Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения:
Золото, некоторые металлы платиновой группы и тантал инертны к азотной кислоте во всём диапазоне концентраций, остальные металлы реагируют с ней, ход реакции при этом определяется её концентрацией.
HNO3 как сильная одноосновная кислота взаимодействует:
а) с основными и амфотерными оксидами:


б) с основаниями:

в) вытесняет слабые кислоты из их солей:

При кипении или под действием света азотная кислота частично разлагается:

Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами, стоящими в ряду напряжений правее водорода:
Концентрированная HNO3

Разбавленная HNO3
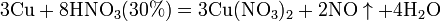
б) с металлами, стоящими в ряду напряжений левее водорода:

Все приведенные выше уравнения отражают только доминирующий ход реакции. Это означает, что в данных условиях продуктов данной реакции больше, чем продуктов других реакций, например, при взаимодействии цинка с азотной кислотой (массовая доля азотной кислоты в растворе 0,3) в продуктах будет содержаться больше всего NO, но также будут содержаться (только в меньших количествах) и NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты  увеличение активности металла
увеличение активности металла
С золотом и платиной азотная кислота, даже концентрированная не взаимодействует. Железо, алюминий, хром холодной концентрированной азотной кислотой пассивируются. С разбавленной азотной кислотой железо взаимодействует, причем в зависимости от концентрации кислоты образуются не только различные продукты восстановления азота, но и различные продукты окисления железа:

Некоторые органические соединения (например амины и гидразин, скипидар) самовоспламеняются при контакте с концентрированной азотной кислотой.
Азотная кислота
Некоторые металлы (железо, хром, алюминий, кобальт, никель, марганец, бериллий), реагирующие с разбавленной азотной кислотой, пассивируются концентрированной азотной кислотой и устойчивы к её воздействию.
Кислоты
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Взаимодействие с основными оксидами с образованием соли и воды:

Взаимодействие с амфотерными оксидами с образованием соли и воды:

Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):

Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:

Взаимодействие с солями, если выпадает осадок или выделяется газ:

Сильные кислоты вытесняют более слабые из их солей:


(в данном случае образуется неустойчивая угольная кислота 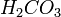 , которая сразу же распадается на воду и углекислый газ)
, которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты  любой концентрации и концентрированной серной кислоты
любой концентрации и концентрированной серной кислоты  ), если образующаяся сольрастворима:
), если образующаяся сольрастворима:

С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:

Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):

Например,

Коррозия
Коррозией называется процесс самопроизвольного разрушения металлов под влиянием внешней среды.
В процессе коррозии происходит переход из металлического состояния в ионное. Коррозия – самопроизвольный процесс, сопровождается уменьшением свободной энергии (ΔG<0), увеличением энтропии системы и определенным энергетическим эффектом.
В некоторых случаях коррозия поражает всю поверхность, в других – часть ее. Характер разрушения зависит от свойств металла и условий протекания процесса. Вот различные виды коррозийных разрушений: равномерное, пятнами, точечное, питтинг, межкристаллитное, растрескивающее, селективное. Наиболее опаснымиявляеютсяпиттинг и межкристаллитное разрушения.
По принципу их протекания все коррозийные процессы принято подразделять на: химические и электрохимические.
Химическая коррозия: самопроизвольное разрушение металлов в среде окисленного газа при повышенных температурах или в жидких неэлектролитах(Уме+х/2О2=МехОу).
Электрохимическая: Разрушение металла при соприкосновении с электролитом с возникновением в системе электрического тока(M-ne> 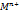 анодное окисление металла; Ox+ne>Red катодное восстановление окислителя). Бывает электрохимическая коррозия с водородной деполяризацией:
анодное окисление металла; Ox+ne>Red катодное восстановление окислителя). Бывает электрохимическая коррозия с водородной деполяризацией:
А:Ме-ze>  ; К: 2
; К: 2 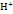 +2е>
+2е>  (pH<7); 2Н2О+2е>
(pH<7); 2Н2О+2е>  +2
+2  (рН>=7).
(рН>=7).
И с кислородной деполяризацией:
А: Ме-ze>  ;
;  +4
+4 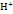 +4е>2Н2О (pH<7);
+4е>2Н2О (pH<7);  +2Н2О+4е>4
+2Н2О+4е>4  (рН>=7).
(рН>=7).
Химическая коррозия: самопроизвольное разрушение металлов в среде окисленного газа при повышенных температурах или в жидких неэлектролитах(Уме+х/2О2=МехОу).
∆  =:∆
=:∆ 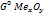 ; ∆G<0 Me будет окисляться.
; ∆G<0 Me будет окисляться.
Скорость окисления металла определяется сплошностью и защитными свойствами оксидной пленки и зависит от наличия в ней трещин и пор.
α=  *
* 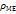 /
/  *
*  *z; α<1 не плотная, не защищает от коррозии;
*z; α<1 не плотная, не защищает от коррозии;
1<α<2,5 защита от коррозии обеспечивается; α>2,5 высокое внутренне напряжение способствует растрескиванию и отслаиванию оксидной пленки.
Газовая коррозия
Уме+х/2О2=МехОу;
Жаростойкое легирование:∆  (легир)<∆
(легир)<∆  . Степень окисления: а) при избытке металла в оксиде основы: nлегир>n; Zn+0.1-1%Al при 660К-скорость коррозии снижается в 100 раз; б) при недостатке металла в оксиде основы: nлегир<n; Ni(т)+Li2O(г), 1370К; в) при nлегир=n;
. Степень окисления: а) при избытке металла в оксиде основы: nлегир>n; Zn+0.1-1%Al при 660К-скорость коррозии снижается в 100 раз; б) при недостатке металла в оксиде основы: nлегир<n; Ni(т)+Li2O(г), 1370К; в) при nлегир=n;  легир<
легир<  где r радиусы атомов. α=VОк/VМе=1,0-2,5.
где r радиусы атомов. α=VОк/VМе=1,0-2,5.
Защитные покрытия: алитирование NH4Cl―>(1200K) NH3+HCl; 2Al+8HCl=3H2+2AlCl3; AlCl3+Fe=FeCl3+Al; Плакирование: Сu+инконель(80%Ni,14%Cr,6%Fe). Жаростойкие эмали: ЭЖ-1000-SiO2, H3BO3, BaCO3, CaCO3, TiO2, ZnO. Тугоплавкие соединения: TiC, SiC.
Защитные атмосферы: Получение: 1) диссоциацией 2NH3  (1000K) N2+3H2; 2) очистка технического азота от О2- 90-96% N2, 10-4% H2; 3) генераторный процесс-из древесного угля: CO+CO2+N2; 4) частичное сжигание: NH3; CO+CO2+H2+H2O+N2.
(1000K) N2+3H2; 2) очистка технического азота от О2- 90-96% N2, 10-4% H2; 3) генераторный процесс-из древесного угля: CO+CO2+N2; 4) частичное сжигание: NH3; CO+CO2+H2+H2O+N2.
Уменьшение окисления металлов: 1) сжигание топлива с недостатком воздуха при термообработке; 2) облегчение образования на металле защитной пленки Mg+SO2+CO2―>MgSO4+MgCO3; 3)защитные обмазки: 50%огнеупорной глины+20%магнезита+5-20% Na2B4O7+2-10%CaO+1-2%NH4Cl; 4) введение в топливо, содержащее V2O5, оксидов, образующих с ним тугоплавкие соединения и уменьшающих налипание золы:CaO, MgO, SiO2.






