1. присоединение и замещение по кратной связи С=О
Механизм реакций присоединения по карбонильной группе близок к механизму присоединения по связи С=С, но начинается с атаки нуклеофильной частицы по атому углерода карбонильной группы (AdN). Атака нуклеофила направлена перпендикулярно плоскости карбонильной группы и на первой стадии образуется тетраэдрический интермедиат. По большей части данная стадия носит обратимый характер.
В дальнейшем возможны два пути развития этой реакции – тетраэдрический анионный интермедиат подвергается протонированию по атому кислорода с образованием нейтральной молекулы «продукта присоединения», либо нейтральный интермедиат подвергается дегидратации и образуется «продукт замещения карбонильной группы». В связи с тем, что вероятность подхода нуклеофильной частицы одинакова с обеих сторон от плоскости карбонильной группы, продукт присоединения образуется в виде рацемата.
Кетоны и особенно альдегиды способны обратимо взаимодействовать с водой по типу реакции присоединения. В большинстве случаев равновесие смещено в сторону карбонильного соединения. Однако при наличии акцепторных групп по соседству с карбонильной функцией равновесие смещается в сторону гидрата. Так, трихлоруксусный альдегид (2,2,2-трихлорэтаналь) и гексафторацетон присутствуют в водном растворе только в виде гидрата и выделяются из раствора тоже в виде продукта присоединения воды.

По первому пути присоединяются спирты и тиолы с образованием ацеталей (кеталей) и тиоацеталей (тиокеталей) соответственно.

По этому же пути образуются циангидрины и бисульфитные производные альдегидов и кетонов. Альдегиды, как правило, более реакционноспособны в реакциях нуклеофильного присоединения и замещения чем кетоны. Это объясняется меньшими стерическими препятствиями у альдегидов для атаки.

Следует отметить, что в реакцию с бисульфитом натрия вступают только альдегиды и кетоны, в которых хотя бы один из заместителей - метил. Взаимодействие карбонильных соединений с бисульфитом натрия – процесс обратимый, для получения препаративных выходов используют большой избыток бисульфита натрия. Обратимость этой реакции часто используют для выделения и очистки некоторых карбонильных соединений из реакционных смесей.
По типу реакции замещения с альдегидами и кетонами реагируют аммиак и другие азотистые основания. Промежуточно образующийся полуаминаль (или его аналоги) легко (в большинстве случаев самопроизвольно) отщепляет молекулу воды с образованием кратной связи C=N.
В данную реакцию помимо аммиака (NH3) с образованием имина, вступают гидроксиламин (NH2OH) - образуется оксим, гидразин (NH2NH2) и его производные, (NH2NHR) – образуются гидразоны, а также семикарбазид (NH2NHC(O)NH2) с образованием семикарбазона. Под действием P2S5 карбонильные соединения способны образовывать тиоальдегиды и тиокетоны (соединения содержащие группу С=S).
Пример: реакция ацетона с гидразином.
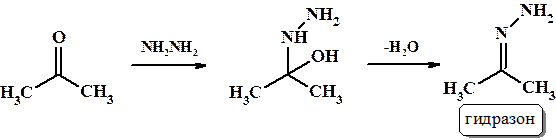
Одной из важнейших реакций альдегидов и кетонов является нуклеофильное присоединение реактивов Гриньяра. Как уже говорилось ранее, из-за обращения полярности атом углерода магнийорганическое соединение проявляет нуклеофильные свойства и легко вступает в реакцию с разнообразными карбонильными соединениями.
В отличие от многих реакций присоединения по карбонильной группе, взаимодействие с RMgHal протекает необратимо, и в результате образуются алкоголяты магния, которые после гидролиза превращаются в спирты. Как и в случае образования циангидринов, данная реакция решает одну из важнейших задач органической химии – направленное образование связи углерод-углерод.

Как и другие продукты присоединения по карбонильной группе, образующиеся спирты оптически не активны (являются рацемическими смесями).
Енолизация и реакции енольной формы.
 Карбонильные соединения, содержащие водородные атомы при атоме углерода в соседнем с карбонильной группой положении, в растворе и в жидком состоянии находятся в равновесии со своей так называемой енольной формой. Следует отметить, что в большинстве случаев это равновесие сильно смещено в сторону карбонильного соединения. Однако под действием оснований кето-енольное равновесие смещается за счет связывания проявляющего более сильные кислотные свойства енола в енолят анион.
Карбонильные соединения, содержащие водородные атомы при атоме углерода в соседнем с карбонильной группой положении, в растворе и в жидком состоянии находятся в равновесии со своей так называемой енольной формой. Следует отметить, что в большинстве случаев это равновесие сильно смещено в сторону карбонильного соединения. Однако под действием оснований кето-енольное равновесие смещается за счет связывания проявляющего более сильные кислотные свойства енола в енолят анион.

 Енол, и енолят анион проявляют свойства нуклеофилов. Енолят анион может нести отрицательный заряд как на атоме кислорода, так и на углероде соседнем с карбонильной группой и следовательно может атаковать субстрат двумя способами. Заряженные частицы, имеющие два активных центра, называют «амбидентные ионы». В данном случае енолят анион проявляет свойства амбидентного нуклеофила.
Енол, и енолят анион проявляют свойства нуклеофилов. Енолят анион может нести отрицательный заряд как на атоме кислорода, так и на углероде соседнем с карбонильной группой и следовательно может атаковать субстрат двумя способами. Заряженные частицы, имеющие два активных центра, называют «амбидентные ионы». В данном случае енолят анион проявляет свойства амбидентного нуклеофила.
Енол, и особенно енолят анион, как и другие нуклеофильные реагенты, способны атаковать карбонильную группу. Причем, атака осуществляется, как правило, углеродным концом амбидентного нуклеофила.
Это процесс называется Альдольно-кротоновая конденсация. На схеме представлен процесс альдольно-кротоновой конденсации на примере пропанона-2 (ацетона).
 Под действием основания часть молекул карбонильного соединения переходят в форму енолята, который нуклеофильно атакует неенолизованную молекулу по карбонильной группе. В результате реакции, на первой стадии образуется продукт альдольной конденсации – кетоспирт (в данном примере 4-гидрокси-4-метилпентанон-2), а после элиминирования воды (иногда для этого необходимо нагревание) образуется α,β-непредельное карбонильное соединение – продукт кротоновой конденсации (в случае ацетона образуется 4-метилпентен-3-он-2 «окись мезитила»). Так же как и в других процессах нуклеофильного замещения альдольно-кротоновая конденсация легче протекает для альдегидов чем для кетонов. Большинство альдегидов удовлетворяющих требованиям данной реакции медленно конденсируются просто при хранении, кетоны же непременно требуют присутствия катализатора. Вышеописанная реакция конденсации ацетона на самом деле равновесна, и содержание альдоля в смеси достаточно низко. Равновесие смещают, выводя продукт конденсации из сферы реакции.
Под действием основания часть молекул карбонильного соединения переходят в форму енолята, который нуклеофильно атакует неенолизованную молекулу по карбонильной группе. В результате реакции, на первой стадии образуется продукт альдольной конденсации – кетоспирт (в данном примере 4-гидрокси-4-метилпентанон-2), а после элиминирования воды (иногда для этого необходимо нагревание) образуется α,β-непредельное карбонильное соединение – продукт кротоновой конденсации (в случае ацетона образуется 4-метилпентен-3-он-2 «окись мезитила»). Так же как и в других процессах нуклеофильного замещения альдольно-кротоновая конденсация легче протекает для альдегидов чем для кетонов. Большинство альдегидов удовлетворяющих требованиям данной реакции медленно конденсируются просто при хранении, кетоны же непременно требуют присутствия катализатора. Вышеописанная реакция конденсации ацетона на самом деле равновесна, и содержание альдоля в смеси достаточно низко. Равновесие смещают, выводя продукт конденсации из сферы реакции.
Реакции окисления и восстановления. Как уже упоминалось в главе 11, альдегиды легко окисляются под действием различных окислителей, таких как K2Cr2O7, KMnO4, HNO3 и др. (во многих случаях кислородом воздуха), с образованием карбоновых кислот. Кетоны в этих условиях устойчивы к окислению.
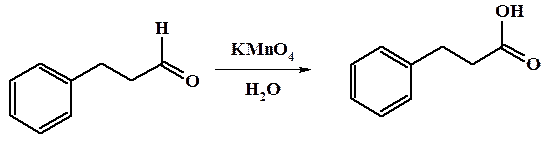
В более жестких условиях кетоны подвергаются окислению до смеси карбоновых кислот с разрывом одной из связей С-С соседней с карбонильной функцией.
Следует разделять понятия окисление и горение. В случае окисления подразумевают модификацию какой-либо функциональной группы или нескольких групп без серьезного нарушения цельности молекулы. Горением называют процесс полного разрушения органической молекулы под действием окислителя с образованием СО2 и воды.
Восстановление альдегидов и кетонов до соответствующих спиртов гладко протекает под действием водорода на платиновых или палладиевых катализаторах, а также металлокомплексными гидридами, такими как LiAlH4 в диэтиловом эфире или ТГФ и NaBH4 в этиловом или метиловом спирте или в водном растворе NaOH.

Реакция образования алкенов (реакция Виттига)
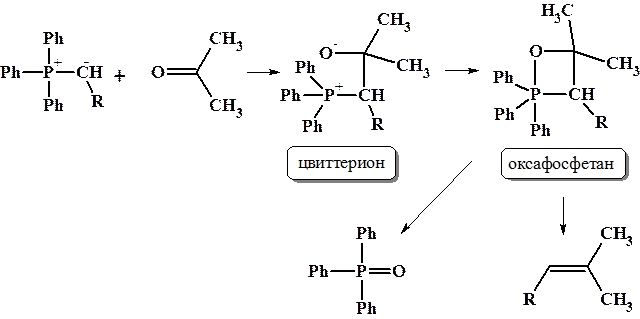
Реакция Виттига – редкий пример регио- и стерео-селективного образования двойной связи С=С из карбонильной группы С=О. Для проведения данной реакции используют т.н. реактивы Виттига, представляющие собой илиды фосфора (фосфораны). Последние, образуются действием сильных оснований (NaH, NaNH2, ((CH3)3Si)2NNa, BuLi) на четвертичные фосфониевые соли. Как правило, в качестве фосфиновой компоненты используют трифенилфосфин, с которым вводят в реакцию необходимый алкилгалогенид.

Полученный илид водят в реакцию с карбонильным соединением. Первоначальная нуклеофильная атака приводит к образованию цвиттериона, который быстро циклизуется в нестабильный оксафосфетан. Последний подвергается цис-элиминированию с образованием алкена и трифенилфосфиноксида.
Реакция Виттига широко используется в промышленном синтезе сложных природных молекул, например синтез витамина А1, где одной из стадий построения полиеновой цепи является олифинирование по Виттигу.






