Глава 13. Карбонильные соединения. Альдегиды и кетоны.
К карбонильным соединениям относятся очень широкий спектр органических молекул содержащих группировку С=О (т.н. карбонильную группу). В таблице представлены названия основных типов соединений, содержащих карбонильный фрагмент.
Номенклатура основных типов карбонильных соединений.

| Х | Карбонильное соединение |
| H | альдегид | |
| Alk (Ar) | кетон | |
| OH | карбоновая кислота | |
| O-Alk | сложный эфир карбоновой кислоты | |
| OC(O)R | ангидрид кислоты | |
| NH2 | амид кислоты | |
| Cl (Br) | хлорангидрид (бромангидрид) кислоты |
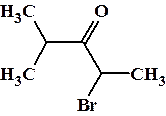 Карбонильная функция с точки зрения номенклатуры является одной из старших, поэтому в большинстве случаев она упоминается в окончании. Для альдегидной группы окончание –аль, для кетонной окончание –он. В случае присутствия в молекуле более старшей группы, например карбоксильной, альдегидная и кетонная функции упоминаются в приставке (оксо-).
Карбонильная функция с точки зрения номенклатуры является одной из старших, поэтому в большинстве случаев она упоминается в окончании. Для альдегидной группы окончание –аль, для кетонной окончание –он. В случае присутствия в молекуле более старшей группы, например карбоксильной, альдегидная и кетонная функции упоминаются в приставке (оксо-).
Примеры: 2-бром-4-метилпентанон-3

4-оксо-2-этилбутановая кислота,
4-оксо-2-этилмасляная кислота
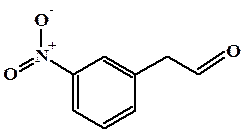
2-(3-нитрофенил)этаналь
3-нитрофениуксусный альдегид
Методы получения альдегидов и кетонов.
1. Окисление первичных спиртов до альдегидов и вторичных спиртов до кетонов под действием K2Cr2O7, KMnO4 и др. (см. Ч.2 главу 11).
2. Озонолиз алкенов и полиенов с последующим восстановительным или нейтральным расщеплением озонидов. В последнее время те же продукты получают деструкцией алкенов под действием тетроксида осмия (OsO4) с последующей обработкой периодатом натрия (NaIO4). (см Ч.1 главу 6)
3. Получение кетонов гидратацией ацетиленов в присутствии солей ртути – реакция Кучерова (см. Ч.1 главу 7) Продукт образуется в соответствии с правилом Марковникова.

4. Получение альдегидов и кетонов гидроборированием ацетиленов с последующим окислительным расщеплением.

5. Каталитическое восстановление хлорангидридов карбоновых кислот водородом и метилокомплексными гидридами.
6. Взаимодействие реактивов Гриньяра с хлорангидридами, амидами и сложными эфмрами карбоновых кислот (см. Ч.2 главу 13).
7. Термолиз Ca, Ba, Mn, Th солей карбоновых кислот.

Этим способом можно получить многие симметричные, и даже некоторые несимметричные кетоны.
Свойства карбонильной группы

 Кислород карбонильной группы проявляет -I и -M эффекты относительно атома углерода, и как следствие, вся карбонильная группа проявляет те же эффекты относительно соседних атомов углерода и их заместителей. Для простейшего карбонильного соединения – формальдегида (см. рисунок) определена следующая геометрия: длина связей С=О 1,20 Ǻ, С-Н 1,10 Ǻ, угол Н-С-Н 116,5˚, все четыре атома лежат в одной плоскости. Атомы углерода и кислорода, образующие карбонильную группу находится в sp2 гибридизованном состоянии.
Кислород карбонильной группы проявляет -I и -M эффекты относительно атома углерода, и как следствие, вся карбонильная группа проявляет те же эффекты относительно соседних атомов углерода и их заместителей. Для простейшего карбонильного соединения – формальдегида (см. рисунок) определена следующая геометрия: длина связей С=О 1,20 Ǻ, С-Н 1,10 Ǻ, угол Н-С-Н 116,5˚, все четыре атома лежат в одной плоскости. Атомы углерода и кислорода, образующие карбонильную группу находится в sp2 гибридизованном состоянии.
Реакционная способность карбонильной группы связана, во первых с присутствием элемента ненасыщенности, и поэтому, как и кратные С=С связи, она вступает в реакции присоединения, разница заключается в том, что карбонильная группа изначально поляризована (μ=2,7-3,05 D) и направление присоединения диполя однозначно. Причем, первичная атака осуществляется нуклеофильной частицей AdN.
Кроме разницы в электроотрицательности вклад в дипольный момент вносит и наличие двух неподеленных пар электронов кислорода (на рисунке показаны точками). Так как данные пары лежат в плоскости карбонильной группы, они не могут перекрываться с π-электронными облаками кратной связи С=О. Поэтому, в отличие от гидроксильной группы в спиртах и фенолах кислород карбонильной группы не может проявлять +М эффект за счет подачи электронной плотности с одной из неподеленных пар электронов.
В связи с наличием свободных электронных пар кислорода альдегиды и кетоны проявляют свойства слабых оснований. Протонирование карбонильного кислорода наблюдается только в концентрированных растворах сильных минеральных кислот.
За счет электроноакцепторных свойств карбонильной группы в целом, она облегчает нуклеофильное замещение у атома углерода соседнего с группой С=О.






