Лабораторная работа №1. УГЛЕВОДОРОДЫ
ОПЫТ 1. Получение метана и его свойства
Необходимые реактивы и оборудование
1. Пробирки (2шт).
2. Трубка газоотводная изогнутая.
3. Смесь безводного ацетата натрия СН3СООNа и прокаленной натронной извести (смесь NаОН и Са(ОH)2) (1:2).
4. Раствор перманганата калия KМnО4 сильно разбавленный.
5. Карбонат натрия Na2СО3 – 5%-ный раствор.
6. Бромная вода - насыщенный раствор (Вг2/H2O).
В сухую пробирку насыпать смесь для получения метана (высота слоя около 4 см). Разместить смесь так, чтобы образующийся метан СН4 мог выходить из пробирки, закрыть пробирку пробкой с газоотводной трубкой и закрепить ее в штативе с небольшим наклоном в сторону пробки. В штатив поставить две пробирки: одну пробирку со смесью 3 мл разбавленного раствора перманганата калия КМnО4 и 1 мл 5%-ного раствора карбоната натрия NаСО3 и вторую пробирку с 3 мл бромной воды. Прогреть сначала всю пробирку, затем сильно нагреть ту ее часть, где находится смесь, начиная от дна пробирки, а затем, передвигая горелку дальше, чтобы могли реагировать новые порции смеси. Сначала из пробирки вытесняется воздух, затем начинается выделение метана СН4. К отверстию трубки время от времени подносить горящую спичку. Наблюдать горение выделяющегося газа. Метан горит голубоватым, несветящимся пламенем. Написать уравнение реакции горения метана. Внести в пламя горящего метана фарфоровую крышку от тигля. Почему на крышке не образуется черного пятна сажи?
Напишите уравнение реакции получения метана СН4 (из ацетата натрия СН3СООNа и гидрооксида натрия NaOH).
Ввести газоотводную трубку в пробирку с бромной водой и пропускать в течение 1 мин метан. Исчезает ли окраска бромной воды? Затем пропустить метан через раствор перманганата калия. Что вы наблюдаете? Сделайте вывод об отношении метана к бромной воде и к водному раствору перманганата калия (при комнатной температуре).
ОПЫТ 2. Получение этилена и его свойства
Необходимые реактивы и оборудование
1. Пробирки.
2. Кипятильники (кусочки битого фарфора, пемзы, кварцевый песок).
3. Хлоркальциевая трубка с натронной известью.
4. Газоотводные трубки.
5. Смесь этилового спирта С2Н2ОН 96%-ного и серной кислоты концентрированной в объемном отношении 1:2.
6. Бромная вода насыщенная.
7. Перманганат калия КМnО4, 2%-ный раствор.
8. Карбонат натрия NаСОз 10%-ный раствор.
9. Перманганат калия КМnO4, 1%-ный раствор.
10.Серная кислота H2SO4 концентрированная.
В сухую пробирку налить 5 мл смеси для получения этилен С2Н4 (этиловый спирт и концентрированная серная кислота в объемном отношении 1:2). При смешивании этанола с серной кислотой образуется этил серная кислота - кислый сложный эфир:
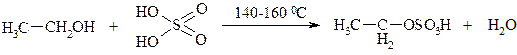
.
В реакционную смесь поместить несколько кипятильников (кусочков битого фарфора, кварцевого песка и т.д.) – для равномерного кипения реакционной смеси, закрыть пробирку пробкой с газоотводной трубкой и закрепить ее в штативе. В середину газоотводной трубки вставить хлоркальциевую трубку с натронной известью, помещенной между двумя неплотными ватными тампонами. Натронная известь должна быть в виде кусочков, газообразные вещества должны свободно проводить через нее (в противном случае может быть несчастный случай: если выход для газов закрыт, под их давлением пробка может выскочить и кипящая реакционная смесь, содержащая концентрированную серную кислоту, будет выброшена из пробирки).
В штатив поставить пробирку с 2 мл бромной воды.
Пробирку со смесью для получения этилена осторожно нагреть, следя за тем, чтобы вспенивающуюся жидкость не перебросило в хлоркалъциевую трубку. Выделяющийся этилен пропустить через бромную воду, которая быстро обесцвечивается (качественная реакция на кратные связи).
При нагревании этилсерная кислота разлагается на этилен и серную кислоту:

Серная кислота играет каталитическую роль, однако дегиратирующее действие ее уменьшается по мере разбавления водой, выделяющейся при реакции.
Этилен реагирует с бромной водой по электрофильному механизму (АЕ), легко присоединяют по двойной связи молекулу брома с образованием дибромпроизводного. Какую роль в этой реакции играет вода?

В пробирку налить 2 мл 2%-ного раствора перманганата калия, добавить 0,5 мл 10%-ного раствора соды и пропустить этилен.
Фиолетовая окраска раствора перманганата калия исчезает, образуется хлопьевидный осадок бурого цвета. Если этилен пропускать долго, осадок может раствориться. Реакция этилена с водным раствором KMnO4, называется реакцией Е.Е. Вагнера. При окислении этилена в условиях реакции Вагнера образуется двухатомный спирт - этиленгликоль:

–
Реакция Вагнера – качественная реакция на кратные связи. Какую роль в этой реакции играет раствор Na2СО3? Напишите уравнение реакции гидролиза карбоната натрия.
В пробирку налить 2 мл 1%-ного раствора перманганата калия, добавить 1 каплю концентрированной серной кислоты и пропустить этилен. Раствор быстро обесцвечивается, бурые хлопья не образуются, так как окисление проходит более глубоко:

Подберите коэффициенты в приведенном уравнении и укажите окислитель и восстановитель.
Поджечь этилен у конца газоотводной трубки. Этилен горит светящимся пламенем. Внесите в пламя этилена крышку от тигля. Объясните, почему на крышке образуется черное пятно.
Напишите уравнение реакции горения этилена.






