Мысль о возможности поддержания жизнедеятельности организма с помощью ИК, по свидетельству С.С. Брюхоненко и С.. И. Чечулина (1928), была высказана LeGallois в 1812 г. Однако прошло более 100 лет, прежде чем С.С. Брюхоненко в 1924 г. сконструировал первый в мире АИК, названный им автожектором. С его помощью были проведены успешные эксперименты по перфузии головы собаки, отделенной от туловища.
Усовершенствование автожектора позволило С.С. Брюхоненко впервые в мире осуществить ИК целостного организма собаки. Начало выдающемуся достижению медицины XX в было положено. Однако приоритет С.С. Брюхоненко был признан только после опубликования статьи W Probert и D. Melrose (I960). «Ранний русский аппарат сердце—легкие». Этот факт подтверждает и известный американский анестезиолог L. Rendel-Baker (1963) «.. Только недавно нам стало известно о значительно более ранних сериях успешных перфузии собак, произведенных С.С. Брюхоненко в 1929 г. К несчастью, эта работа была опубликована в русской и французской литературе, где и осталась похороненной». Остается только удивляться, что подобное произошло с изобретением, запатентованным в 1929 г. в Германии и Англии и в 1930 г во Франции. Сами же работы были опубликованы «Journal Physiology et Pathology General», 1929, Vol 27, № 1. И уже совершенно непонятно, когда тот же D. Melrose, в I960 г. восстановивший приоритет С. С Брюхоненко, через 26 лет в книге «Cardiopulmonary bypass», вышедшей в 1986 г. под редакцией К Taylor, и С. Lake в книге «Cardiovascular anesthesia» (1985) основоположником метода ИК называют J. Gibbon. Только в 1937 г. этот автор провел успешные эксперименты с искусственным кровообращением на кошках. С помощью сконструированного им аппарата, состоящего из насоса и оксигенатора, он пережимал легочную артерию на 25 мин, вскрывал ее и демонстрировал возможность эмболэктомии. Начавшаяся вскоре Вторая мировая война затормозила работы в области ИК. Симптоматично, что в первые послевоенные годы наибольших успехов достигли ученые стран, не пострадавших в войне (США, Швеция). Были созданы более совершенные модели АИК, с помощью которых уже можно было провести общую перфузию у человека [Gibbon J. et al., 1948; Crafoord С. et al., 1948, Jongbloed D., 1919]
В 1951 г. С. Dennis и соавт. впервые применили ИК у человека, однако больная с дефектом межпредсердной перегородки умерла на операционном столе от сердечной недостаточности.
Наконец, в 1953 г. J. Gibbon выполнил первую успешную операцию по поводу дефекта межжелудочковой перегородки в условиях общей перфузии организма. С 1955 г. метод стал применяться в различных странах. Этому способствовали работы D. Kirklm и соавт. из клиники Мауо (США). Авторы модифицировали аппарат Гиббона и стали оперировать с объемной скоростью, равной или близкой к нормальному сердечному выбросу.
В СССР работы по созданию клинических моделей АИК были начаты в 1952 г. (Е.А. Вайнриб и сотр.). В 1957 г. А.А. Вишневский с помощью второй модели АИК-57 произвел первую успешную операцию на открытом сердце, а спустя 2 года метод стал применяться в ведущих учреждениях страны, руководимых Н.М. Амосовым, А.Н. Бакулевым, А.А. Вишневским, П.А. Куприяновым, Б.В. Петровским, Ф. Г. Угловым и др.
В настоящее время метод ИК широко применяется во всем мире. Сконструированные в 50-х годах образцы АИК по праву заняли место в музеях. На смену им пришли новые, оснащенные современной электронной техникой аппараты с одноразовыми оксигенаторами, теплообменниками, фильтрами, канюлями и т.д. Сам по себе метод ИК практически стал совершенно безопасным. Об этом свидетельствуют сотни тысяч успешных операций, проводимых ежегодно в разных странах [Tinker J., 1989].
Аппараты ИК. Насосы. Современные насосы АИК должны обладать производительностью 4-5 л/мин, т.е. приблизительно равной минутному объему сердца в покое. Главными требованиями ко всем конструкциям насосов являются минимальное повреждение форменных элементов крови и высокая надежность.
Различают клапанные (мембранный, камерный) и бесклапанные (роликовый, пальчиковый) насосы, которые создают пульсирующий поток различной амплитуды. В литературе существуют противоположные точки зрения относительно целесообразности использования насосов с малой или большой амплитудой [Taylor К., 1984; Hdmund L., 1982; Philbin D. et al., 1982].
Сторонники насосов с большой амплитудой (пульсирующий поток) подчеркивают их физиологичность, лучшее кровоснабжение миокарда, больший диурез, выраженный капиллярный кровоток, минимальный ацидоз, уменьшение периферического сопротивления и др. [Waaben A. et al., 1985]. Позиция же их противников основывается на увеличении гемолиза вследствие повышенной турбулентности из-за быстрого ускорения и замедления кровотока, а также усложнением насосов и других технических средств в АИК, тем более, что системные показатели кровообращения среднее артериальное давление и общее периферическое сопротивление практически не меняются как при пульсирующем, гак и при непульсирующем кровотоке [Осипов В.П., 1976].
Разумно поступили конструкторы фирмы «Stockert» (ФРГ), предусмотрев возможность применения пульсирующего и непульсирующего кровотока в одном АИК.
Оксигенаторы. Технические устройства, временно заменяющие оксигенирующую функцию легких, подразделяются на две группы: 1) оксигенаторы, где кровь и кислород непосредственно контактируют друг с другом; 2) оксигенаторы, где между кровью и кислородом имеется газопроницаемая мембрана. К первой группе относятся пузырьковые и пленочные оксигенагоры, ко второй — мембранные.
Пузырьковые оксигенaторы в свою очередь делятся на прямоточные и противоточные в зависимости от направления потоков газа и крови [Осипов В.П., 1976].
Характерными представителями прямоточного оксигенатора являются оксигенатор де Волла — Миллихая, сконструированный в 1956 г. в США, и все последующие его модификации. К подгруппе пузырьковых оксигенаторов относятся и современные одноразовые оксигенирующие системы различных фирм: «Bentley» (США), «Shiley» (США), «Harvey» (США), «Gambro» (Швеция).
Недостатками прямоточных пузырьковых оксигенаторов являются мощный поток кислорода и связанный с этим гемолиз, а также вспенивание и последующий переход в жидкое состояние всего объема крови, проходящего через оксигенатор [Осипов В.П., 1976].
Кислород, поступающий в кровь из нижней части пузырькового оксигенатора противоточного типа, создает пенный столб (экран), навстречу которому из верхней части оксигенатора стекает венозная кровь. Этот принцип более экономичен и эффективен. Расход кислорода и количество крови существенно меньше, чем в прямоточных оксигенаторах. Из-за вспенивания небольшой части притекающей венозной крови меньше травмируются форменные элементы крови. Недостатком указанных оксигенаторов является сложность управления, обусловленная необходимостью постоянного наличия пенного столба [Осипов В.П., 1976]. Оксигенаторами указанного типа были снабжены различные модификации отечественных АИК.
Пленочные оксигенаторы. Как свидетельствует название этих технических устройств, оксигенация происходит при контакте пленки крови, образовавшейся на какой-либо твердой поверхности, с кислородом. Различают стационарные и ротационные пленочные оксигенаторы.
В стационарных оксигенаторах кровь стекает по неподвижным экранам, которые находятся в атмосфере кислорода. Примером является оксигенатор Гиббона, с помощью которого была проведена первая успешная операция на сердце с ИК.
Основными недостатками экранных оксигенаторов являются их дороговизна, плохая управляемость, громоздкость конструкции и необходимость большого количества донорской крови. Более эффективны ротационные оксигенаторы. К ним относятся популярные в прошлом дисковый оксигенатор Кея — Кросса и цилиндровый оксигенатор Крафорда — Сеннинга.
Пленка крови, образующаяся на поверхности вращающихся дисков или цилиндров, контактирует с кислородом, подаваемым в оксигенатор. Производительность ротационных оксигенаторов в отличие от экранных может быть увеличена за счет повышения скорости вращения дисков (цилиндров).
В заключение отметим, что рассмотренные пленочные и пузырьковые оксигенаторы многоразового пользования имеют исторический интерес. На смену им пришли оксигенаторы одноразового пользования в комплекте с теплообменником, артериальным и венозным резервуарами, специальной «антифомной» (силикон) секцией внутри оксигенатора, газовыми и жидкостными фильтрами, набором канюль и катетеров. Нет необходимости подчеркивать, что все это находится в стерильных упаковках. Наибольшей популярностью пользуются оксигенаторы фирм «Bentley» (США), «Harvey» (США), «Shiley» (США), «Polystan» (Дания), «Gambro» (Швеция) и др. Эти оксигенаторы полностью удовлетворяют запросы современной кардиохирургии и кардиоанестезиологии. Однако если необходима длительная (более 4 ч) искусственная оксигенация крови, то вредное действие прямого контакта крови с кислородом и углекислым газом становится небезразличным для организма. Антифизиологичность этого феномена проявляется изменением электрокинетических сил, нарушением нормальной конфигурации молекул белков и их денатурацией, агрегацией тромбоцитов, выбросом кининов и т.д. [Bethume I)., 1986]. Во избежание этого при длительных перфузиях более целесообразно пользоваться мембранными оксигенаторами.
Мембранные оксигенаторы. Первый мембранный оксигенатор небольших размеров был сконструирован W. Kolff и с успехом испытан в эксперименте D. Effler в 1956 г В гом же году О. Olowes и соавт. применили в клинике больших размеров мембранные легкие, используя полиэтиленовые, затем теф-лоновые мембраны. В 1958 г. G. Clowes сообщил о 100 больных, у которых были использованы мембранные легкие. В последующие годы были созданы более эффективные и менее громоздкие модели с использованием в качестве мембраны полимера силикона и поликарбоната [Peirce Е., 1970], силиконизированного угля [Kolobow Т. et al., 1963, 1971]. Первые одноразовые оксшенаторы с мембраной для микропористого полипропилена были применены в клинике при операциях на сердце J. Hill и соавт. в 1975 г. В аналитическом обзоре М. Bramson и соавт. (1981) сообщается об использовании мембранных оксигенаторов более чем у 500 больных при операциях на сердце и у 35 при острой дыхательной недостаточности в течение нескольких дней. Наибольший срок 21 день.
Другая модель оксигенаторов с использованием силиконовых мембран оыла сконструирована A. Lande в 1967 г., и ее начала выпускать фирма «Edwards Laboratories» (США). В последующие 10 лег ее использовали во многих странах [Lande A. et al., 1970; Carleson R. et al., 1973; Birnbaum D. et al., 1979, и др.].
В настоящее время наибольшей популярностью пользуются мембранные эксигенаторы «Cobe membrane Lung» (США) производительностью 6 л/мин с мембраной из микропористого полипропилена, «Sci. Med. membrane oxygenaors» (США) - спиральный компактный с метилсиликоновой мембраной, «Terumo Capiox Oxygenalor» (Япония) — с мембраной из микропористого полипропилена, с помощью которого Suma и соавт. произвели более 100 операций на открытом сердце у больных с массой тела 4,8—78 кг, «Travenol membrane oxygenator» (США) с мембраной из микропористого тефлона, с помощью которого было выполнено более 4000 операций [Cosgrovz D., Loop E., 1981)
В заключение следует подчеркнуть, что преимущества мембранных оксигенаторов выявляются после двухчасовой перфузии [Lake С., 1985]. При этом отмечаются меньший гемолиз, менее выраженное снижение числа лейкоцитов и содержания иммуноглобулинов IgG, IgM. Воздействие на гемодинамику выражается и в снижении периферического сопротивления, увеличении диуреза. Поскольку большинство операций на сердце проводятся в пределах 2 ч, перспективы мембранных оксигенаторов в хирургии сердца пока проблематичны [Lake С., 1985] При длительных же перфузиях в реаниматологической практике их преимущество бесспорно.
Коронарный отсос. Любой АИК, как правило, снабжен системой коронарного отсоса для удаления крови из полостей сердца и оперативной раны и возвращения ее в оксигенатор АПК. Следует подчеркнуть, что коронарным отсосом можно пользоваться только в условиях гепаринизации больного. Сразу после введения протамина сульфата для нейтрализации гепарина (по окончании ПК) необходимо отсасывать кровь обычным отсосом В. противном случае может свернуться кровь, оставшаяся в оксигенаторе, которою обычно нагнетают больному в ближайшие 10-20 мин после перфузии. Отметим также, что именно в системе коронарного отсоса происходит наибольший гемолиз, особенно если применяется вакуумный принцип. При использовании роликовых насосов гемолиз менее выражен. В современных аппаратах имеется несколько таких насосов с раздельной регуляцией их производительности.
Теплообменник. Для экстракорпоралыюго охлаждения и согревания крови АИК снабжают теплобменником. Обычно его монтируют на пути артериальной магистрали. Различают трубчатые и щелевые теплообменники.
Кровь, протекая по трубкам, охлаждается (согревается) водой, циркулирующей в цилиндре, внутри которого расположены трубки (рис. 17.6). В настоящее время теплообменники выпускаются в комплекте с оксигенаторами в одноразовом исполнении.
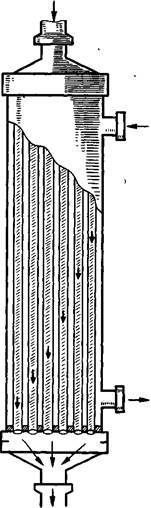
Рис. 17.6. Трубчатый теплообменник (схема)
Фильтры. Современная аппаратура ИК, как правило, снабжена фильтрами для жидких сред и газов. Это необходимое условие при проведении общей перфузии организма, гарантирующее безопасность больного. Фильтры для крови с отверстиями диаметром 40 мкм устанавливаются на линии артериальной магистрали, в системах коронарного отсоса и в рециркуляционной линии. В системе для введения кардиоплегического раствора также устанавливаются специальные фильтры. Необходимость в фильтрах различного назначения, задерживающих микрочастицы, бактерии, пузырьки газа, обусловлена большим числом осложнений и летальных исходов вследствие эмболии сосудов головного мозга и других жизненно важных органов [Hill J. et al., 1969; Patterson R. et al., 1974]. Для реальной оценки этой опасности потребовалось 17 лет со дня первой операции с ИК в 1953 г. Появление первых серийно выпущенных фильтров в 1970 г., изготовленных фирмами «Pioner-Swank» (США) и «Pall» (ФРГ) для установки на артериальной магистрали и системе коронарного отсоса, положило начало новому периоду в хирургии открытого сердца, гарантирующему полную безопасность самого метода ИК. Надо признать, что в ведущих клиниках мира этот уровень достигнут. Летальность, связанная с ИК, практически отсутствует.
Следует иметь в виду, что микрочастицы и газовые пузырьки могут поступить в ток крови из разных источников и на различных этапах операции и ИК. Большую опасность представляет консервированная донорская кровь, в которой еще до перфузии содержится значительное количество микроагрегатов дегенерированных тромбоцитов, гранулоцитов, эритроцитов и фибрина [Solis R. et al., 1974]. Микрочастицы неорганического происхождения могут остаться в резервуарах оксигенатора, канюлях и др. в процессе их изготовления [Clark R. et al., 1975]. Во время операции в АИК могут поступать через систему коронарного отсоса микрочастицы кости и тканей (подкожная клетчатка, мышцы и т.д). Другим источником образования микроагрегатов являются механическая травма крови роликовыми насосами, коронарным отсосом, при взаимодействии кислорода с кровью, денатурации белков и повреждении клеточных компонентов и, наконец, реакция последних с инородными материалами АИК [Jones H. et. al., 1982].
Существенную опасность представляет и газовая эмболия. Микропузырьки газа могут попасть в артериальную магистраль АИК из оксигенатора. Антиформ успешно гасит крупные пузырьки, но не всегда мелкие [Patterson R. et al., 1982; Semb В. et al., 1982]. Проблему не решают и мембранные оксигенаторы, так как могут иметь место незаметные микроповреждения самой мембраны. Недостаточный градиент давления между газом и кровью по обе стороны мембраны может также способствовать образованию микропузырьков газа в крови. Подобное происходит и при быстром и избыточном согревании крови в теплообменнике. Наконец, газ может проникнуть в артериальную канюлю вследствие механических повреждений различных частей АИК. При крупных повреждениях наблюдаются массивные газовые эмболии с высокой летальностью [Mills N. et al., 1980; Stone W. et al, 1980]. Мы были свидетелями массивной газовой эмболии, произошедшей из-за технической ошибки, когда насос, вместо того чтобы отсасывать кровь из сердца, начал нагнетать воздух в левый желудочек. Произошла массивная эмболия сосудов головного мозга. Больную удалось спасти, быстро охладив с помощью АЙК и проведя гипербарическую оксигенацию тотчас после доставки из операционной 0,7 МПа (7 ати).
Современные фильтры, устанавливаемые на линии артериальной магистрали, не только способны задержать мелкие пузырьки газа, но эффективны и при массивной эмболии.
Фильтры изготавливают из нейлона, полистера или дакрона. Размеры пор от 12 до 40 мкм. Для инфузии кардиоплегических растворов, не содержащих крови, применяют фильтры с порами диаметром 0,2 мкм. Согласно данным литературы [Hill J. et al, 19701, микрофильтры позволили снизить летальность с 19,8 до 6,5%, а число мозговых осложнений с 31 до 4,2%. По данным A. Wilner и соавт. (1983), число неврологических осложнений было снижено до минимума при применении фильтров, у которых диаметр пор составляет 40 мкм. При использовании фильтров с порами диаметром 25 мкм осложнения практически исчезли.
Методика проведения ИК. Мониторинг. ИК требует тщательного многостороннего контроля за функциями жизненно важных органов и систем. Некоторые из показателей анестезиологи и перфузиологи получают в виде мониторинга, т.е. постоянно, другие - периодически на различных этапах операции и перфузии. Под непосредственным контролем перфузиолога находятся приборы, дающие информацию в режиме мониторинга о производительности артериального и отсасывающих насосов, температуре артериальной крови, охлаждающей и согревающей воды, циркулирующей через теплообменник. К нему же поступают данные исследования газов крови, КОС, электролитов, гематокрита, свертывающей системы крови и др. Остальные параметры — ЭЭГ, ЭКГ, среднее артериальное давление, ЦВД, температура тела (пищевод, носоглотка, прямая кишка, мисжард), диурез и т.д. - находятся под контролем анестезиолога. Следует подчеркнуть, что в процессе перфузии анестезиолог и перфузиолог постоянно обмениваются информацией.
Выбор раствора для заполнения АПК. В период освоения и внедрения ИК в клиническую практику использовали свежую гепаринизированную кровь в количестве 4 5л. Затем организационные сложности заставили клиницистов пользоваться консервированной кровью со сроком хранения до 5 дней. В дальнейшем стали очевидны опасности циркуляции в организме больших количеств чужеродной крови. Был описан «синдром гомологичной крови» [Dow J. el al., I960) с выходом плазмы из сосудистого русла, застоем и «заболачиванием» («binding») крови в системе чревных сосудов, агрегацией эритроцитов и тромбоцитов в различных областях и в первую очередь в легочных сосудах с открытом артериовенозных шутов и возникновением гиноксемии («перфузионные легкие»). Эти изменения сопровождались коагулопатней, печеночно-почечной недостаточностью, метаболическим ацидозом, снижением сурфактантной активностью и податливостью и легких и т.д. [Tobias М., 1986]. Иными словами, налицо была картина шока, достаточно полно описанная в литepaтype при переливании больших объемов крови, тяжелой травме и т.д. Решению этой проблемы способствовали гемодилюция [Panica F., Neptune W., 1959], совершенствование аппаратуры для ИК с меньшим объемом первичного заполнения (до 1,5 л) и большей оксигенирующей способностью. Это позволило у взрослых больных проводить перфузию без использования донорской крови [Cooley D. et al., 1962]. Целесообразность гемодилюции была подтверждена существенным снижением количества осложнений со стороны легких, свертывающей системы крови [Litwak R. et al., 1965], улучшением тканевой перфузии, диуреза, уменьшением числа почечных осложнений [Roe В. et al., 1964] и повреждений форменных элементов крови [Zundi N. et al., 1961]. Многие авторы, использующие аутокровь и растворы, т.е. оперирующие без донорской крови, отмечают высокое содержание тромбоцитов и значительное снижение числа послеоперационных кровотечений [Lilleaasen P., 1977].
Недостатками гемодилюции являются уменьшение кислородной емкости крови и избыточное содержание жидкости в сосудистой системе, чреватое опасностью гипоксии, перегрузки сердца и отека органов и тканей. Эти факторы не представляют существенной опасности во время перфузии, но проявляются при переходе на естественное кровообращение [Осипов В.П., 1976]. Оптимальная степень гемодилюции равняется 20—25 мл/кг, максимальная — 30 мл/кг. Гипотермия существенно нивелирует недостатки гемодилюции за счет снижения потребностей тканей в кислороде и повышения его растворимости в плазме при охлаждении [Tobias M., 1986].
Для заполнения АИК используют кристаллоидные и коллоидные плазмозаменители с различными компонентами. Из кристаллоидов чаще всего применяют 5% раствор глюкозы, сбалансированные солевые компоненты (раствор Хартмана, Рингер-лактат, плазмолит-148), маннитол [Tobias M., 1986], из коллоидных плазмозаменителей — желатиноль, реополиглюкин, «перфузионный коктейль» [Кобахидзе Э.А., 1975; Осипов В.П., 1976], декстран-40 и декстран-70, 5% и 20% растворы альбумина и др. [Rudowski W., 1980; Ring J., Messmer К., 1977 и др.].
В последние годы определенный интерес вызывают работы по созданию искусственного носителя кислорода, проведенные как в СССР, так и за рубежом [Белоярцев Ф.Ф. и др., 1984; Beisbarth H., Suyama Т., 1981; Frey R. et al., 1981; Jones H., 1983]. Цель этих исследований — получить перфторхимические соединения, способные переносить растворенный в них кислород. Созданы отечественные препараты перфторан, перфукол, зарубежные флюозол ГС-43, флюозол ДА (35 и 20%). Эксперименты на животных и отдельные клинические наблюдения показали эффективность этих препаратов как переносчиков кислорода, однако были выявлены и существенные недостатки. В частности, установлено, что перфторуглеродные соединения, покинув сосудистое русло, длительно задерживаются в ретикулоэндотелиальной системе. Однако имеются отдельные сведения о том, что наблюдается незначительная биотрансформация их и отсутствуют существенные повреждения тканей и органов [Wickham H., Hardy R., 1982]. Проблема нуждается в дальнейшем всестороннем экспериментальном изучении.
Резюмируя вышеизложенное, следует отметить, что оптимальной средой для заполнения АИК являются комбинированные кристаллоидно-коллоидные растворы [Осипов В.П., 1976; Tobias M., 1986]. Количество свежей индивидуально подобранной крови должно быть сведено к минимуму. Основанием для добавления донорской крови в аппарат является опасность избыточной гемодилюции (детский возраст, исходно низкий гематокрит).
Подключение АИК к больному. После заполнения аппарата и удаления воздуха из артериальной магистрали проверяют и корригируют КОС перфузата. Важно знать, что подогревать перфузат (без крови) не следует, так как, согласно закону Генри, это приводит к выходу пузырьков газа из перфузата [Осипов В.П., 1976]. Канюли вводят в восходящую аорту и полые вены после предварительной инъекции гепарина, как правило, из расчета 3 мг/кг. Следует подчеркнуть, что первоначальной расчетной дозы гепарина для безопасности проведения перфузии без дополнительного контроля за свертываемостью крови может быть недостаточно. По данным В. Bull и соавт. (1975), после введения одинаковой дозы 3 мг/кг многие больные оказывались либо недостаточно, либо избыточно гепаринизированы. С этой целью перед началом ИК необходимо оценить такой показатель, как активированное время свертывания крови clotting time— (АВСК), оптимальный уровень которого во время ИК согласно данным J. Young (1982), должен быть в пределах 450—500 с. АВСК целесообразно исследовать через каждые 30—45 мин перфузионного периода.
Перед началом ИК анестезиолог вводит в оксигенатор препараты, необходимые для поддержания анестезии и миорелаксации (см. главу 23).
Начало и поддержание ИК. Переход сестественного кровообращения на искусственное осуществляется в два этапа. Первый — параллельное кровообращение — требует от перфузиолога большого искусства. Основная задача заключается в поддержании адекватного кровоснабжения головного мозга и недопущении даже кратковременного периода гипоксии вследствие быстрого уменьшения объема циркулирующей крови (ОЦК).
Как показывает опыт, для предупреждения указанного осложнения необходимы тесное сотрудничество и взаимопонимание между анестезиологом, перфузиологом и хирургом. Важно, чтобы на этапе параллельного кровообращения количество притекающей в АИК по венозным катетерам крови не превышало бы количества нагнетаемой артериальным насосом. Перфузиолог контролирует приток венозной крови с таким расчетом, чтобы ЦВД уменьшалось постепенно, а биоэлектрическая активность мозга не изменялась.
Аналогичным образом перфузиолог должен регулировать работу артериального насоса, увеличивая его производительность до расчетной постепенно, в течение 2—3 мин [Осипов В.П., 1976].
После того как достигнут перфузионный баланс между притоком и оттоком на уровне расчетной производительности, можно переходить к этапу полного ИК путем перетягивания турникетов над венозными катетерами. Многолетний опыт свидетельствует о том, что расчетная производительность артериального насоса должна быть в пределах 2,2—2,4 л/(м2•мин). В дальнейшем ее корригируют в зависимости от степени охлаждения (согревания) под контролем Ро2 и РСо2 артериальной и венозной крови, показателей КОС, гематокрита, ЭЭГ и др. Для улучшения периферического кровотока и предупреждения артериальной гипертензии в АИК вводят вазодилататоры (дроперидол, натрия нитропрус-сид, гигроний, арфонад).
Спецификой ИК является начальное падение артериального давления и общего периферического сопротивления с последующим повышением при неизменной производительности АИК. Подчеркнем, что артериальное давление обычно не достигает исходного уровня, в то время как общее периферическое сопротивление в условиях гипотермии временами, особенно у гипертоников, может увеличиваться по сравнению с исходным уровнем. По мнению большинства авторов, во время перфузии целесообразно поддерживать среднее артериальное давление в пределах 50—60 мм рт. ст. [Kolka R. et al., 1980; Sethia В., Wheat-ley D., 1986; Koning H. et al., 1987]. В условиях умеренной гипотермии (28—30°С), адекватного периферического кровотока, достигаемого применением вазодилататоров, и производительности АИК 2,2—2,4 л/(м2• мин) такое артериальное давление полностью обеспечивает доставку кислорода к органам и тканям. В связи с тем что большинство операций проводится в условиях холодовой и фармакологической кардиоплегии, часть раствора в процессе перфузии поступает в оксигенатор и усиливает гемодилюцию. Для выведения излишков воды многие перфузиологи в процессе ИК подключают специальный прибор — гемоконцентратор, который выводит излишки воды из перфузата, возвращая кровь в АИК.
Проблему излишней гемодилюции решает специальная система для кардиоплегии, созданная фирмой «Polystan» (Дания).
Одновременно эта система защищает сердце от гипоксии, так как один и тот же объем кардиоплегического раствора циркулирует по кругу (полость перикарда—отсос—теплообменник—насос—полость перикарда), охлаждаясь с помощью маленького теплообменника.
Переход на естественное кровообращение. После завершения внутрисердечного этапа операции, согревания больного и восстановления сердечной деятельности начинается не менее ответственный период — переход с искусственного на естественное кровообращение, который должен быть плавным, с этапом параллельного кровообращения, который обычно продолжительнее, чем параллельное кровообращение в начале перфузии. Разумеется, все зависит от функциональной полноценности сердца, степени восстановления ее сократительной способности после периода кардиоплегии и ишемии. Очевидно одно — нагрузка на сердце должна увеличиваться постепенно. Анестезиолог регулирует этот процесс, основываясь на показателях сердечного выброса, артериального давления, ЦВД, давления в левом предсердии, ЭКГ и ЭЭГ. При наличии признаков сердечной недостаточности параллельное кровообращение продолжают на фоне энергичной кардиотонической терапии. Перфузию прекращают, когда сердце начинает адекватно перекачивать 75% минутного объема крови. После пережатия венозной магистрали АИК продолжает нагнетать кровь через артериальную магистраль под контролем ЦВД, которое не должно превышать 15—17 см вод. ст. В последующие 15—20 мин постепенно, дробными порциями (70—100 мл), по мере снижения ЦВД продолжается нагнетание крови из АИК.
Восстановление ОЦК и стабилизация гемодинамики являются основанием для удаления венозных канюль из предсердия и начала введения протамина сульфата для нейтрализации гепарина. Артериальная канюля удаляется несколькими минутами позже с тем, чтобы ввести дополнительный объем крови из АИК в ответ на снижение артериального давления и вазодилатацию, как правило, возникающие при введении протамина сульфата. В течение 30—40 мин постперфузионного периода АИК и канюли должны оставаться в операционной на случай экстренного подключения. При нестабильной гемодинамике этот период увеличивают. Если медикаментозными средствами не удается стабилизировать сердечную деятельность, следует, не теряя времени, прибегать к вспомогательным методам поддержания кровообращения.






