Как проводить ИВЛ? Чтобы ответить на этот вопрос, необходимо прежде всего определить те основные параметры, которые характеризуют ИВЛ. К их числу относятся две группы факторов, к одной из которых относятся особенности дыхательной системы больного (мертвое пространство, податливость, сопротивление дыхательных путей и т.д.), а вторая включает условия, искусственно создаваемые руками анестезиолога или аппаратом ИВЛ (частота дыхательных движений, объем газа, поступающего в легкие, давление, под которым поступает газ, скорость газотока и т.д.). Каждый из этих факторов по-своему важен, они тесно взаимосвязаны, и изменение одного тотчас приводит к сдвигам других. Однако, исходя из задач ИВЛ, один фактор все же следует считать наиболее важным, определяющим все остальные. Это объем вентиляции, решающее значение которого понятно, если учесть, что в конечном счете в отсутствие нарушений функций легких и сердечно-сосудистой системы газообмен зависит только от величины объема газа, поступающего в легкие и выдыхаемого из них.
Весь круг вопросов, связанных с объемом ИВЛ, как, впрочем, и с величиной любого другого ее параметра, требует рассмотрения в двух аспектах: какой должна быть величина показателя и как ее надежно обеспечить в процессе ИВЛ. С этих позиций мы и подвергнем анализу методику ИВЛ.
Объем ИВЛ. Объем ИВЛ, как и объем спонтанного дыхания, характеризуется несколькими величинами. То количество газа, которое поступает в легкие за один вдох (или выделяется за один выдох), называется дыхательным объемом (ДО). Умножив эту величину на частоту дыхания в минуту (ЧД), получим минутный объем дыхания (МОД).
Однако нас интересует не только и даже не столько объем газа, поступающий в легкие, сколько его количество, достигающее альвеол, где происходит обмен с кровью легочных капилляров, иными словами, необходимо знать минутный объем альвеолярной вентиляции (МАВ). Он определяется по формулам:
МАВ = (ДО - ОМП) X ЧД, МАВ = МОД - (ОМП X ЧД)
где ОМП — объем мертвого пространства.
Рассмотрим каждый из этих показателей, ОМП для каждого человека есть величина относительно постоянная, хотя и подверженная изменениям под влиянием некоторых факторов (фармакологические средства, положение тела и др.). По данным Е. Radford (1954), ОМП составляет 2,22 мл на 1 кг массы тела, если она находится в пределах, нормальных для роста, комплекции и возраста. Эту величину можно приближенно расценивать как ОМП в обычных условиях.
Остается установить необходимый для удовлетворительного газообмена ДО. Он должен быть достаточным, чтобы полностью «промыть» анатомическое мертвое пространство, доставить к легочным капиллярам кислород и удалить выделившийся в альвеолярное пространство углекислый газ.
Известно, что альвеолярная вентиляция может быть определена по формуле:
Обьем выдыхаемого СО2
МАВ =------------------------------------------ Х 100%
% CО2 в альвеолярном газе

Рис. 16.1. Номограмма Рэдфорда
Количество выделяемого углекислого газа зависит от активности обмена. Последняя в свою очередь может быть ориентировочно установлена на основании зависимости между поверхностью тела, ростом, массой тела и уровнем обмена. Исходя из этих положений Е. Radford (1955), С. Engstrom и P. Herzog (1959) составили получившие широкую популярность номограммы, по которым может быть найден необходимый для каждого больного объем ИВЛ (рис 16.1, 16.2). При использовании номограмм необходимо вносить поправки, часть которых предусмотрена авторами.
1. При хронической дыхательной недостаточности, если ИВЛ применяют длительное время, необходимо увеличить ДО, определенный по номограмме, на 10 % (для учета обычной дневной активности).
2. При повышении температуры тела на каждые 0,5 °С выше нормальной ДО увеличивают на 5%.
3. Ряд поправок касается возможных изменений «мертвого пространства»:
а) при введении трахеотомической или эндотрахеальной трубки ОМП уменьшается на 50%, поэтому из ДО следует вычесть половину «мертвого пространства»;
б) эфир способен увеличить ОМП на 50%, а холинолитики (например, атропин) — на 30%; применяя эти фармакологические средства, к ДО необходимо добавить соответствующий объем, равный 50 и 30% «мертвого пространства»;
в) при использовании гофрированных трубок для коррекции потери объема за счет их растяжимости к ДО необходимо добавить 50 мл.
У больных без сопутствующих заболеваний при экстраторакальных операциях номограмма Энгстрема—Герцога надежно обеспечивает достаточную вентиляцию Тот же результат может быть получен при использовании номограммы Редфорда (с поправками), но с обязательным увеличением найденного по ней объема вентиляции на 20% В таком случае рекомендации обеих номограмм совпадают. Без этой дополнительной коррекции с помощью номограммы Редфорда не удается обеспечить удовлетворительный уровень вентиляции У ряда больных может возникнуть гиперкапния.
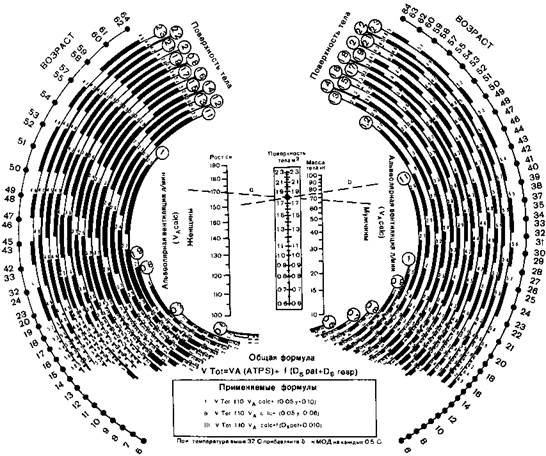
Рис. 16.2. Номограмма Энгстрема и Герцога
VTot — необходимый МОД в литрах (для больного в покое при нормальной температуре тела), VAcalc — альвеолярная вентиляция в литрах в минуту (определяют по номограмме), f — частота дыхания в минуту, у — поверхность тела в квадратных метрах (определяют по номограмме) Dspat — «мертвое пространство» больного в литрах (определяют с учетом поправок) VА(ATPS) = 1 10Х VAcaic (включает по правку к Удса1с при 24 °С и поправку на отклонение от стандартов основного обме на), Dsresp — «мертвое пространство» нар козного аппарата или респиратора с учетом поправки на растяжимость трубок Правила применения 1 Определить «у» соединяя точки соответствующие росту и массе тела больного (линия «а») «у» находят по шкале «Поверхность тела» в месте пересечения с этой линией 2. Определить VАcalc соединяя найденную точку по верхностности тета с цифрой соответствующей возрасту (линия «в») искомый VAсаlс находят в месте пересечения этой линии с кривой в верхней части которого (в кружке) обозначена величина поверхности тела. 3 Подставить найденные величины в обшлю формулу (формулы I II III испотьзуют при применении респиратора Энгстрема)
Во время торакотомии у больных, оперированных по поводу митрального стеноза, при использовании указанных номограмм получены вполне удовлетворительные результаты. Однако возможность использования номограмм в других случаях (в частности, при операциях на легких) нуждается в уточнении. Некоторые опубликованные материалы [Долина О.А., 1975] свидетельствуют о том, что у таких больных иногда необходимо увеличить объем ИВЛ на 25 и даже50% Наличие сопутствующих заболеваний (выраженный пневмоскле-роз и эмфизема, ожирение II—III степени) также требует увеличения объема ИВЛ для обеспечения нормального газообмена и ограничивает действенность номограмм. Очевидно, в подобных случаях нарушение газообмена обусловлено выраженными сдвигами механики дыхания и величины вентиляционно-перфузионного отношения.
Таким образом, несмотря на внесение поправок в номограммы и учет факторов, влияющих на функциональные характеристики дыхательных путей и легких, получаемые этим способом рекомендации для выбора объема вентиляции имеют сугубо ориентировочное значение. Для выбора величины ДО и МОД могут быть использованы и другие расчетные таблицы [Dobkin A., 1958] и формулы. Среди них привлекает внимание простотой и доступностью формула, предложенная Т.М. Дарбиняном (1976):
Масса тела (кг)
МОД (л/мин) = —————————————— + 1
В.С. Ширяев и А.Л. Тверской (1979), сравнив полученные при помощи этой формулы величины МОД с найденными по номограммам, установили весьма удовлетворительное совпадение в достаточно широком диапазоне колебаний массы тела больных. Заданная таким образом вентиляция в 98% случаев обеспечивала нормальный газообмен.
Наконец, определение необходимого ДО и МОД может быть произведено и с помощью спирографии в условиях основного обмена. После измерения искомых показателей необходимо внести поправки, касающиеся изменений мертвого пространства. При нарушениях общего обмена (микседема, тиреотоксикоз и др.) номограммы не могут быть применены из-за возможности больших ошибок. В подобных условиях единственным методом определения ДО и МОД остается спирография.
Таким образом, ориентировочный выбор объема ИВЛ не представляет особых трудностей. Иначе обстоит дело с методами обеспечения заданного объема, которые мы рассмотрим в порядке возрастания их точности и надежности.
Первым и наименее точным критерием являются субъективные ощущения анестезиолога, связанные с большим или меньшим сжатием мешка или гармошки наркозного аппарата при проведении ручной ИВЛ. Чаще всего наблюдаются отклонения в сторону гипервентиляции, но возможна и гиповентиляция Зго полностью касается также аппаратов ИВЛ, не снабженных специальными измерительными устройствами
Второй путь контроля объема вентиляции основывается на существовании зависимости между податливостью, давлением в легких и вдыхаемым (точнее, вдуваемым) объемом. При нормальном сопротивлении дыхательных путей, зная общую податливость или приняв ее условно за норму, по величине «давления но рту» (измеряемою с помощью манометра или по указателю давления на предохранительном клапане) можно приближенно рассчитать объем ИВЛ. Однако этот способ можно рассматривать лишь как грубо ориентировочный и вспомогательный, особенно при использовании аппаратов, регулируемых по давлению. Колебания степени миорелаксации, влияние раздражений, исходящих из операционного поля, перемена положения тела, введение по ходу операции дополнительных фармакологических средств (атропин, анальгетики и др.) способны изменить податливость (а также сопротивление дыхательных путей) на значительную величину.
Устройство всех современных аппаратов ИВЛ, используемых во время анестезии, позволяет с той или иной степенью ограничений регулировать ДО и МОД. Однако в силу различных причин фактически обеспечиваемый ими объем вентиляции может существенно отклоняться от заданной величины. Наиболее точным методом контроля объема ИВЛ является его непосредственное измерение в процессе анестезии, для чего следует пользоваться волюметрами.
Насколько надежен метод волюметрии для обеспечения адекватной ИВЛ? Очевидно, что объем ИВЛ соответствует потребностям организма в том случае, если он полностью обеспечивает снабжение кислородом и элиминацию углекислого газа. Необходимый больному объем ИВЛ устанавливают с помощью номограммы или спирографии на основании показателей, характеризующих состояние основного обмена. Между тем уровень обмена, изменяясь во время операции под влиянием множества не всегда учитываемых факторов, может существенно отличаться от той величины, которая послужила исходной при определении нужного объема ИВЛ. В связи с этим при использовании во время анестезии априорно установленного и стабильно поддерживаемого объема ИВЛ возможны его отклонения от оптимума в ту или другую сторону. С учетом этого обстоятельства и во избежание сдвига в направлении гиповентиляции введены поправки к номограммам, основная цель которых — приблизить объем ИВЛ к фактическим потребностям организма. Поправки должны также предусматривать некоторый «запас» с тенденцией к легкой гипервентиляции.
Таким образом, волюметрия, позволяя осуществлять контроль объема ИВЛ, строго говоря, не гарантирует ее адекватность. Единственным методом, создающим возможность точного соответствия объема ИВЛ потребностям организма, является поминутный контроль за напряжением углекислого газа в крови. Для этого необходима постоянная регистрация (например, с помощью внутрисосудистого датчика или чрескожного исследования, что пока практически недоступно в широкой практике) либо частое лабораторное определение газов артериальной крови (что также не всегда реально). Можно измерять напряжение углекислоты в альвеолярном воздухе (которое приблизительно равно рссь артериальной крови) с помощью капнографа. При использовании всех других методов контроля объема ИВЛ анестезиолог должен помнить о возможности отклонения ее величины от истинных потребностей организма.
Частота дыхательных движений во время ИВЛ является произвольно устанавливаемой величиной. Выбор ее связан с зависимостью, существующей между ЧД и другими показателями.
На первом месте по значению стоит влияние ЧД на размеры альвеолярной вентиляции: при том же минутном объеме чем больше частота, тем меньше альвеолярная вентиляция и наоборот. Это положение иллюстрирует простой пример. Зависимость между МОД и МАВ может быть выражена формулами, приведенными выше. Оценка физиологического значения этих формул позволяет установить несколько важных закономерностей.
Пусть МОД составляет 8 л, ОМП — 150 мл, а ЧД меняется. Тогда при ЧД 8 в минуту МАВ = 8 л — 1,2 л = 6,8 л, при ЧД 16 в минуту МАВ = 8 л — 2,4 л = = 5,6 л, при ЧД 32 в минуту МАВ == 8 л — 4,8 л = 3,2 л. Итак, простой расчет показывает, что при том же МОД увеличение ЧД приводит к резкому снижению АВ и, следовательно, эффективности вентиляции. С другой стороны, при ней смененном ДО учащение дыхания будет закономерно сопровождаться увеличением МАВ. Наконец, уменьшение ДО без соответствующего возрастания ЧД неизбежно снижает эффективность вентиляции.
При сближении величины ДО и ОМП в сочетании с обычными величинами ЧД альвеолярная вентиляция будет стремиться к нулю. Это правило теряет гное значение при ВЧ ИВЛ, при которой, как предполагают, фронтальное движение газа заменяется коническим и происходит усиление турбулентности, способствующее их смешиванию. Кроме того, при ВЧ ИВЛ, особенно осцилляторным методом, важную роль приобретает возрастание диффузионного газообмена. В условиях ИВЛ значение зависимости между ЧД и МАВ (т.е. эффективностью вентиляции) возрастает в связи с некоторым увеличением общего ОМП за счет соответствующих «мертвых» объемов наркозных аппаратов и аппаратов ИВЛ. Становится понятным, почему прилагают столько усилий, чтобы максимально уменьшить ОМП наркозной и дыхательной аппаратуры, особенно используемой у детей.
И еще одно следствие уже известных читателю закономерностей. Чем эффективнее вентиляция при прочих равных условиях, тем лучше газообмен и тем скорее происходит уравнивание концентрации вдыхаемого анестетика с его содержанием в альвеолярном газе. При ОМП 150 мл каждый ДО (допустим, 500 мл) на 350 мл обновляет альвеолярный газ. Объем последнего составляет так называемую функциональную остаточную емкость (ФОБ), равную в среднем 2—3,5 л. Следовательно, в нашем примере полная замена альвеолярного газа происходит примерно через 6—10 вдохов. Чем выше ЧД и ДО, тем скорее наступают замена альвеолярного газа и повышение концентрации анестетика, приближающейся к вдыхаемой. Понимание этого факта особенно важно в периоде индукции ингаляционными анестетиками. Это положение в равной степени справедливо и для фазы выведения из ингаляционной анестезии: увеличение ЧД и ДО способствует ускорению процесса элиминации анестетика из организма.
ЧД связана также с величиной так называемой мгновенной объемной скорости газотока, создаваемой в дыхательных путях больного при сжатии мешка или респиратором: чем меньше ЧД, тем выше должна быть объемная скорость газотока, и наоборот.
При спонтанном дыхании и ИВЛ движение газа через дыхательные пути может быть выражено синусоидальной кривой. Во время вдоха газоток очень быстро нарастает от нуля до максимальной величины (пик), вновь падая затем ю нуля к концу фазы. Аналогично подъем и спад газотока происходят во время выдоха. Следовательно, максимальную скорость газоток имеет в ограниченное время как во время вдоха, так и во время выдоха.
Предположим, что это не так и что скорость равномерного газотока одинакова на протяжении всего акта дыхания (но при вдохе он направлен в легкие, л при выдохе — из них) и равна 10 л/мин (167 мл/с). При частоте дыхания 20в минуту на каждый цикл приходится 3 с, причем на вдох расходуется только часть этого времени, допустим 1,5 с. За это время при объемной скорости газотока 167 мл/с в легкие поступит ДО, равный 250 мл (а в альвеолы с учетом 150 мл мертвого пространства — только 100 мл). Из этого следует, что ЧД 20 в минуту и скорость газотока в дыхательных путях (этот показатель не следует путать со скоростью подачи свежего газа через дозиметры) 10 л/мин обеспечивает МОД 5 л и МАВ 2 л, что, конечно, недостаточно для человека со средней массой тела. При той же ЧД (20 в минуту) и скорости газотока 20 л/мин ИЗ мл/с) дыхательный объем, МОД и МАЕ будут равны соответственно "О мл, 10 и 7 л, что приближается к среднему физиологическому оптимуму. Однако этот результат мы получили, приняв, что газоток равномерен и скорость его одинакова на протяжении всей фазы вдоха и выдоха. В действительности же, как было указано, максимальный газоток развивается только на протяжении части фазы. Кроме того, мы приняли, что вдох и выдох одинаковы и равны каждый половине дыхательного цикла (по 1,5 с). Между тем при спонтанном дыхании (а при ИВЛ это детается искусственно) соотношение продолжительности вдоха и выдоха составляет при первом способе дыхания 1—1,25, а при втором чаще всего 1—2. Следовательно, чтобы обеспечить достаточный объем ИВЛ при ЧД 20 в минуту, объемная скорость газотока должна быть выше 20 л/мин Эта величина еще более возрастает при ЧД менее 20 в минуту.
Обсуждая этот вопрос, мы опустили ради простоты такие факторы, как утечка из системы наркозный аппарат—аппарат для ИВЛ — больной, растяжение трубок и т.д. Все эти обстоятельства способствуют увеличению объемной скорости газотока, необходимой для удовлетворительной ИВЛ.
Таким образом, для обеспечения ДО 500 —700 мл и МАВ 4—6 л/мин при ЧД 16—18 в минуту объемная скорость газотока должна быть не менее 40 л/мин.
Объемная скорость газотока, возникающая в дыхательных путях, зависит от разницы давления «во рту» и альвеолах, а также от того, насколько быстро создается эта разница. Иными словами, при проведении ручной ИВЛ анестезиолог должен сжимать мешок достаточно энергично и быстро. Точно так же должен действовать аппарат ИВЛ, чтобы обеспечить нужную обьемную скорость газотока Этим условиям отвечают пик давления на вдохе 1,2—2 кПа (12—20 см вод ст) и продолжительность вдоха 1 с.
На ЧД при ИВЛ могут влиять и некоторые заболевания легких (например, бронхиальная астма, эмфизема). Повышение сопротивления газотоку, возникающее при этих патологических состояниях, ведет к значительному увеличению продолжительности выдоха, а это в свою очередь требует достаточно редкого дыхания. В противном случае воздух, введенный в легкие во время вдоха, не будет успевать выходить из них, легкие будут постоянно находиться в раздутом состоянии, эффективность вентиляции уменьшится, давление в них все время будет повышено. Наконец, анестезиолог должен учесть необходимость выбора такой ЧД, которая будет мало нарушать условия работы хирурга.
Для обеспечения всех необходимых условий и предупреждения возможных нарушении ЧД не должна выходить за пределы оптимума, который лежит между 12 и 20 дыхательными экскурсиями в минуту.
Обсуждая выбор ЧД во время ИВЛ при анестезии, кратко рассмотрим возможную роль метода ВЧ ИВЛ Клинический опыт применения ВЧ ИВЛ при анестезии невелик Она находит большее признание в определенных ситуациях при оказании экстренной помощи и в интенсивной терапии Однако ВЧ ИВЛ может оказаться полезной при проведении анестезии у некоторых больных с крайними степенями дыхательной и сердечной недостаточности, при которых традиционная ИВЛ бесполезна и даже вредна.
Величина давления во время ИВЛ. Выбор оптимальной величины давления во время ИВЛ представляет не меньшие трудности, чем определение необходимого объема. Они связаны с тем, что анестезиологу обычно неизвестны такие показатели, как податливость и сопротивление дыхательных путей больного, а именно эти факторы являются решающими при выборе необходимого для удовлетворительной ИВЛ давления. Напоминаем, что при проведении ИВЛ аппаратами, регулируемыми по объему, давление в системе является не самостоятельно регулируемой величиной, а производной от величины ДО и податливости легких.
Наблюдении показывают что с учетом условии, способных влиять на эти факторы, для обеспечения нужного объема ИВЛ при большинстве к клинических ситуаций следует создавать давление порядка 1,2—2 кПа (12—20 ссм вод.ст.). Такое давление необходимо также для получения оптимальной объемной скорости газотока вдыхательных путях (30-40 л/мин). При использовании ВППОД оптимальной величиной отрицательного давления на выдохе считают) 0,5—0,7 кПа (5 7 см вод ст).
Регуляция создаваемого во время ручной ИВЛ давления на вдохе легко осуществляется путем соответствующей установки предохранительного выдыхательного клапана на наркозном аппарате. При проведении ИВЛ с помощью шпаратов для ИВЛ установку давления обеспечивают в соответствии с их устройством (см главу 9), контроль за величиной давления — с помощью манометра.
Все факторы, увеличивающие сопротивление выдоху, одновременно способствуют повышению давления. В свою очередь повышение давления может благоприятно влиять на кровообращение и уменьшать эффективность ИВЛ. Рассмотрим последнее явление более детально.
Нередкой причиной увеличения сопротивления выдоху и повышения давления служит ошибка анестезиолога, который при проведении ручной ИВЛ допекает переполнение мешка наркозного аппарата. Как показали наши наблюдения, в таких случаях давление на выходе может быть 0,5 кПа (5 см вод ст. и выше. Предположим, что во время вдоха в легкие введено 500 мл газа. Общая податливость равна 0,5 л/кПа (0,05 л/см вод.ст.), сопротивление дыхательных путей — 0,2 кПа• л/с (2 см вод ст л/с) Во время пассивного выдоха в альвеолах разовьется давление 0,2 кПа (2 см вод ст) и при пустом мешке ДО полностью покинет легкие. Если же мешок переполнен газом, то давление в альвеолах достигнет 0,7 кПа (2 + 5 = 7 см вод ст), в связи с чем 250 мл ДО останетсея в легких. Как только при следующем вдохе в легкие поступит 250 мл газа, давление достигнет предела, установленного на предохранительном клапане, а остальная часть газа будет выброшена наружу. Эта последовательность событий будет повторяться и в дальнейшем, если мешок на выдохе переполнен таким образом, ДО уменьшится наполовину — с 500 до 250 мл. Посредством этого механизма вентиляция может снизиться до самых малых величин, хотя анестезиолог все так же активно сжимает мешок. В определенных условиях аналогичная ситуация может возникнуть при использовании аппаратов для ИВЛ, регулируемых по давлению.
Отрицательные эффекты
Основным побочным эффектом ИВЛ является ее отрицательное воздейвие на кровообращение, которое можно отнести к числу почти неизбежных недостатков метода. Иной источник движущей силы и связанные с этим изменения механики процесса вентиляции служат причиной извращения сдвигов внутригрудного давления если в условиях спонтанной вентиляции как альвеолярное, так и внутриплевральное давление во время вдоха наименьшее, а во время выдоха наибольшее, то ИВЛ характеризуется обратным соотношением. Более того, увеличение давления во время вдоха намного превышает величину, которая имеет место при спонтанном дыхании во время выдоха. В результате при ИВЛ значительно повышается среднее внутригрудное давление. Именно это обстоятельство создает предпосылки для появления побочных вредных эффектов ИВЛ.
Мы уже отмечали, что в обычных условиях дыхательные движения и соответствующие колебания давления в грудной клетке служат дополнительным важным механизмом, способствующим притоку крови к сердцу и обеспечивающим достаючныи сердечный выброс. Речь идет о присасывающем эффекте грудной клетки, развивающемся во время вдоха вследствие чего увеличивается перепад (градиент) давления между периферическими и большими грудными венами и облегчается приток крови к сердцу. Повышение давления во время вдоха при ИВЛ мешает присасыванию крови в большие вены. Более того, увеличение внутригрудного давления теперь уже препятствует венозному возврату со всеми вытекающими из этого последствиями.
Прежде всего повышается ЦВД. Градиент давления между периферическими и большими венами уменьшается, венозный возврат, а вслед за ним сердечный выброс и артериальное давление снижаются. Этому способствует эффект мышечных релаксантов, выключающих скелетную мускулатуру, сокращения которой в обычных условиях служат «периферическим сердцем». Отмеченные сдвиги быстро компенсируются рефлекторным повышением тонуса периферических вен (а возможно, и мелких артерий, так как периферическое сопротивление возрастает), градиент венозного давления увеличивается, что содействует восстановлению нормальной величины сердечного выброса и артериального давления.
В описанном процессе компенсации существенное значение приобретают нормальный объем циркулирующей крови (ОЦК), сохранение способности сердечно-сосудистой системы к приспособительным реакциям и т.д. Например, выраженная гиповолемия сама по себе вызывает интенсивную вазоконстрикцию, и дальнейшая компенсация уже невозможна. Гиповолемия особенно опасна при применении ПДКВ, опасное воздействие которого на кровообращение еще более выражено. Столь же очевидна возможность осложнений на фоне тяжелой сердечно-сосудистой недостаточности.
Повышение внутригрудного давления непосредственно влияет также на сердце, которое в определенной степени сдавливается раздуваемыми легкими. Последнее обстоятельство позволяет даже говорить о «функциональной тампонаде сердца» в условиях ИВЛ. При этом снижается наполнение сердца, а следовательно, и сердечный выброс.
Легочный кровоток — третий объект воздействия повышенного внутригрудного давления. Давление в легочных капиллярах в норме достигает 1,3 кПа (13 см вод. ст.). При выраженном повышении альвеолярного давления легочные капилляры частично или полностью сдавливаются, в результате чего: 1) это уменьшает количество крови в легких, перемещая ее на периферию, и является одним из механизмов повышения венозного давления; 2) создается чрезмерная нагрузка на правый желудочек, что в условиях сердечной патологии способно вызвать правожелудочковую недостаточность.
Рассмотренные пути нарушения кровообращения под влиянием ИВЛ играют большую роль при интактной грудной клетке. Положение меняется в условиях торакотомии. Когда грудная клетка открыта, повышение давления более не влияет на венозный возврат. Тампонада сердца также невозможна. Сохраняется только влияние на легочный кровоток, нежелательные последствия которого все же имеют определенное значение.
Таким образом, отличия механики ИВЛ от спонтанного дыхания не проходят бесследно для больного. Вместе с тем большинство больных способны компенсировать эти изменения, и клинически у них не обнаруживают никаких патологических сдвигов. Только у больных с предшествующими расстройствами кровообращения той или иной этиологии, когда приспособительные возможности понижены, ИВЛ может быть причиной осложнений.
Поскольку ухудшение условий кровообращения является неотъемлемой чертой ИВЛ, необходимо искать пути ослабления этого влияния. Разработанные в настоящее время правила позволяют в значительной степени ослабить интенсивность патологических сдвигов. Принципиальную основу этих правил составляет понимание того факта, что главной причиной расстройства кровообращения служит повышение внутригрудного давления.
Основные правила сводятся к следующему:
1) положительное давление на вдохе не следует поддерживать дольше, чем необходимо для эффективного газообмена;
2) вдох должен быть короче выдоха, а при ручной ИВЛ — выдоха и паузы после него (оптимальное соотношение 1:2);
3) легкие следует раздувать, создавая быстрый газоток, для чего надо сжимать мешок достаточно энергично и одновременно по возможности более плавно;
4) сопротивление дыханию должно быть низким, что обеспечивается обрывистым падением давления во время выдоха, при ручной вентиляции — поддерживанием мешка в полураздутом состоянии, а также туалетом дыхательных путей, применением бронходилататоров;
5) «мертвое пространство» должно быть сведено к минимуму.
Другие нежелательные эффекты ИВЛ. Тот факт, что выбор параметров ИВЛ имеет ориентировочный характер и не основывается на обратной связи с потребностями организма, предполагает возможность некоторых нарушений (к сожалению, серийное производство созданных в нашей стране аппаратов РОА-1 и РОА-2, автоматически устанавливавших необходимый для поддержания нормокапнии объем вентиляции, не было начато). Неверно заданный объем вентиляции неизбежно приводит к сдвигам газообмена, в основе которых лежит гипо- или гипервентиляция.
Не может вызвать возражений утверждение, что любая степень гиповентиляции вредна для больного. Даже при условии обогащения вдыхаемой смеси кислородом, что предупреждает гипоксию, гиповентиляция приводит к гиперкапнии и дыхательному ацидозу со всеми вытекающими из этого последствиями.
Каковы клиническое значение и вредные последствия гипервентиляции, в результате которой возникает гипокапния? Во время бурных дискуссий защитников и противников гипервентиляции каждая сторона выдвигала убедительные аргументы, самым неопровержимым из которых является утверждение, что манипуляции анестезиолога должны быть направлены на нормализацию функций, а не на заведомое их нарушение (особенно если оно сопровождается такими явлениями, как сдвиг влево кривой диссоциации оксигемоглобина и сужение сосудов головного мозга). Этот тезис действительно неоспорим: оптимальными условиями газообмена являются нормовентиляция и как ее следствие нормокапния. Однако в повседневной практике точная нормовентиляция является желаемым, но трудно достижимым идеалом как при ручной, так и при аппаратной ИВЛ. Если признать реальность этого факта, то неизбежен вывод, что из двух зол выбирают наименьшее, чем является легкая гипервентиляция, при которой pc о, артериальной крови поддерживается около 4 кПа (30 мм рг. ст.). Рассмотренные нами правила выбора объема вентиляции обеспечивают такую возможность, а возникающая при этом небольшая гипокапния практически безвредна для больного.
В качестве одного из путей оптимизации ИВЛ и предупреждения нежелательного влияния ее на кровообращение была предложена вентиляция с ВППОД. Фаза отрицательного давления, снижая среднее давление в грудной клетке, действительно может улучшить условия гемодинамики. Однако это положение теряет значение при операциях на открытой грудной клетке. Кроме того, ВППОД, кроме преимуществ, обладает существенными недостатками.
У больных эмфиземой или бронхиальной астмой выдох затруднен. Казаюсь бы, имеются прямые показания к использованию фазы отрицательного швления у больных этой группы. Однако у них в результате патологического процесса стенки мелких бронхов могут быть истончены. Отрицательная фаза величивает перепад давления между альвеолами и ртом. При превышении определенного уровня разницы давлений включается механизм, получивший название «клапан-отсекатель» (chack-valve в англоязычной литературе): истонченные стенки бронхов спадаются и задерживают часть выдыхаемого в альвеолах (воздушная ловушка). Тот же механизм имеет место у эмфизематозных больных во время форсированного выдоха Эта особенность ставит под сомнение пользу применения ВППОД у лиц, страдающих хроническими легочными заболеваниями. Если к этому добавить, что отрицательное давление способно приводить к экспираторному закрытию дыхательных путей даже у здоровых лиц, то следует признать, что без особых показаний применение ВППОД нецелесообразно.
К числу нежелательных эффектов ИВЛ следует отнести также баротравму, возможность которой возрастает при применении ПДКВ, особенно в отсутствие должного контроля за величиной избыточного давления.
Наконец, можно упомянуть снижение мочеотделения, обусловленное ИВЛ. Этот эффект длительной ИВЛ опосредуется через антидиуретический гормон. Однако нет четко документированных данных, которые свидетельствовали бы о подобном значении относительно кратковременного (несколько часов) периода ИВЛ во время анестезии. Невозможно также отличить антидиуретический эффект ИВЛ от задержки мочеотделения, вызванной другими причинами, во время и в ближайшие часы после операции.






