Все многообразие процессов можно разделить на следующие группы: изохорные, изобарные, изотермические, адиабатные, политропные.

| p |
| Рис. 4.2 |
| s |
| T |
| T |
| T |
| s |
| p |
| T |
| p |
| s |
| s |
| v |
| v |
| v |
Цель расчета процесса – определение параметров в начальном и конечном состояниях, а также теплоты и работы процесса. Расчет процессов, как правило, сопровождается графическим представлением их в p - v- и T - s- диаграммах (рис. 4.1, рис. 4.2).
Изобары в T - s- диаграмме располагаются эквидистантно между собой
и с увеличением давления смещаются влево; построены на основании уравнения (4.18).
Изохоры в T - s- диаграмме располагаются также эквидистантно между собой и с увеличением объема смещаются вправо; для построения изохор использовалась формула (4.17).
Изотермы в p - v- диаграмме представляют собой симметричные гиперболы, отражающие связь между p и v в изотермическом процессе,
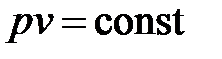 . .
| (4.28) |
Адиабаты (изоэнтропы) в p-v -диаграмме – несимметричные гиперболы, отражающие связь между давлением и объемом в адиабатном обратимом процессе,
 , ,
| (4.29) |
располагаются круче изотерм, т. к. показатель адиабаты k >1.
4.2.1. Изобарный процесс
Дано: параметры начального состояния p 1, v 1, удельный объем конечного состояния v 2.
Определить: недостающие термические параметры T 1 и T 2, работу и теплоту процесса (w, l, q).
Изобарный процесс, построенный на основании исходных данных
(p 1, v 1, v 2), в p - v- и T - s- диаграммах представлен на рис. 4.3 и 4.4.


Из уравнения состояния для точки 1 определяется температура T 1:
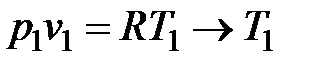 .
.
Сравнение уравнений состояния для точек 1 и 2 при условии
p 1= p 2 = p = const,

дает связь между v и T в изобарном процессе:
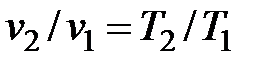 , ,
| (4.30) |
из которой можно определить искомую температуру T 2.
Формулы для расчета работы и теплоты изобарного процесса легко получить на основании уравнений
 . .
|
Отсюда при p = const имеем

| (4.31) |
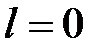 , ,
| (4.32) |
 . .
| (4.33) |
Работа и теплота изобарного процесса в диаграммах представлены заштрихованными площадями. Работа положительна (w > 0), т. к. v 2 > v 1, теплота подводится (q > 0), поскольку s 2 > s 1.
Из T - s- диаграммы следует: изменение энтальпии (Dh) любого процесса, осуществляемого в интервале температур T 1 – T 2, характеризуется площадью под изобарой в этом интервале температур.
Изохорный процесс
Дано: параметры начального состояния p 1, v 1, давление конечного состояния p 2(p 2 > p 1).


Определить: недостающие термические параметры T 1 и T 2, работу и теплоту процесса (w, l, q).
Изохорный процесс, построенный на основании исходных данных
(p 1, v 1, p 2) в диаграммах p - v и T - s, представлен на рис. 4.5 и 4.6.
Из уравнения состояния для точки 1 определяется температура
T 1 = p 1 • v 1/ R. Сравнение уравнений состояния для точек 1 и 2 при условии
v 1 = v 2 = v = const (p 1 •.v = RT 1, p 2 • v = RT 2) дает связь между давлением и температурой в изохорном процессе:
 , ,
| (4.34) |
из которой можно рассчитать температуру T 2.
Формулы для расчета работы и теплоты изохорного процесса получены на основании уравнений
 . .
|
При v = const получаем

| (4.35) |
 , ,
| (4.36) |
 . .
| (4.37) |
Работа и теплота изохорного процесса в p - v- и T - s- диаграммах представлена заштрихованными площадями. Работа затрачивается (l < 0), т. к.
p 2 > p 1, теплота подводится (q > 0), поскольку s 2 > s 1.
Из T - s- диаграммы следует: изменение внутренней энергии ( ) любого процесса, осуществляемого в интервале температур T 1 – T 2, характеризуется площадью под изохорой в этом интервале температур.
) любого процесса, осуществляемого в интервале температур T 1 – T 2, характеризуется площадью под изохорой в этом интервале температур.
Изотермический процесс
Дано: параметры начального состояния p 1, v 1, давление конечного состояния p 2(p 2 > p 1).
Определить: недостающие термические параметры T 1 и v 2, работу и теплоту процесса (w, l, q).


Изотермический процесс, построенный на основании исходных данных (p 1, v 1, p 2) в диаграммах p - v и T - s, представлен на рис. 4.7 и 4.8.
Из уравнения состояния для точки 1 определяется температура
T = p 1 • v 1/ R. Сравнение уравнений состояния для точек 1 и 2 при условии
T 1 = T 2 = T = const (p 1 • v 1 = RT, p 2 • v 2 = RT) дает связь между давлением и объемом в изотермическом процессе:
 , ,
| (4.38) |
из которой можно определить удельный объем v 2.
Формулы для расчета работы и теплоты изотермического процесса получены на основании уравнений
 . .
|
Для идеального газа при T = const имеем
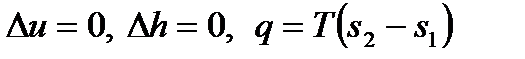 , ,
| (4.39) |
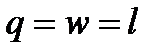 , ,
| (4.40) |
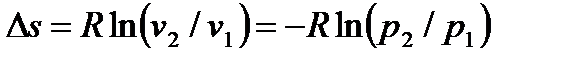 . .
|
Для расчета теплоты (работы) изотермического процесса можно использовать формулы
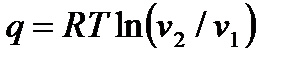 , ,
| (4.41) |
 . .
| (4.42) |
Работа и теплота изотермического процесса в p - v- и T - s- диаграммах представлена заштрихованными площадями. Равенство работ w и l подтверждается симметрией изотермы относительно осей координат. Работа процесса w < 0, т. к. v 2 < v 1; работа l < 0, поскольку p 2 > p 1; теплота отводится (q < 0), т. к. s 2 < s 1.
Адиабатный процесс
Адиабатным называется процесс, который протекает без теплообмена с окружающей средой (dq = 0).
В обратимых адиабатных процессах энтропия не изменяется (ds = 0,
s = const), в необратимых – энтропия увеличивается (ds > 0).
Уравнение обратимого адиабатного процесса имеет вид
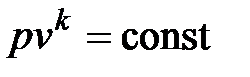 , ,
| (4.43) |
где k – показатель адиабаты.
Для идеального газа
 . .
| (4.44) |
Для одноатомного идеального газа показатель адиабаты не зависит от температуры:
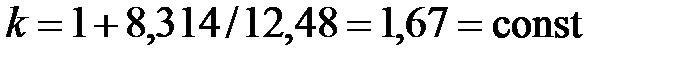 . .
|
Для двух-, трех- и многоатомных идеальных газов k = f (T), т. к. теплоемкость m cv = f (T). С увеличением температуры показатель адиабаты убывает.
Если принять теплоемкость постоянной в соответствии с молекулярно-кинетической теорией газов, то для двухатомных газов
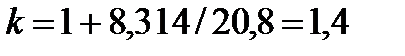 , ,
|
для трех- и многоатомных газов:
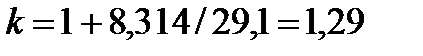 . .
|
Расчет адиабатных процессов двух-, трех- и многоатомных газов при значениях показателя адиабаты 1,4; 1,29 является приближенным, т. к. не учитывает зависимость теплоемкости от температуры.
Совместное решение (4.43) с уравнением состояния идеального газа
pv = RT дает следующие связи параметров:
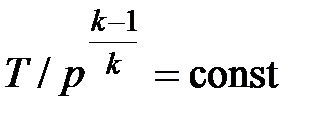 , ,
| (4.45) |
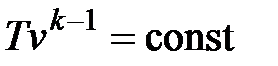 . .
| (4.46) |
Для адиабатного процесса 1-2, в котором параметры изменяются от p 1, v 1, T 1 до p 2, v 2, T 2, на основании уравнений (4.43), (4.45), (4.46) можно получить следующие соотношения между параметрами:
 , ,
| (4.47) |
 , ,
| (4.48) |
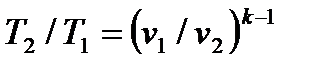 . .
| (4.49) |
Совместное решение уравнений

позволяет получить расчетные формулы для работы адиабатного процесса 1-2:
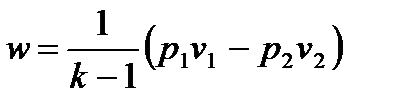 , ,
| (4.50) |
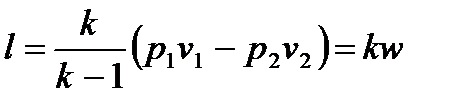 . .
| (4.51) |
С учетом уравнения состояния pv = RT, а также соотношения (4.48) формулу (4.50) можно представить следующим образом:
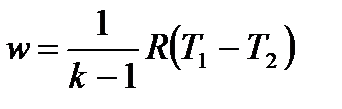 , ,
| (4.52) |
 . .
| (4.53) |
По формулам (4.46) – (4.53) производят расчеты адиабатных процессов одноатомного идеального газа и приближенные расчеты двух-, трех- и многоатомных газов при значениях k = 1,4; k = 1,29.
Расчет адиабатных процессов с учетом зависимости k = f (T) по вышеприведенным формулам прост, если известны температуры T 1 и T 2. В противном случае используется метод последовательных приближений, что значительно усложняет расчет.
Более простым является табличный метод расчета адиабатного процесса идеального газа с учетом зависимости теплоемкости от температуры. В основе расчета лежат следующие уравнения:
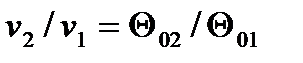 , ,
| (4.54) |
 , ,
| (4.55) |
 , ,
| (4.56) |
 . .
| (4.57) |
Здесь  – безразмерные величины, приведенные в таблицах термодинамических свойств газов [7]; h, u – табличные значения параметров.
– безразмерные величины, приведенные в таблицах термодинамических свойств газов [7]; h, u – табличные значения параметров.


Обратимый адиабатный процесссжатия идеального газа, построенный по исходным параметрам p 1, T 1, p 2 в p - v- и T - s- диаграммах, представлен на рис.4.9 и 4.10.
В p - v- диаграмме адиабата – несимметричная гипербола располагается круче изотермы, в T - s- диаграмме – изоэнтропа (s = const, q = 0).


Необратимые адиабатные процессы (1-2 д), протекающие с увеличением энтропии, показаны на рис. 4.11, 4.12.
Работа необратимого адиабатного расширения (см. рис. 4.11) равна
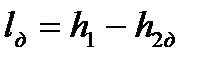 , ,
|
и она меньше работы обратимого процесса, вычисляемого по формуле
 . .
|
Напротив, работа необратимого адиабатного сжатия (см. рис. 4.12), равная
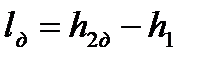 , ,
|
больше работы обратимого процесса
 . .
|
Политропные процессы
Политропные процессы описываются уравнением
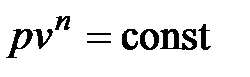 , ,
| (4.58) |
где n – показатель политропы, который не зависит от температуры (n = const) и изменяется в пределах от -µ до µ.
Внешняя схожесть уравнений (4.43) и (4.58) позволяет записать расчетные формулы политропного процесса, аналогичные адиабатному:
 , ,
| (4.59) |
 , ,
| (4.60) |
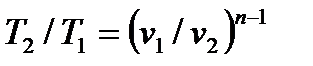 , ,
| (4.61) |
 , ,
| (4.62) |
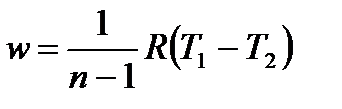 , ,
| (4.63) |
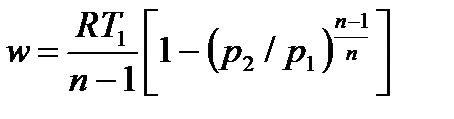 , ,
| (4.64) |
 . .
| (4.65) |
Теплота политропного процесса рассчитывается по уравнению
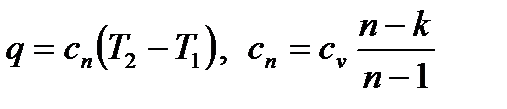 , ,
| (4.66) |
где c п– теплоемкость политропного процесса.
Все многообразие процессов можно описать политропой с показателем µ < n < µ. Изохорный, изобарный, изотермический, адиабатный процессы являются частным случаем политропных процессов с определенным показателем n. Подставляя конкретные его значения в формулы (4.58) и (4.66), можно доказать, что при
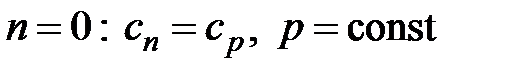 - процесс изобарный;
- процесс изобарный;
 - процесс изотермический;
- процесс изотермический;
 - процесс адиабатный;
- процесс адиабатный;
 - процесс изохорный.
- процесс изохорный.


На рис. 4.13 и 4.14 в p - v- и T - s- диаграммах представлено все множество политропных процессов с показателем n, изменяющиxся от -µ до µ.
Можно выделить следующие группы процессов:
1. Процессы расширения (dv > 0, dw > 0) – области 1, 2, 3, 4.
2. Процессы сжатия (dv < 0, dw < 0) – области 5, 6, 7, 8.
3. Процессы подвода теплоты (ds > 0, dq > 0) – области 8, 1, 2, 3.
4. Процессы отвода теплоты (ds < 0, dq < 0) – области 4, 5, 6, 7.
5. Процессы, протекающие с увеличением температуры (dT > 0, du > 0, dh > 0) – области 7, 8, 1, 2.
6. Процессы, протекающие с уменьшением температуры (dT < 0, du < 0, dh <0) – области 3, 4, 5, 6.
7. Процессы с отрицательной теплоемкостью (cn < 0, 1 < n < k) – области 3, 7.
В области 3 при подводе теплоты (dq > 0) температура, внутренняя энергия, энтальпия уменьшаются (dT < 0, du < 0, dh < 0). В области 7 при отводе теплоты (dq < 0) температура, внутренняя энергия, энтальпия увеличиваются (dT > 0, du > 0, dh > 0). Это может быть только при отрицательной теплоемкости. В процессах с отрицательной теплоемкостью  , поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела, а затрачиваемая работа на сжатие компенсирует не только отводимую теплоту, но и повышает внутреннюю энергию рабочего тела.
, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела, а затрачиваемая работа на сжатие компенсирует не только отводимую теплоту, но и повышает внутреннюю энергию рабочего тела.
При изображении политропных процессов в диаграммах p - v и T - s необходимо определить область, к которой они принадлежат, путем сравнения показателя политропы с n = k, n =1 и т. д.
Политропный процесс газа с показателем 1< n < k, построенный по исходным параметрам p 1, t 1, p 2 (p 2 > p 1) в p - v- и T - s- диаграммах, представлен на
рис. 4.15 и 4.16.


В p - v- диаграмме политропа – несимметричная гипербола, которая располагается круче изотермы, т. к. n >1.
В T - s- диаграмме политропа – логарифмическая кривая, которая располагается между изотермой и изоэнтропой, т. к. 1< n < k.
14) Влажный воздух и его процессы
Итак, смесь сухого воздуха и водяного пара называется влажным воздухом. Именно влажный воздух окружает нас повсеместно, именно он сушит бельё после стирки, постепенно опустошает ёмкость с водой, а иногда напоминает о себе запотевшими стеклами и конденсатом на поверхности холодного предмета. Он может способствовать накоплению статического электричества на металлических поверхностях, развитию астмы у людей, иссушать растения, ухудшать наше самочувствие в теплую погоду. Попробуем же разобраться с его свойствами, характеристиками и процессами! Перед нами - влажный воздух!
Влажный воздух, как мы уже определились, это смесь сухого воздуха с водяным паром, причем смесь эта не находится в состоянии равновесия, т.е. постоянно меняется, и именно эта неравновесность представляет огромную сложность в изучении. Без неё книги о влажном воздухе превратились бы в пару абзацев.
Как и у любого вещества, у влажного воздуха есть основные параметры, определяющие его состояние, и достаточно трех независимых из них, чтобы полностью определить его состояние. Однако, из-за сложности ввиду неравновесности, а также для удобства описания процессов обычно выделяют 6 основных параметров влажного воздуха. Перечислим их:
- Давление (абсолютное), P, атм;
- Температура, t, К или С;
- Относительная влажность, φ, %;
- Энтальпия, i, кДж/кг*С;
- Влагосодержание, d, г/кг;
- Парциальное давление водяного пара, pп, Па.






