| Положительно заряженные ионы (катионы) | Отрицательно заряженные ионы (анионы) |
| О д н о з а р я д н ы е | |
| Ион аммония NH4+ | Хлорид – ион Cl- |
| Ион меди Cu+ | Бромид – ион Br - |
| Ион водорода H+ | Гидрид – ион H- |
| Ион серебра Ag+ | Гидрокарбонат – ион HCO3- |
| Ион натрия Na+ | Гидросульфат – ион HSO4- |
| Ион калия K+ | Гидроксид – ион OH- |
| Перманганат – ион MnO4- | |
| Д в у х з а р я д н ы е | |
| Ион бария Ba2+ | Карбонат – ион CO32- |
| Ион кальция Ca2+ | Хромат – ион CRo42- |
| Ион хрома Cr2+ | Оксид – ион O2- |
| Ион цинка Zn2+ | Сульфид –ион S2- |
| Т р е х з а р я д н ы е | |
| Ион алюминия Al3+ | Фосфат – ион PO43- |
| Ион хрома Cr3+ | |
| Ион железа Fe3+ |
С целью систематики химических свойств и названий неорганических соединений считают, что соединения состоят из двух частей, одна из которых электроположительна, а другая – электроотрицательна. В ионных соединениях реально электроположительной частью является катион, электроотрицательной – анион.
Обычно (за редким исключением NH3, CH4) в формулах химических соединений на первое место ставится электроположительная составляющая, а отрицательная часть записывается в формуле второй, а в названиях - наоборот.
Н а п р и м е р: Назвать следующие соединения: а) K2SO4, б) Ba(OH)2 .
Решение: а) поскольку К+ - ион калия, SO42- - сульфат – ион, название соединения K2SO4 – сульфат калия; б) поскольку Ba2+ - ион бария, а OH- - гидроксид – ион, название соединенияBa(OH)2 – гидроксид бария.
Таким образом, зная степени окисления и названия катионов и анионов, можно составить множество формул химических соединений и назвать их.
Cu(NO3)2 – нитрат меди (II)
Al2O3 – оксид алюминия
BaBr2 - бромид бария
Соотношение между числом положительных и отрицательных ионов всегда таково, что результирующий электрический заряд соединения оказывается равным нулю.
А л г о р и т м с о с т а в л е н и я ф о р м у л
Для составления формул химического соединения необходимо следующее:
1. Написать рядом символы катиона и аниона сложного вещества.
2. Обозначить степень окисления катиона и аниона (элемента).
3. Подобрать индексы (числа, указывающие количество катионов и анионов) для катионов и анионов в молекуле. Для этого необходимо найти наименьший общий множитель для величин степени окисления катиона и аниона и разделить его на каждую степень окисления. Поставить индексы в формулу.
4. Проверить электронейтральность молекулы. Для этого необходимо умножить степень окисления каждого иона на его индекс и найти их алгебраическую сумму. Если она равна нулю, то формула составлена правильно.
П р и м е р 1. Составить формулу оксида алюминия Al2O3.
1. Напишем рядом химические знаки алюминия и кислорода
Al O
2. Обозначим степень окисления алюминии и кислорода
Al+3 O-2
3. Подберем индексы, делающие молекулу электронейтральной
Al23+ O32-
4. Проверим электронейтральность молекулы:

(+3∙2) + (-2∙3) = 0
Количество положительных зарядов молекулы равно количеству отрицательных, следовательно, формула составлена правильно.
П р и м е р 2. Составить формулу фосфата натрия Na3PO4.
1. Фосфат натрия – это натриевая соль фосфорной кислоты, следовательно, в состав его молекулы входит катион натрия Na+ и фосфат-ион PO43-.
2. Заряд катиона натрия равен 1+, фосфат-иона (анион фосфорной кислоты H3PO4) – соответственно 3-.
3. Подберем индексы, делающие молекулу электронейтральной
Na31+ PO43-
4. Проверим электронейтральность молекулы
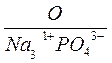
(1+)∙3 + (3-)∙1 = 0
Количество положительных зарядов в ней равно количеству отрицательных зарядов, следовательно, формула составлена правильно.






