Рідини, як і тверді тіла, можуть бути діелектриками, провідниками і напівпровідниками. Діелектриком є також дистильована вода. До провідників належать розплави і розчини електролітів: кислот, лугів і солей. Рідкими напівпровідниками є розплавлений селен, розплави сульфідів та ін.
Речовини, розчини яких проводять електричний струм, називаються електролітами.
Під час розчинення електролітів під впливом електричного поля полярних молекул води відбувається розпад молекул електролітів на іони. Цей процес називають електролітичною дисоціацією, в результаті якої нейтральні молекули розпадаються на позитивні та негативні іони. В електроліті з'являються вільні носії зарядів і він починає проводити струм. Оскільки заряд у водних розчинах чи розплавах електролітів переноситься іонами, то таку провідність називають іонною. За іонної провідності проходження струму пов'язано із перенесенням речовини. На електродах відбувається виділення речовин, які входять до складу електроліту. На аноді негативно заряджені частинки віддають свої зайві електрони (окиснювальна реакція), а на катоді позитивні іони отримують електрони (реакція відновлення). Процес виділення на електроді речовини, пов'язаний із окиснювально-відновлювальними реакціями, називають електролізом.
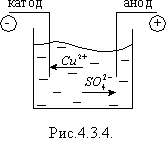 Розглянемо явище електролізу на прикладі мідного купоросу. В результаті електролітичної дисоціації CuSO4 = Cu2 + + SO4 2 +. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 4.3.4). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
Розглянемо явище електролізу на прикладі мідного купоросу. В результаті електролітичної дисоціації CuSO4 = Cu2 + + SO4 2 +. Позитивно заряджені іони міді під дією електричного струму будуть переміщуватися до катода, де отримають електрони і виділяться на ньому у вигляді нейтральних атомів міді (рис. 4.3.4). Негативно заряджені іони під дією електричного поля перемістяться до анода, де віддадуть вільні електрони і також виділяться на ньому.
Явище електролізу вивчав Фарадей. Він вимірював протікаючий через розчин заряд та масу катоду до та після електролізу.
Досліди Фарадея показали,що що маса виділенної при електролізі речовини залежить не лише від величини заряду q, але й від роду речовини.
Перший закон Фарадея: маса речовини, що виділяється при електролізі, прямо пропорційна кількості електрики, що протікає через розчин:
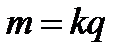
де k – електрохімічний еквівалент речовини - виражає залежність маси виділяємої речовини від її роду
Електрохімічний еквівалент вимірюється масою речовини,що виділяється на електроді при проходженні через електроліт одиниці заряду:
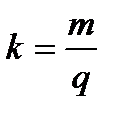
[k]=1кг/Кл
Оскільки  , то перший закон Фарадея можна записати наступним чином:
, то перший закон Фарадея можна записати наступним чином: 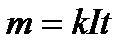
З досліду можна визначити електрохімічні еквіваленти з великою точністю.
Маса одного моля  (кг/моль)
(кг/моль)
В результаті ділення молярної маси іонів на їх валентність позначили:
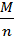 - хімічним еквівалентом.
- хімічним еквівалентом.
другий закон Фарадея: Електрохімічні еквіваленти різних речовин прямопропоційні їх хімічним еквівалентам.

де F=9.65·104Кл/моль - стала Фарадея.
Застосування електролізу.
1) Електрометалургія. На сьогоднішній день багато металів отримують за допомогою електролізу руд. Так, наприклад, алюміній отримують виключно електролізом його розплавленого оксиду (глинозему Al12O3) в кріоліті Na3AlF6. Електролітичною ванною і одночасно катодом служить залізний ящик з вугільним черенем, а анодами є вугільні стержні, які опускаються в розплав. Електроліз проводиться при температурі близько 900 oС, причому висока температура підтримується самим струмом. Розплавлений алюміній опускається на дно ящика, звідки його через спеціальний отвір випускають у форму для виплавки. За допомогою такого електролізу одержують також натрій, магній, берилій, кальцій, фтор і інші речовини.
2) Очищення металів. В промисловості під час електролізу здійснюють очищення металів. Метал, що очищається, виливають у вигляді пластин і роблять їх анодами в електролітичній ванні. Електролітом є розчин солі даного металу. Підбираючи напругу між анодом і катодом, можна добитися, щоб метал, що очищається, переходив від аноду в розчин і виділявся на катоді. Домішки ж випадають на дно посуду у вигляді осаду. Цей спосіб найбільш поширений для очищення міді, як ми це описали в деталях трохи вище.
3) Гальванопластика, або електричне осадження металу на поверхні предмету для відновлення його форми здійснюється так: з предмету спочатку знімають зліпок з воску, гіпсу і т.п., покривають його порошком графіту для формування електропровідності і потім використовують зліпок, як катод в електролітичній ванні, яка вміщає розчин солі відповідного металу. Під час електролізу метал з електроліту виділяється на поверхні зліпка і отримують металеву копію предмету. Цим способом виготовляють друкарські кліше, безшовні труби, а також інші металеві деталі складної форми.
4) Гальваностегія. Електролітичне осадження металів широко використовують для покриття одних металів шаром інших з метою захисту від корозії. Такими є електролітичні позолота, сріблення і т.п.






