При вивченні явищ в природі та техніці практично не можливо врахувати всі фактори, що впливають на те чи інше явище. Проте із досліду завжди можна встановити найважливіші з них. Тоді іншими факторами можна знехтувати. Потім теоретично вивчають хід явища в ідеальних умовах (коли діють тільки найважливіші фактори). Створена за таких умов модель явища допомагає вивчати реальні процеси і уявити їх хід в різних умовах.
Так в розрідженому газі відстань між молекулами в багато разів перевищують розміри самих молекул. Притягання між молекулами відсутнє, а сили відштовхування діють дуже малий час при зіткненні молекул. І замість реального газу, між молекулами якого діють сили взаємодії, було створена модель ідеального газу.
Ідеальний газ – це газ, взаємодією між молекулами якого можна знехтувати.
Характеристики ідеального газу:
1) молекулами газу є матеріальні точками, тобто власним об'ємом молекул газу можна нехтувати в порівнянні з об'ємом судини, в якій знаходиться газ;
2) сили взаємодії між молекулами відсутні, вони виявляються лише при зіткненні молекул;
3) зіткнення молекул між собою і із стінками судини відбувається за законами абсолютно пружного удару, тобто без втрат механічної енергії.
Для опису процесів в газах і інших макроскопічних тілах немає необхідності весь час звертатися до молекулярно-кінетичної теорії. Поведінка макроскопічних тіл, зокрема газів, можна охарактеризувати мало чим числом фізичних величин, що відносяться не до окремих молекул, що складають тіла, а до всіх молекул в цілому. До таких величин належать об'єм V, тиск p, температура Т.
Основне рівняння МКТ зв'язує макроскопічну величину - тиск, який може бути виміряне манометром, - з мікроскопічними величинами, що характеризують молекули: їх масою m0, швидкістю хаотичного руху. Воно має декілька виглядів.
1. Чим більша кінетична енергія поступального руху кожної молекули, тим більша сила, що виникає при її зіткненні зі стінкою. А чим більше молекул в одиниці об’єму n, то ти частіше вони ударяються о стінки судини.
Тому тиск газу прямо пропорційне середній кінетичній енергії поступального руху молекул газу та їх кількості в одиниці об'єму:
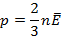
2. З урахуванням формули кінетичної енергії
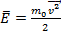 отримаємо рівняння Клаузіуса
отримаємо рівняння Клаузіуса
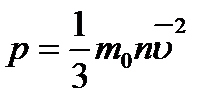
де m0- маса молекули,
n – концентрація молекул
υ – середня квадратична швидкість руху молекул
3. Залежність тиску газу від концентрації його молекул та температури має вигляд:
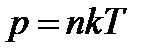
З формули ми бачимо, що при однакових тисках та температурах концентрація молекул в усіх газів одна й теж.
Видно, що тиск газу не залежить від його природи, а визначається лише концентрацією молекул n та температурою газу T.






