Элементы в свободном состоянии. Получение, свойства.
В виде простых веществ V, Nb, Ta - серые тугоплавкие металлы. Чистые металлы ковки, тогда как примеси (особенно O, H, N, C) сильно ухудшают пластичность и повышпют твердость металлов.
V на холоду растворяется лишь в царской водке и концентрированной HF, а при нагревании - в азотной и концентрированной серной кислоте.

Ванадий, ниобий и тантал взаимодействуют при сплавлении с щелочами в присутствии окислителей:
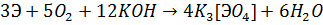
При нагревании металлы окисляются кислородом до 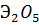 , фтором -
, фтором -  . При высокой температуре они также реагируют с хлором, азотом, углеродом и др.
. При высокой температуре они также реагируют с хлором, азотом, углеродом и др.
Получение:
из оксидов или галогенидов металлотермическим способом:

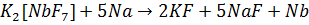
Ниобий и тантал получают также электролизом 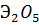 в расплавленных комплексных фторидах, например
в расплавленных комплексных фторидах, например  ,
, 
Соединения ванадия (II, III, IV, V).
Соединения (II)
В соединения ванадия (II) металл входит в виде катиона V2+.
Оксид ванадия (II) VO – вещество серого цвета, обладает металлическим блеском и довольно высокой электрической проводимостью, кристаллизуется в кубической гранецентрированной решетке типа хлорида натрия.
Проявляет основные свойства, с водой и щелочами не взаимодействует, реагирует с кислотами:
VO + 2HCl = VCl2 + H2O;
при этом образуется бледно-голубого или фиолетового цвета раствор соли ванадия (II).
Получается при восстановлении оксида ванадия (V) водородом при 1700 °С:
V2O5 + 3H2 = 2VO + 3H2O.
Соединения V (II) - сильные восстановители. Фиолетовые растворы производных 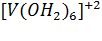 довольно легко окисляются до
довольно легко окисляются до 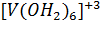 и их окраска становится зеленой.
и их окраска становится зеленой.
Соединения (III):
Основными формами существования ванадия (III) являются V3+, VO+, VO33-, комплексные ионы, в которых ванадий имеет координационное число, равное 6.
Оксид ванадия (III) V2O3 – вещество черного цвета, кристаллизуется в виде двух полиморфных модификаций.
Проявляет амфотерные свойства с преобладанием основных, растворяется только в кислотах:
V2O3 + 6HCl = 2VCl3 + 3H2O.
Получается восстановлением оксида ванадия (V) оксидом углерода (II) или водородом при нагревании:
V2O5 + 2H2 = V2O3 + 2H2O.
Производные ванадия (III) - сильные восстановители; в растворах они довольно легко окисляются кислородом воздуха до производных V (IV).
Соединения ванадия (IV)
При обычных условиях степень окисления +4 является для ванадия наиболее характерной. Ванадий (IV) существует в следующих формах: VO2+ (ванадин-ион), VO32-, V4O92- (ванадат (IV)-ионы). В комплексных ионах имеет координационное число, равное 6, а также 4 и 5.
Оксид ванадия (IV) VO2 – вещество синего цвета. Амфотерное соединение, с преобладанием кислотных свойств. В воде не растворяется, реагирует с кислотами с образованием производных ванадила светло-синего цвета:
VO2 + 2HCl = VOCl2 + H2O;
взаимодействует со щелочами, при этом образуются оксованадаты (IV) бурого цвета:
4VO2 + 2KOH = K2[V4O9] + H2O.
Проявляет восстановительные свойства.
Соединения ванадия (V)
Степень окисления +5 для ванадия реализуется в оксокатионах VO2+, VO3+ (ванадил-ионы) и оксоанионах VO43-, V2O74-, V3O93- и др. (ванадат (V)-ионы).
Оксид ванадия (V) V2O5 – тугоплавкое кристаллическое вещество красно-бурого цвета, обладает полупроводниковыми свойствами.
Проявляет кислотные свойства. Плохо растворяется в воде, образуя раствор светло-желтого цвета. Легко растворяется в щелочах, с образованием ванадатов:
V2O5 + 2KOH = 2KVO3 + H2O.
При взаимодействии с концентрированной соляной кислотой проявляет окислительные свойства:
V2O5 + 6HCl = 2VOCl2 + Cl2 + 3H2O.
Чистый оксид ванадия (V) получают при разложении ванадата аммония при 400–500 °С:
2NH4VO3 = V2O5 + 2NH3 + H2O






