РАБОЧАЯ ПРОГРАММА КУРСА
Модуль I
I. СТРОЕНИЕ ВЕЩЕСТВА
Строение атомов и систематика химических элементов
Основные сведения о строении атомов. Состав атомных ядер. Изотопы. Современное понятие о химическом элементе.
Электронные оболочки атомов. Размещение электронов в атомах. Составление электронных формул. Нормальное и возбужденное состояние атомов.
Атомные массы элементов.
Периодическая система элементов Д.И. Менделеева. Взаимосвязь свойств элементов с их положением в периодической системе. Изменение свойств химических элементов в рядах и группах. Изменение энергии ионизации, сродства к электрону и электроотрицательности.
Химическая связь
Образование молекул из атомов. Основные виды и характеристики химической связи.
Ионная связь. Механизм образования и свойства.
Основные представления о ковалентной связи. Валентность химических элементов. Насыщаемость и направленность ковалентных связей. Полярность связей.
Металлическая связь. Свойства металлов.
II. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Основные классы неорганических соединений. Простые и сложные вещества их химичские свойства.
Понятие моля вещества. Число Авогадро. Молярная масса вещества.
Основные газовые законы. Закон Авогадро. Уравнение Менделеева – Клапейрона. Расчеты по уравнениям химических реакций.
III. ОБЩИЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
Основы химической термодинамики
Энергетические эффекты химических реакций. Энтальпия. Закон Гесса.
Энтальпия образования химических соединений. Термохимические расчеты.
Энтропия и ее изменение при химических процессах и фазовых переходах.
Энергия Гиббса и ее изменение при химических процессах. Критерий возможности протекания процесса. Расчеты изменения энтальпии, энтропии и Энергии Гиббса химических реакций при стандартных условиях.
Химическая кинетика и равновесие в гомогенных системах
Скорость химических реакций. Гомогенные и гетерогенные реакции.
Зависимость скорости гомогенных реакций от концентрации реагирующих веществ. Закон действия масс. Зависимость скорости гомогенных реакций от температуры. Правило Вант-Гоффа. Катализаторы. Изменение скоростей гомогенных реакций. Ингибиторы. Химическое равновесие в гомогенных системах. Константа равновесия. Смещение равновесия. Принцип Ле Шателье.
Модуль II
IV. РАСТВОРЫ
Общие понятия о растворах. Классификация растворов.
Способы выражения концентрации растворов.
Электролиты и неэлектролиты. Электролитическая диссоциация. Сильные и слабые электролиты. Степень и константа диссоциации.
Ионные реакции в растворах. Электролитическая диссоциация воды. Водородный показатель.
V. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Окислительно-восстановительные реакции
Степень окисления. Метод электронного баланса, определение стехиометрических коэффициентов. Виды окислительно-восстановительных реакций.
Химические источники тока
Гальванические элементы. Схемы гальванических элементов. Электродные процессы. Электродные потенциалы. Уравнение Нернста. Электродвижущая сила.
Топливные элементы. Аккумуляторы
Электролиз
Электролиз. Катодные и анодные процессы. Электролиз с инертным и активным анодом. Схемы электролиза.
Законы Фарадея. Выход по току. Практическое применение электролиза: получение и рафинирование металлов, гальванопластика и гальваностегия. Получение веществ методом электролиза.
Коррозия металлов
Химическая коррозия металлов. Электрохимическая коррозия металлов.
Способы защиты металлов от коррозии. Антикоррозионные покрытия.
Электрохимические методы защиты (протекторная и катодная защиты). Ингибиторы коррозии.
ЛИТЕРАТУРА
1. Загальна та неорганічна хімія: Підручник для вищих навч. закладів / Н. В. Романова. - К.; Ірпінь: Перун, 1998. - 480 с.
2. Загальна хімія: Навч. посібник для інж.-пед. спец. вищих навч. закладів / В. І. Кириченко. - К.: Вища шк., 2005. - 640 с.
3. Глинка Н.Л. Общая химия. - Л.: Химия, 2001.
4. Лучинский Г.П. Курс химии. - М.: Высшая школа, 1985.
5. Курс общей химии/ Под ред. Н.В. Коровина. - М.: Высшая школа, 2002.
6. Фролов В.В. Химия. - М.: Высшая школа, 1979.
7. Зубов И.А. Неорганическая химия. - М: Высшая школа, 1989.
8. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии. - М.: Высшая школа, 1983.
Контрольные задания
Модуль I
1. Составьте электронные формулы атомов элементов с порядковыми номерами 13 и 21. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
2. Составьте электронные формулы атомов элементов с порядковыми номерами 14 и 22. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
3. Составьте электронные формулы атомов элементов с порядковыми номерами 15 и 23. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
4. Составьте электронные формулы атомов элементов с порядковыми номерами 16 и 2Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
5. Составьте электронные формулы атомов элементов с порядковыми номерами 17 и 26. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
6. Составьте электронные формулы атомов элементов с порядковыми номерами 31 и 27. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
7. Составьте электронные формулы атомов элементов с порядковыми номерами 32 и 28. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
8. Составьте электронные формулы атомов элементов с порядковыми номерами 33 и 30. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
9. Составьте электронные формулы атомов элементов с порядковыми номерами 34 и 39. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
10. Составьте электронные формулы атомов элементов с порядковыми номерами 35 и 40. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
11. Составьте электронные формулы атомов элементов с порядковыми номерами 49 и 41. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
12. Составьте электронные формулы атомов элементов с порядковыми номерами 50 и 42. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
13. Составьте электронные формулы атомов элементов с порядковыми номерами 51 и 43. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
14. Составьте электронные формулы атомов элементов с порядковыми номерами 52 и 44. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
15. Составьте электронные формулы атомов элементов с порядковыми номерами 53 и 4Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
16. Составьте электронные формулы атомов элементов с порядковыми номерами 18 и 46. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
17. Составьте электронные формулы атомов элементов с порядковыми номерами 10 и 47. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
18. Составьте электронные формулы атомов элементов с порядковыми номерами 9 и 48. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
19. Составьте электронные формулы атомов элементов с порядковыми номерами 36 и 24. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
20. Составьте электронные формулы атомов элементов с порядковыми номерами 54 и 29. Покажите распределение электронов этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов?
21. Какой объем углекислого газа (н.у.) выделится при взаимодействии 100г карбоната натрия с избытком соляной кислоты?
22. Какой объем водорода (н.у.) выделится при взаимодействии 100г цинка с избытком серной кислоты?
23. Какой объем углекислого газа (н.у.) выделится при сгорании 100кг углерода в избытке кислорода?
24. Какой объем азота (н.у.) потребуется для получения 100г аммиака при его взаимодействии с избытком водорода?
25. Какой объем оксида серы VI (н.у.) потребуется для получения 100г серной кислоты?
26. Какой объем аммиака (н.у.) потребуется для получения 100г гидроксида аммония при его растворении в воде?
27. Какой объем водорода (н.у.) может быть получен из 100г воды (при электролизе)?
28. Какой объем хлора (н.у.) может быть получен из 100г хлорида натрия (при электролизе)?
29. Какая масса гидроксида натрия потребуется для нейтрализации 100г соляной кислоты?
30. Какая масса серной кислоты потребуется для нейтрализации 100г гидроксида кальция?
31. Какая масса цинка вступит в реакцию со 100г серной кислоты?
32. Какая масса кислорода потребуется для окисления 100г магния?
33. Какая масса углекислого газа потребуется для получения 100г карбоната кальция?
34. Какая масса кислорода потребуется для окисления 100г серы до оксида серы IV?
35. Какая масса углекислого газа выделится при сгорании 100г углерода?
36. Какая масса водорода потребуется для получения 100г аммиака?
37. Какой объем займет 100г водорода при давлении 1000Па и температуре 100°C?
38. Какая масса кислорода содержится в 100м3 газа при давлении 1000Па и температуре 100°C?
39. Сколько молей газа содержится в 100м3 при давлении 10000Па и температуре 10°C?
40. Какой объем займет 100г аммиака при давлении 10000Па и температуре 10°C?
41. Напишите уравнение и вычислите тепловой эффект реакции восстановления Fe2O3 металлическим алюминием.
42. Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите уравнение этой реакции и вычислите её тепловой эффект.
43. При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерода CS2 (г). Напишите уравнение этой реакции и вычислите её тепловой эффект.
44. Напишите уравнение реакции между CO (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Вычислите её тепловой эффект.
45. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите уравнение этой реакции и вычислите её тепловой эффект.
46. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте уравнение этой реакции и вычислите теплоту образования С6Н6 (ж).
47. При сгорании газообразного аммиака образуются пары воды и оксид азота NO. Напишите уравнение этой реакции и вычислите её тепловой эффект.
48. Вычислите тепловой эффект реакции горения этана С2Н6 (г), в результате которой образуются пары воды и диоксид углерода.
49. Реакция горения аммиака выражается термохимическим уравнением
4NН3 (г) + 3 О2 (г) = 2 N2 (г) + 6 Н2О (ж); Δ Н = -1530,28 кДж.
Вычислите теплоту образования NH3 (г).
50. При получении одного моля гидроксида кальция из СаО (к) и Н2О (ж) выделяется 32,53 кДж теплоты. Напишите уравнение этой реакции и вычислите теплоту образования оксида кальция.
51. Вычислите Δ Go298 реакции:
PbO2 (к) + 2 Zn (к) = Pb (к) + 2 ZnO (к)
Можно ли восстановить PbO2 цинком по этой реакции?
52. Восстановление Fe3O4 оксидом углерода идет по уравнению:
Fe3O4 (к) + CO(г) = 3 FeO (к) + CO2 (г)
Вычислите Δ Go298 и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях.
53. Реакция горения ацителена идет по уравнению:
С2Н2 (г) + 5/2 О2 (г) = 2 СO2 (г) + Н2О (ж)
Вычислите Δ Go298 этой реакции.
54. Уменьшается или увеличивается энтропия при переходе воды в пар? Почему? Вычислите ΔSo298 для этого превращения.
55. Реакция проходит по уравнению:
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); Δ Н = -2,85 кДж?
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите Δ Go298 этой реакции.
56. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
2NO (г) + О2 (г) = 2 NO2 (г) Ответ мотивируйте, вычислив Δ Go298 прямой реакции.
57. Вычислите ΔGo298 реакции, протекающей по уравнению:
NН3 (г) + НСl (г) = NН4Сl (к)
Может ли эта реакция при стандартных условиях идти самопроизвольно?
58. Вычислите ΔGo298 реакции, протекающей по уравнению
4 NH3 (г) + 5 О2 (г) = 4 NO (г) + 6 Н2О (г)
Возможна ли эта реакция при стандартных условиях?
59. Вычислите Δ Go298 реакции, протекающей по уравнению
СО2 (г) + 4 Н2 (г) = СН4 (г) + 2 Н2О (ж)
Возможна ли эта реакция при стандартных условиях?
60. Можно ли получить карбонат ВаСО3 по реакции взаимодействия его оксида с СО2? Вывод сделайте, вычислив Δ Go298.
61. Окисление серы и ее диоксида протекает по уравнениям:
а) S (к) + О2 = SO2 (г);
б) 2 SO2 (г) + О2 = 2 SO3 (г).
Как изменяются скорости этих реакций, если объёмы каждой из систем уменьшить в четыре раза?
62. Напишите выражение для константы равновесия гомогенной системы N2 +3 H2 ↔ 2 NH3. Как изменится скорость прямой реакции – образования аммиака, если увеличить концентрацию водорода в три раза?
63. Реакция идет по уравнению N2 + O2 ↔ 2 NO. Концентрация исходных веществ до начала реакции были: [N2]исх. = 0,049 моль/ дм3; [О2]исх. = 0,01 моль/ дм3. Вычислите концентрацию эти веществ в момент, когда [NO] = 0,005 моль/ дм3.
64. Реакция идет по уравнению N2 + 3 Н2 ↔ 2 NН3. Концентрация участвующих в ней веществ были: [N2] = 0,80 моль/ дм3; [Н2] = 1,5 моль/ дм3; [NH3] = 0,10 моль/ дм3. Вычислите концентрацию водорода и аммиака, когда [N2] = 0,5 моль/ дм3.
65. Реакция идет по уравнению Н2 + I2 ↔ 2 HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ: [Н2] = 0,04 моль/ дм3; [I2] = 0,05 моль/ дм3. Вычислите начальную скорость реакции.
66. Вычислите, во сколько раз уменьшится скорость реакции, протекающей в газовой фазе, если понизить температуру от 120 до 80°С. Температурный коэффициент скорости реакции 3.
67. Как изменится скорость реакции, протекающей в газовой фазе, повышении температуры на 60°C, если температурный коэффициент скорости данной реакции равен 2?
68. В гомогенной системе СО + Cl2 ↔ COCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/ дм3; [Cl2] =0,3 моль/дм3; [COCl2] =1,2 моль/ дм3. Вычислите константу равновесия реакции.
69. В гомогенной системе A + 2B = C равновесные концентрации реагирующих газов: [A] = 0,06 моль/ дм3; [B] = 0,12 моль/ дм3; [C] =0,216 моль/ дм3. Вычислите константу равновесия системы.
70. В гомогенной системе A + B ↔ C + D равновесие установилось при концентрациях: [B] = 0,05 моль/ дм3; [C] =0,02 моль/ дм3. Константа равновесия системы равна 0,04. Вычислите равновесную концентрацию вещества A.
71. Константа скорости реакции разложения N2O, протекающей по уравнению 2N2O ↔ 2N2 + O2, равна 5×10-4. Начальная концентрация N2O = 6,0 моль/ дм3. Вычисли те начальную скорость реакции и её скорость, когда разложится 50% N2O.
72. Напишите выражение для константы равновесия гетерогенной системы
СО2 + С ↔ 2 СО. Как изменится скорость прямой реакции – образования СО, если концентрацию СО2 уменьшить в четыре раза?
73. Напишите выражение для константы равновесия гетерогенной системы
С(к) + Н2О (г) ↔ СО(г) + Н2(г). Как следует изменить концентрацию и давление, чтобы сместить равновесие в сторону обратной реакции – образования водяных паров?
74. Равновесие в гомогенной системе
4HCl (г) + О2(г) ↔ 2 Н2О (г) + 2 Cl2 (г)
установилось при следующих концентрациях реагирующих веществ: [Н2О] = 0,14 моль/ дм3; [Cl2] = 0,14 моль/ дм3; [HCl] = 0,20 моль/ дм3; [O2] =0,32 моль/ дм3. Вычислите константу равновесия этой реакции.
75. Вычислите константу равновесия для гомогенной системы
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г),
если равновесные концентрации реагирующих веществ: [СО]р. = 0,004 моль/ дм3; [Н2О]р = 0,064 моль/ дм3; [СО2]р. = 0,016 моль/ дм3; [Н2]р. = 0,016 моль/ дм3.
76. Константа равновесия гомогенной системы СО (г) + Н2О (г) ↔ СО2(г) + Н2 (г) при некоторой температуре равна 1. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО]исх. = 0,10 моль/л; [Н2О]исх. = 0,40 моль/ дм3.
77. Константа равновесия гомогенной системы N2 (г) + 3H2 (г) ↔ 2NH3 (г) при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/ дм3. Вычислите равновесную концентрацию азота.
78. При некоторой температуре равновесие гомогенной системы 2NO(г) + O2(г) ↔ 2NO2(г) установилось при следующих концентрациях реагирующих веществ: [NO] p = 0,2 моль/ дм3; [О2]р. = 0,1 моль/ дм3; [NO2] p. = 0,1 моль/ дм3. Вычислите константу равновесия.
79. Почему при изменении давления смещается равновесие системы
N2 (г)+ 3H2 (г) ↔ 2NH3 (г) и не смещается равновесие системы N2 (г)+ O2 (г) ↔ 2NO (г)? Ответ мотивируйте на основании расчета скорости прямой и обратной реакции в этих системах до, и после изменения давления.
80. Исходные концентрации [NO]исх. и [Cl2]исх. в гомогенной системе 2NO(г) + Cl2(г) ↔ 2NOCl (г) составляют соответственно 0,5 и 0,2 моль/дм3. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NO.
Модуль II
81. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na2CO3 и H2SO4; б) K2SiO3 и HCl; в)BaCl2 и Na2SO4.
82. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl;
б) FeSO4 и (NH4)2S; в) Cr(OH)3 и KOH.
83. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Mg2++CO32− = MgCO3
б) H++OH − = H2O
84. Какое из веществ: Al(OH)3; H2SO4; Ba(OH)2 – будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
85. Составьте молекулярные и ионно-молекулярные уравнения реакции взаимодействия в растворах между: а) K2CO3 и HCl; б) Zn(OH)2 и NaOH; в) CaCl2 и AgNO3.
86. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CuSO4 и H2S; б) BaCO3 и HNO3; в) FeCl3 и KOH.
87. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Cu2++S2− = CuS
б) SiO32−+2H+ = H2SiO3
88. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2.
89. Какое из веществ: K2CO3, CH3COOH, NiSO4, Na2S – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
90. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNO3 и K2CrO4; б) Pb(NO3)2 и KI; в) CdSO4 и Na2S.
91. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) CaCO3 + 2H+ = Ca2+ + H2O + CO2
б) Al(OH)3 + OH ‾ = AlO2‾ + 2 H2O
в) Pb2+ + 2I ‾= PbI2
92. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б)Cu(OH)2 и HNO3; в)ZnCO3 и HCl
93. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а)Na3PO4 и CaCl2; б) K2CO3 и BaCl2; в) Zn(OH)2 и KOH.
94. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
Cd2+ + 2OH ‾ = Cd(OH)2
H+ + NO2‾ = HNO2
95. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) CdS и HCl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2.
96. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Zn2+ + H2S = ZnS + 2H+
б) HCO3‾ + H+ = H2O + CO2
в) Ag+ + Cl ‾ = AgCl
97. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba(OH)2; б) FeCl3 и NH4OH; в) CH3COONa и HCl.
98. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и KOH; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3.
99. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
а) Ве(OH)2 + 2OH ‾ = BeO22‾ + 2H2O
б) CH3COO‾ + H+ = CH3COOH
в) Ba2+ + SO42‾ = BaSO4
100. Какое из веществ: NaCl, NiSO4, Be(OH)2, KHCO3 - взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
101. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

102. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

103. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

104. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

105. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

106. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

107. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

108. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

109. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

110. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

111. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

112. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

113. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

114. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

115. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

116. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:
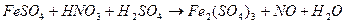
117. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:
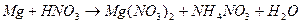
118. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:
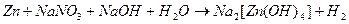
119. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

120. Методом электронного баланса рассчитайте стехиометрические коэффициенты в уравнении реакции:

121. В два сосуда с голубым раствором медного купороса поместили в первый цинковую пластинку, а во второй серебряную. В каком сосуде цвет раствора постепенно пропадает? Почему? Составьте электронные и молекулярное уравнения соответствующей реакции.
122. Увеличится, уменьшится или останется неизменной масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
123. При какой концентрации ионов Zn2+ (в моль/дм3) потенциал цинкового электрода будет на 0,015 В меньше его стандартного электродного потенциала?
124. Увеличится, уменьшится или останется неизменной масса кадмиевой пластинки при взаимодействии ее с растворами: а) AgNO3; б) ZnSO4; в) NiSO4? Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
125. Марганцевый электрод в растворе его соли имеет потенциал –1,23 В. Вычислите концентрацию ионов Mn2+(в моль/дм3). Ответ: 2 ×10-2 моль/ дм3.
126. Потенциал серебряного электрода в растворе AgNO3 составил 95% от значения его стандартного электродного потенциала. Чему равна концентрация ионов Ag+ (в моль/л)?
127. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС медно-кадмиевого гальванического элемента, в котором [Cd2+]=0,8 моль/ дм3, а [Cu2+]=0,01 моль/ дм3.
128. Составьте схемы двух гальванических элементов, в одном из которых медь была бы катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
129. При какой концентрации ионов Cu2+(в моль/ дм3) значение потенциала медного электрода становится равным стандартному потенциалу водородного электрода?
130. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, опущенных: первый в раствор AgNO3 с концентрацией 0,01моль/ дм3, а второй в раствор AgNO3 с концентрацией 0,1 моль/ дм3.
131. При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в растворе с концентрацией 0,001 моль/дм3, а другой такой же электрод – в растворе сульфата никеля с концентрацией 0,01 моль/ дм3.
132. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией [Pb2+] = [Mg2+] = 0,01 моль/дм3. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
133. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и аноде.
134. Железная и серебряная пластины соединены внешним проводником и погружены в раствор серной кислоты. Составьте схему данного гальванического элемента и напишите электронные уравнения процессов, происходящих на аноде и катоде.
135. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией [Mg2+] = [Cd2+] = 1 моль/ дм3. Изменится ли значение ЭДС, если концентрацию каждого из ионов понизить до 0,01 моль/ дм3?
136. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения реакций, протекающих на катоде и аноде. Какой концентрации надо было бы взять ионы железа (моль/ дм3), чтобы ЭДС элемента стала равной нулю, если [Zn2+] = 0,001 моль/ дм3?
137. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению
Ni + Pb(NO3)2 = Ni(NO3)2 + Pb
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Ni2+] = 0,01 моль/ дм3, [Pb2+] = 0,0001 моль/ дм3.
138. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
139. Какие химические процессы протекают на электродах при зарядке и разрядке никель-кадмиевого аккумулятора?
140. Какие химические процессы протекают на электродах при зарядке и разрядке железо-никелевого аккумулятора?
141. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
142. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
143. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
144. Если пластинку из чистого цинка опустить в разбавленную кислоту, то начинающееся выделение водорода вскоре почти прекращается. Однако при прикосновении к цинку медной палочкой на последней начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
145. В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
146. Железное изделие покрыли никелем. Какое это покрытие - анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
147. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары магний - никель. Какие продукты коррозии образуются в первом и во втором случаях?
148. В раствор хлороводородной (соляной) кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
149. Почему химически чистое железо более стойко против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в кислой среде.
150. Какое покрытие металла называется анодным и какое - катодным? Назовите несколько металлов, которые могут служить для анодного и катодного покрытия железа. Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии железа, покрытого медью, во влажном воздухе и в кислой среде.
151. Железное изделие покрыли кадмием. Какое это покрытие — анодное или катодное. Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
152. Железное изделие покрыли свинцом. Какое это покрытие — анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в хлороводородной (соляной) кислоте. Какие продукты коррозии образуются в первом и в втором случаях?
153. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этих пластинок. Каков состав продуктов коррозии железа?
154. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии. Какой состав продуктов коррозии?
155. Если опустить в разбавленную серную кислоту пластинку из чистого железа, то выделение на ней водорода идет медленно и со временем почти прекращается. Однако, если цинковой палочкой прикоснуться к железной пластинке, то на последней начинается бурное выделение водорода. Почему? Какой металл при этом растворяется? Составьте электронные уравнения анодного и катодного процессов.
156. Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
157. Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
158. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
159. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий - железо. Какие продукты коррозии образуются в первом и во втором случаях?
160. Как протекает атмосферная коррозия железа, покрытого слоем никеля, если покрытие нарушено? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии?
Таблица вариантов контрольных заданий
(номер варианта определяется по двум последним цифрам номера студенческого билета)
| № вар-та | Номера задач | |||||||
| Модуль I | Модуль II | |||||||
ПРИЛОЖЕНИЕ
1. Стандартные теплоты (энтальпии) образования некоторых веществ
| Вещество | Состояние | ΔH0298,кДж/моль | Вещество | Состояние | ΔH0298,кДж/моль |
| C2H2 | г | +226,75 | CH3OH | г | –201,17 |
| CS2 | г | +115,28 | C2H5OH | г | –235,31 |
| NO | г | +90,37 | H2O | г | –241,83 |
| C6H6 | г | +82,93 | H2O | р | –285,84 |
| C2H4 | г | +52,28 | NH4Cl | к | –315,39 |
| H2S | г | –20,15 | CO2 | г | –393,51 |
| NH3 | г | –46,19 | Fe2O3 | к | –822,10 |
| CH4 | г | –74,85 | TiO2 | к | –944,75 |
| C2H6 | г | –84,67 | Ca(OH)2 | к | –986,50 |
| HCl | г | –92,31 | Al2O3 | к | –1669,80 |
| CO | г | –110,52 |
Стандартные энергии Гиббса образования некоторых веществ
| Вещество | Состояние | ΔG0298,кДж/моль | Вещество | Состояние | ΔG0298,кДж/моль |
| BaCO3 | к | –1138,8 | ZnO | к | –318,20 |
| CaCO3 | к | –1128,75 | Fe | к | –244,30 |
| Fe3O4 | к | –1014,20 | H2O | р | –237,19 |
| BeCO3 | к | –944,75 | H2O | г | –228,59 |
| CaO | к | –604,20 | PbO2 | к | –219,00 |
| BeO | к | –581,61 | CO | г | –137,27 |
| BaO | к | –528,40 | CH4 | г | –50,79 |
| NaF | к | –543,46 | NO2 | г | +51,84 |
| CO2 | г | –394,48 | NO | г | +86,69 |
| NaCl | к | –384,03 | C2H2 | г | +209,20 |






