12.1 Углекислый газ транспортируется кровью в разных состояниях. Расположите следующие транспортные формы СО2 по степени процентного преобладания в общей доле транспортируемой углекислоты:
1. карбгемоглобин;
2. бикарбонат;
3. физически растворенный СО2.
12.2 Расположите реакции синтеза гема в той последовательности, в которой они протекают в организме:
1. образование порфобиллиногена;
2. образование δ-аминолевулиновой кислоты;
3. образование протопорфирина IX;
4. присоединение железа.
12.3 Снижение концентрации общего белка в плазме крови называется … и может наблюдаться при …
12.4 Повышение концентрации общего белка плазмы крови называется …и может наблюдаться вследствие…
12.5 Перечислите основные буферные системы крови…
12.6 Метаболизм глюкозы в эритроцитах представлен …
12.7 В связи с высокими концентрациями кислорода в эритроците создаются благоприятные условия для окисления гемоглобина в метгемоглобин, который не может выполнять функцию переноса кислорода. Обратное восстановление метгемоглобина в гемоглобин осуществляется при участии фермента …, донором электронов и протонов в котором служит кофермент …
12.8 Транспорт и депонирование железа в организме происходит при участии … соответственно.
12.9 Ключевой реакцией синтеза гема является образование …, реакцию катализирует фермент…, который ингибируется …
12.10 На синтез одной молекулы гема используется … молекул глицина.
12.11 Заболевания, обусловленные наследственным дефектом ферментов синтеза гема, называются …
12.12 Подберите к указанным типам гемоглобина соответствующие наборы полипептидных цепей:
| А – Нв А1 | 1. α2γ2 |
| Б – Нв А2 | 2. α2β2 |
| В – Нв F | 3. α2δ2 |
12.13 Определите участок β полипептидной цепи, принадлежащий нормальному гемоглобину и гемоглобину S:
| А – нормальный гемоглобин; | 1. вал-гис-лей-тре-про-глу-глу-лиз-… |
| Б – гемоглобин S. | 2. вал-гис-лей-тре-про-вал-глу-лиз-… |
12.14 Сравните два белка, участвующие в обмене железа:
| А – Только трансферрин. | 1. Содержит негемовое железо. |
| Б – Только ферритин. | 2. Содержит гемовое железо. |
| 3. Гликопротеин плазмы крови. | |
| 4. Депонирует железо в клетках организма. |
12.15 Сравните функции разных белковых фракций крови:
| А – альбумины; | 1. Обеспечивают иммунитет. |
| Б – α1 глобулины; | 2. Обеспечивают осмотическое давление крови. |
| В – α2 глобулины; | 3. Осуществляют транспорт кислорода. |
| Г – β глобулины. | 4. Осуществляют транспорт гидрофобных молекул (жирные кислоты, билирубин и т.д.). |
| Д – γ глобулины | 5. Осуществляют транспорт тироксина, кортикостероидов. |
| 6. Осуществляют транспорт железа. | |
| 7. Осуществляет транспорт меди. | |
| 8. Содержат ингибиторы тканевых протеиназ. |
12.16 Многие ферменты крови могут быть использованы для диагностики заболеваний и контроля эффективности лечения. При патологии каких органов в крови повышается активность перечисленных ниже ферментов?
| А – Печень. | 1. ЛДГ 4,5. |
| 2.ЛДГ1,2 | |
| Б – Сердце. | 3. Амилаза. |
| 4. Креатинфосфокиназа (МВ форма). | |
| В – Поджелудочная железа. | 5. Аланинаминотрансфераза. |
| 6. Аспартатаминотрансфераза. |
12.17 Укажите возможные причины:
| А – Гиперпротеинемий. | 1. нефротический синдром; |
| 2. обильные рвоты; | |
| 3. обширные ожоги; | |
| Б – Гипопротеинемии. | 4. поражение печени; |
| 5. острые инфекции; | |
| 6. белковая недостаточность. |
12.18 Подберите верные утверждения для следующих понятий:
| А – ацидоз; | 1. сдвиг рН крови в кислую сторону; |
| 2. развивается на фоне гипервентиляции легких; | |
| Б – алкалоз. | 3. сдвиг рН крови в щелочную сторону; |
| 4. развивается на фоне сахарного диабета. |
12.19 Подберите к перечисленным патологиям соответствующее определение:
| А – парапротеинемия; | 1. нарушение синтеза одной из нормальных цепей гемоглобина; |
| Б – талассемия; | 2. появление в крови белков не свойственных нормальному организму; |
| В – порфирия; | 3. нарушение процентного соотношения основных белковых фракций; |
| Г- диспротеинемия; | 4. наследственное изменение структуры одной из полипептидных цепей гемоглобина; |
| Д – гемоглобинопатии. | 5. накопление предшественников гема, вследствие дефекта ферментов участвующих в его синтезе. |
12.20 Гемоглобин транспортирует по крови:
1. азот;
2. углекислый газ;
3. кислород;
4. аммиак.
12.21 Гемоглобин относится к классу:
1. нуклеопротеинов;
2. фосфопротеинов;
3. хромопротеинов;
4. флавопротеинов.
12.22 Какие функции гемоглобина нарушаются при серповидноклеточной анемии?
1. растворимость;
2. кооперативность;
3. снижается сродство гемоглобина к кислороду;
4. повышается сродство к кислороду;
5. деформируется эритроцит.
12.23 По какому признаку разделяют белки крови методом электрофореза?
1. по молекулярной массе;
2. по растворимости в буферных растворах;
3. по заряду.
12.24 К группе гемопротеинов относятся:
1. миоглобин;
2. трансферрин;
3. церулоплазмин;
4. каталаза.
12.25 Какие виды гемоглобинов содержатся в эритроцитах здорового человека:
1. НвА1
2. НвА2
3. НвА3
4. НвF
5. НвС
12.26 Экскреторными ферментами называют:
1. ферменты, синтезируемые преимущественно в печени в норме, выделяющиеся в кровь и выполняющие определенную функцию;
2. ферменты, синтезируемые в печени и выделяемые с желчью;
3. ферменты, синтезируемые в клетках и попадающие в кровь при повреждении тканей;
4. ферменты, синтезирующиеся в любой ткани;
5. ферменты, определяемые качественными реакциями.
12.27 Секреторными ферментами называют:
1. ферменты, синтезируемые преимущественно в печени в норме выделяющиеся в кровь и выполняющие определенную функцию;
2. ферменты, синтезируемые в печени и выделяемые с желчью;
3. ферменты, синтезируемые в клетках и попадающие в кровь при повреждении тканей;
4. ферменты, синтезирующиеся в любой ткани;
5. ферменты, определяемые качественными реакциями.
12.28 Индикаторными ферментами называют:
1. ферменты, синтезируемые преимущественно в печени, в норме выделяющиеся в кровь и выполняющие определенную функцию;
2. ферменты, синтезируемые в печени и выделяемые с желчью;
3. ферменты, синтезируемые в клетках и попадающие в кровь при повреждении тканей;
4. ферменты, синтезирующиеся в любой ткани;
5. ферменты, определяемые качественными реакциями.
12.29 Органоспецифичные ферменты печени:
1. ЛДГ;
2. аргиназа;
3. креатинфосфокиназа;
4. липаза;
5. орнитинкарбомоилтрансфераза.
12.30 Белки крови синтезируются в:
1. печени;
2. РЭС;
3. стенке кишечника;
4. соединительной ткани.
12.31 Кровь выполняет функции:
1. транспортную, осморегулирующую;
2. буферную, обезвреживающую;
3. синтетическую, экскреторную;
4. защитную, иммунологическую;
5. регуляторную, гомеостатическую.
12.32 Какие нарушения в структуре и функции гемоглобина имеют место при талассемии?
1. снижается растворимость гемоглобина;
2. нарушается синтез одной из цепей гемоглобина;
3. нарушается кооперативность;
4. повышается сродство гемоглобина к кислороду.
12.33 В состав α2-глобулинов входят:
1. церулоплазмин;
2. гаптоглобин;
3. трансферрин;
4. гемопексин;
5. макроглобулин.
12.34 Преальбумины выполняют функции:
1. связывание и транспорт гемовой структуры Hb;
2. связывание и транспорт тироксина;
3. транспорт ретинолсвязывающего белка;
4. связывание и транспорт железа и меди.
12.35 β-глобулины содержат:
1. трансферрин;
2. гемопексин;
3. гаптоглобин;
4. тироксинсвязывающий белок;
5. С-реактивный белок.
12.36 Обезвреживающие функции крови осуществляются в результате:
1. действия фосфатного и белкового буферов крови;
2. разведения токсичных веществ;
3. действия ферментов и плазмы и клеток крови;
4. связывания токсических веществ альбуминами.
12.37 Резервный гемопротеин ферритин откладывается в клетках:
1. сердца;
2. печени;
3. лимфоузлов;
4. костного мозга;
5. спинного мозга.
12.38 Функции гаптоглобина:
1. связывание свободного гемоглобина;
2. обеспечение переноса Fe;
3. связывает гемовую чать гемоглобина;
4. ингибирует тканевые протеазы;
5. транспорт тироксина.
12.39 Функции церулоплазмина:
1. транспорт меди;
2. ингибитор тканевых протеаз;
3. транспорт железа;
4. транспорт гемоглобина;
5. транспорт ретинола.
12.40 В состав альфа1-глобулинов входят:
1. церулоплазмин, гаптоглобин;
2. альфа-антитрипсин, ингибитор тканевых протеаз;
3. С-реактивный белок, гемопепсин;
4. тироксинсвязывающий белок, транскортин.
12.41 При недостаточном белковом питании и связанными с ним «голодными» отеками происходит:
1. нарушение экскреторной функции почек;
2. нарушение образования альбуминов в печени;
3. увеличение ионов натрия в крови;
4. повышение концентрации общего белка в крови.
12.42 Поддержание осмотического давления внутри сосуда обеспечивается:
1. альбуминами;
2. катионами натрия;
3. действием цАМФ;
4. катионами кальция;
5. содержанием глюкозы.
12.43 Что является источником железа для синтеза гема:
1. цитохромы;
2. миоглобин;
3. ферритин;
4. каталаза;
5. метионин.
12.44 Выберите соединения, которые используются для синтеза гема:
1. глицин;
2. ацетил-КоА;
3. железо;
4. гуанидиноацетат;
5. сукцинил-КоА;
6. малат.
12.45 Ключевой реакцией в синтезе гема, по которой происходит регуляция процесса, является:
1. образование порфобиллиногена;
2. образование δ-аминолевулиновой кислоты;
3. образование протопорфирина IX;
4. присоединение железа с образованием гема.
12.46 Выберите ферменты, препятствующие окислению гемоглобина в метгемоглобин и образованию активных форм кислорода:
1. каталаза;
2. глюкозо-6-фосфат дегидрогеназа;
3. глютатионпероксидаза;
4. метгемоглобинредуктаза;
5. гексокиназа;
6. аланинаминотрансфераза;
7. супероксиддисмутаза.
12.47 Небелковым компонентом аминолевулинатсинтетазы является:
1. ФАД
2. НАД
3. НАДФ
4. ТПФ
5. ПФ
12.48 Способность гемоглобина связывать кислород зависит от:
1. рН;
2. концентрации глюкозы в крови;
3. температуры;
4. парциального давления кислорода;
5. осмотического давления крови;
6. концентрации 2,3-дифосфоглицерата;
7. возраста.
12.49 В капиллярах тканей происходят следующие процессы:
1. ННвО2 + КНСО3 = КНвО2 + Н2СО3
2. КНвО2 = О2 + КНв
3. Н2О + СО2 = Н2СО3
4. КНв + Н2СО3 = КНСО3 + ННв
5. КНв + О2 = КНвО2
12.50 К секреторным ферментам относятся:
1. глутаматдегидрогеназа;
2. кислая фосфатаза;
3. щелочная фосфатаза;
4. ацетилхолинэстераза;
5. лактатдегидрогеназа;
6. тромбокиназа;
7. протромбин.
12.51 К экскреторным ферментам относятся:
1. лейцинаминопептидаза;
2. аланинаминотрансфераза;
3. лактатдегидрогеназа;
4. щелочная фосфатаза;
5. кислая фосфатаза;
6. глутаматдегидрогеназа.
12.52 К индикаторным ферментам относятся:
1. холинэстераза;
2. аспартатаминотрансфераза;
3. аланинаминотрансфераза;
4. щелочная фосфатаза;
5. креатинфосфокиназа;
6. лактатдегидрогеназа.
12.53
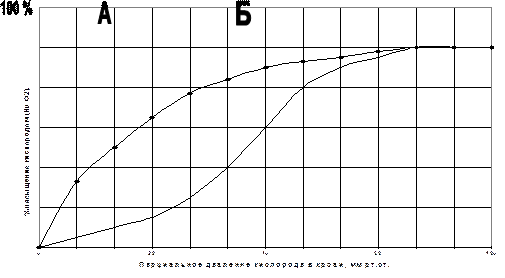 |
На рисунке изображены графики, отражающие связывание кислорода гемоглобином и миоглобином. Определите, какая из этих кривых принадлежит миоглобину?
12.54 Для диагностики инфаркта миокарда в крови определяются следующие ферменты:
1. малатдегидрогеназа (МДГ), аспартатаминотрансфераза (АсАТ)
2. глутаматдегидрогеназа (ГДГ), аланинаминотрансфераза (АлАТ)
3. АсАТ, МВ-изофермент креатинфосфокиназы (МВ-КФК)
4. МДГ, аргиназа
5. щелочная фосфатаза, альдолаза.
Раздел 13. БИОХИМИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ.
13.1 Определите порядок реакций образования проколлагена в эндоплазматическом ретикулуме:
1. гидроксилирование пролина и лизина;
2. удаление N-концевой сигнальной последовательности;
3. образование внутри- и межмолекулярных дисульфидных связей;
4. образование тройной спирали;
5. гликозилирование.
13.2 Определите порядок синтеза коллагена в межклеточном пространстве:
1. окисление лизиновых, оксилизиновых и гликозилированных остатков в альдегиды;
2. образование незрелых коллагеновых фибрилл;
3. удаление амино- и карбоксиконцевых пептидов;
4. образование перекрестных связей между цепями фибрилл.
13.3 Выберите положения, характеризующие:
| А – Протеогликаны. | 1. На долю белка приходится 80-90% от общей массы. |
| 2. Углеводный компонент – олигосахариды. | |
| 3. Локализация – межклеточное вещество. | |
| Б – Гликопротеины. | 4. Углеводный компонент – гетерогенные олигосахариды. |
| 5. На долю белка приходится 1-5% от общей массы. | |
| 6. Локализация – мембраны, плазма крови. |
13.4 Выберите аминокислоты, преобладающие в:
| А – эластине; | 1. аланин; |
| 2. пролин; | |
| 3. валин; | |
| Б – коллагене. | 4. триптофан; |
| 5. цистеин; | |
| 6. оксипролин. |
13.5 Выберите особенности, характерные для:
| А – коллагена; | 1. Фибриллярный белок. |
| 2. Глобулярный белок. | |
| Б – эластина; | 3. Содержит аминокислоту десмозин. |
| 4. Имеет надмолекулярную структуру. | |
| В – обоих белков. | 5. Преобладающими аминокислотами являются пролин и оксипролин. |
| 6. Образуют волокна. | |
| 7. Содержат в больших количествах глицин. |
13.6 Укажите, где происходят перечисленные ниже этапы синтеза коллагена.
| 1. Синтез препроколлагена. | А - рибосомы фибробластов. |
| 2. Образование фибрилл. | Б - цитоплазма фибробластов. |
| 3. Формирование проколлагена. | В - межклеточное вещество. |
| 4. Формирование коллагеновых волокон. |
13.7 Укажите, где происходят перечисленные ниже этапы синтеза коллагена?
| Этапы созревания коллагена: | Компартменты клетки: |
| 1. гликозилирование пролина; | А - рибосомы фибробластов. |
| 2. образование поперечных сшивок между фи бриллами; | |
| 3. гидроксилирование пролина; | Б -цитоплазма фибробластов. |
| 4. избыточный синтез ППЦ; | |
| 5. образование деспирализованных участков полипептидной цепи (ППЦ); | |
| 6. ограниченный протеолиз; | В - межклеточное вещество. |
| 7. образование фибрилл. |
13.8 Как изменятся биохимические показатели соединительной ткани при старении?
К каждому пункту подставить соответствующую букву:
| А – увеличится. | 1. соотношение основное вещество/волокно; |
| 2. обмен коллагена; | |
| 3. активность гиалуронидазы; | |
| 4. активность коллагеназы; | |
| Б – уменьшится. | 5. потеря оксипролина; |
| 6. содержание гиалуроновой кислоты; | |
| 7. соотношение кератансульфата/хондроитинсульфата. |
13.9 Протеогликановый агрегат содержит:
1. хондроитинсульфаты;
2. коровый белок;
3. гепарин;
4. кератансульфаты;
5. связывающий белок;
6. гиалуроновую кислоту;
7. дерматансульфаты;
8. альбумин.
13.10 Поперечные сшивки в молекуле эластина образуются с участием следующих аминокислот:
1. десмозина;
2. лизина;
3. лизинорлейцина;
4. изодесмозина;
5. лейцина;
6. глицина.
13.11 Десмозин – это:
1. 4 остатка лизина;
2. 4 остатка оксилизина;
3. 4 остатка аргинина;
4. 4 остатка валина.
13.12 Назовите особенности строения соединительной ткани:
1. большое содержание клеток;
2. малое содержание клеток;
3. богата межклеточным веществом;
4. содержит большое количество липидов;
5. содержит большое количество белков;
6. богата фибрильными структурами.
13.13 Надмолекулярная структура коллагена - это:
1. альфа спираль полипептидной цепи;
2. объединение полипептидных цепей в фибриллу;
3. объединение фибрилл тропоколлагена.
13.14 Выберите аминокислоты, отсутствующие в молекуле коллагена:
1. аланин;
2. триптофан;
3. пролин;
4. лейцин;
5. метионин;
6. валин.
13.15 В составе коллагена у детей:
1. больше оксипролина;
2. меньше оксипролина;
3. меньше сшивок между фибриллами;
4. больше ковалентных сшивок между фибриллами.
13.16 Коровый белок – это:
1. белок, объединяющий протеогликаны в углеводно-белковые комплексы (УБК);
2. белок, объединяющий глюкозамингликаны в протеогликаны.
13.17 Какие связи стабилизируют коллагеновое волокно?
1. водородные, нековалентные;
2. альдольные, ковалентные;
3. адсорбционные;
4. ионные;
5. пептидные.
13.18 Какие условия необходимы для гидроксилирования пролина при синтезе коллагена?
1. ионы Fе;
2. НАДФН;
3. НАД;
4. аскорбиновая к-та;
5. кислород;
6. пролилгидроксилаза.
13.19 Межклеточное вещество в соединительной ткани представлено:
1. протеогликанами;
2. гликопротеинами;
3. гетерополисахаридами;
4. углеводно-белковыми комплексами.
13.20 Тропоколлаген - это:
1. суперспираль, объединяюшая три ППЦ;
2. одна ППЦ коллагена;
3. волокно, объединяющее фибриллы коллагена.
13.21 Какие аминокислоты участвуют в формировании водородных связей тропоколлагена?
1. аланин;
2. оксипролин;
3. лизин;
4. глицин.
13.22 Что такое проколлаген?
1. 3-х цепочечная спираль, содержащая не гидроксилированные лизин и пролин;
2. три полипептидные цепи, не сформированные в спираль, имеющие добавочные аминокислотные последовательности у С- и N- концов;
3. одноцепочечная спираль коллагена с гидроксилированными и гликозилированными аминокислотами.
13.23 Почему с возрастом суточное выделение оксипролина с мочой уменьшается?
1. c возрастом увеличивается распад коллагена из-за уменьшения связей, стабилизирующих молекулу;
2. c возрастом замедляется распад коллагена из-за возрастания ковалентных связей;
3. c возрастом активируется коллагеназа;
4. c возрастом ингибируется коллагеназа.
13.24 Перечислите функции протеогликанов в составе межклеточного вещества соединительной ткани:
1. опорная;
2. фильтрация микроорганизмов;
3. депонирование ионов;
4. энергетическая;
5. кофакторная;
6. гидроосмотическая.
13.25 Чем отличается коллаген типа альфа -1от альфа-2:
1. по составу и чередованию аминокислот;
2. по количеству ППЦ в коллагене;
3. по прочности связи фибрилл в коллагеновом волокне.
13.26 Где происходит синтез пре-про-коллагена?
1. в аппарате Гольджи, внутри ретикулоэндотелиальной системы;
2. в ядре;
3. в рибосоме.
13.27 При гипервитаминозе Д3происходит деструкция как минеральных, так и органических компонентов кости. Концентрация каких компонентов будет увеличиваться в моче?
1. коллагена;
2. глицина;
3. оксипролина;
4. оксилизина.
13.28 Что общего у коллагена и эластина?
1. небольшое содержание оксипролина;
2. фибриллярные белки;
3. большое содержание глицина;
4. образуют волокна;
5. содержат десмозин;
6. обладают упругостью;
7. имеют надмолекулярную структуру.
13.29 Какова функция гиалуроновой кислоты в организации межклеточного матрикса?
1. участвует в связывании со структурными белками;
2. связывает протеогликаны, образуя структуру "ерша";
3. связывает гликозамингликаны, образуя структуру "ерша".
13.30 Глицин коллагена участвует в формировании связей:
1. альфа-спирали ППЦ;
2. коллагенового волокна;
3. суперспирали тропоколлагена;
4. в образовании водородных связей;
5. в образовании альдольной связи.
13.31 Коллаген содержит:
1. одну ППЦ (полипептидную цепь);
2. более 100 ППЦ;
3. пролин, триптофан;
4. глицин, оксипролин;
5. моносахариды;
6. геторополисахариды.
13.32 В формировании связи между фибриллами коллагена участвуют:
1. глюкоза и галактоза;
2. оксипролин и лизин;
3. глицин и пролин.
13.33 Нарушение структуры коллагена, связанное со снижением активности пролилгидроксилазы связано с:
1. дефицитом витамина С;
2. мутациями в ДНК фибробластов;
3. дефицитом меди;
4. дефицитом витамина А;
5. недостаточностью кислорода.
13.34 Какие витамины могут явиться причиной нарушения образования коллагенового волокна:
1. биотин;
2. витамина С;
3. витамина А;
4. витамин В12.
13.35 Укажите свойства, характерные для эластина (отличные от коллагена):
1. имеет много генетических типов;
2. имеет один генетический тип;
3. представлен тройной спиралью;
4. состоит из одной спирали;
5. первичная структура состоит из последовательности аминокислотных остатков (Гли-X-Y);
6. содержит углеводный компонент.
13.36 Какие факторы могут явиться причиной нарушения первичной структуры коллагена?
1. дефицит витамина С;
2. мутации в ДНК фибробластов;
3. дефицит меди;
4. недостаток витамина А;
5. недостаточность кислорода.
13.37 Об обмене соединительной ткани судят по выведению с мочой:
1. мочевины
2. оксипролина
3. глицина
4. мочевой кислоты
5. гиалуроновой кислоты
13.38Витамин С принимает участие в:
1. синтезе гликогена
2. созревании коллагена
3. синтезе гемоглобина
4. синтезе нуклеиновых кислот
5. синтезе фосфолипидов мембран






