ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ
1. Фазовое пространство. Функция распределения. Статистическая независимость. Теорема Лиувилля.
2. Роль энергии. Энтропия. Закон возрастания энтропии.
3. Определение основных термодинамических величин (температура и давление).
4. Условия теплового и механического равновесия.
5. Работа и количество тепла. Теплоемкость. Основные термодинамические потенциалы.
6. Соотношения между термодинамическими производными.
7. Процесс Джоуля – Томсона.
8. Максимальная работа.
9. Термодинамические флуктуации основных физических величин.
10. Термодинамические неравенства.
11. Зависимость термодинамических величин от числа частиц.
12. Условия равновесия в системах с переменным числом частиц.
13. Условия равновесия во внешнем поле.
14. Уравнение Клайперона-Клаузиуса
15. Равновесие фаз с искривленной поверхностью
16. Условия равновесия однокомпонентных флюидов в рамках уравнения ван-дер-Ваальса
17. Преобразования Лежандра. Различные термодинамические потенциалы.
18. Распределение Гиббса. Свободная энергия и распределение Гиббса.
19. Идеальный газ. Распределение Больцмана. Свободная энергия идеального газа.
20. Уравнение состояния идеального газа. Идеальный газ с постоянной теплоемкостью.
21. Закон равнораспределения.
22. Отклонение газов от идеальности. Первый вириальный коэффициент.
23. Уравнение ван – дер – Ваальса. Свободная энергия газа ван – дер – Ваальса.
24. Уравнение Пенга-Робинсона. Свободная энергия в рамках уравнения Пенга-Робинсона
25. Приведенные уравнения состояния.
26. Критическая точка газа ван – дер – Ваальса.
27. Критическая точка в рамках уравнения Пенга-Робинсона.
28. Растворы. Правило фаз Гиббса
29. Термодинамический потенциал разбавленных растворов.
30. Условие равновесия по отношению к растворителю.
31. Условие равновесия по отношению к растворенному веществу
Задачи по термодинамике и статистической физике
1. Уравнение состояния газа имеет вид
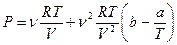 (
(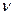 - число молей)
- число молей)
Найти выражение для плотности энтропии газа.
2. Два одинаковых идеальных газа с одинаковыми температурами 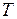 и числами частиц
и числами частиц 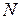 , но с разными давлениями
, но с разными давлениями 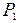 и
и  находятся в двух сосудах. Затем сосуды соединяются; определить изменение энтропии.
находятся в двух сосудах. Затем сосуды соединяются; определить изменение энтропии.
3. Два одинаковых идеальных газа с одинаковыми давлениями  и числом частиц
и числом частиц 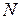 . Но с разными температурами
. Но с разными температурами 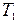 и
и  находятся в сосудах с объемами
находятся в сосудах с объемами 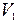 и
и  . Затем сосуды соединяются. Найти изменение энтропии.
. Затем сосуды соединяются. Найти изменение энтропии.
4. Найти работу, производимую над идеальным газом при адиабатическом сжатии.
5. Найти количества тепла, получаемого газом при процессе, происходящем при постоянном объеме (изохорном).
6. Найти работу и количества тепла при процессе, происходящем при постоянном давлении (изобарном).
7. Найти работу, совершаемую над газом и количества тепла, получаемое им при сжатии от объема 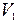 до
до  , согласно уравнению
, согласно уравнению 
 (политропический процесс).
(политропический процесс).
8. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им, для цикла, состоящего из двух изохорных и двух изобарных процессов (последовательные состояния газа имеют давление и объем: 1) 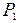 ,
, 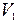 ; 2)
; 2) 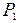 ,
,  ; 3)
; 3)  ,
,  ; 4)
; 4)  ,
, 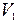 ; 5)
; 5) 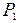 ,
, 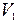 ).
).
9. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им для цикла, состоящего из двух изохорных и двух изотермических процессов (последовательные состояния газа имеют объем и температуру: 1) 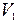 ,
, 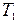 ; 2)
; 2) 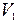 ,
,  ; 3)
; 3)  ,
,  ; 4)
; 4)  ,
, 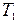 ; 5)
; 5) 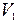 ,
, 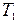 ).
).
10. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им, для цикла из двух изотермических и двух адиабатических процессов (последовательные состояния имеют энтропию, температуру и давление: 1) 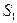 ,
, 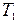 ,
, 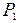 ; 2)
; 2) 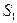 ,
,  , 3)
, 3) 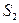 ,
,  ,
,  ; 4)
; 4) 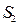 ,
, 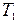 ; 5)
; 5) 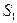 ,
, 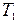 ,
, 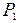 ).
).
11. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им, для цикла из двух изобарных и двух изотермических процессов (последовательные состояния: 1) 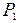 ,
, 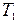 ; 2)
; 2) 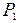 ,
,  ; 3)
; 3)  ,
,  ; 4)
; 4)  ,
, 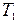 ; 5)
; 5) 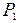 ,
, 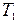 ).
).
12. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им, для цикла из двух изобарных и двух адиабатических процессов (последовательное состояние газа: 1) 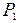 ,
, 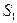 ,
, 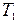 ; 2)
; 2) 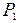 ,
, 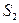 ; 3)
; 3)  ,
, 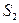 ,
,  ; 4)
; 4)  ,
, 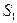 ; 5)
; 5) 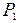 ,
, 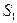 ,
, 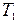 ).
).
13. Найти работу, производимую над идеальным газом, и количество тепла, получаемое им, для цикла из двух изохорных и двух адиабатических процессов (последовательные состояния: 1) 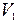 ,
, 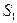 ,
, 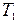 ; 2)
; 2) 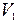 ,
, 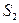 ; 3)
; 3)  ,
, 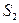 ,
,  ; 4)
; 4)  ,
, 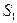 ; 5))
; 5)) 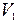 ,
, 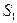 ,
, 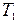 ).
).
14. Определить максимальную работу, которую можно получить при соединении сосудов с двумя одинаковыми идеальными газами, имеющими одинаковые температуру  и число частиц
и число частиц 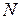 , но разные объемы
, но разные объемы 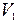 и
и  .
.
15. Определить максимальную работу, которую можно получить при соединении сосудов с двумя одинаковыми идеальными газами, если до соединения сосудов газы имели одинаковое давление 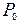 и разные температуры
и разные температуры 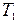 и
и  .
.
16. Найти минимальную работу, которую надо произвести над идеальным газом для того, чтобы сжать его от давления 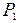 до давления
до давления  при постоянной температуре среды (
при постоянной температуре среды (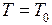 ).
).
17. Определить максимальную работу, которую можно получить с помощью идеального газа при охлаждении от температуры 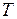 до температуры среды
до температуры среды  при постоянном объеме.
при постоянном объеме.
18. Определить максимальную работу, которую можно получить с помощью газа, охлаждающегося от температуры  до температуры среды
до температуры среды 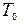 и в то же время расширяющегося так, что его давление меняется от
и в то же время расширяющегося так, что его давление меняется от 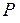 до давления среды
до давления среды 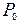 .
.
19. Найти 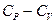 для неидеального газа, описывемого уравнением Пенга-Робинсона..
для неидеального газа, описывемого уравнением Пенга-Робинсона..
20. Найти уравнение адиабатического процесса для газа ван-дер-Ваальса с постоянной теплоемкостью 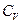 .
.
21. Найти изменение температуры для газа ван-дер-Ваальса с постоянной теплоемкостью 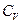 при расширении этого газа в пустоту.
при расширении этого газа в пустоту.
22. Найти зависимость точки инверсии процесса Джоуля – Томсона от температуры для газа ван-дер-Ваальса с постоянной теплоемкостью 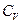 .
.
23. Найти параметры 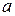 и
и 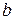 уравнения Пенга-Робинсона для метана. Критические параметры метана равны
уравнения Пенга-Робинсона для метана. Критические параметры метана равны 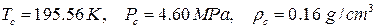
24. Найти параметры 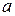 и
и 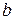 уравнения Пенга-Робинсона для этана. Критические параметры этана равны
уравнения Пенга-Робинсона для этана. Критические параметры этана равны 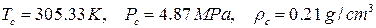
25. Найти параметры 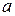 и
и 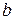 уравнения Пенга-Робинсона для пропана. Критические параметры пропана равны
уравнения Пенга-Робинсона для пропана. Критические параметры пропана равны 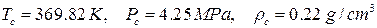
28. Пусть газ подчиняется уравнению состояния ван-дер-Ваальса 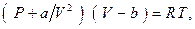 а его молярная теплоемкость при постоянном объеме
а его молярная теплоемкость при постоянном объеме 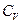 постоянна и не зависит от температуры. Показать, что внутренняя энергия (на 1 моль) такого газа
постоянна и не зависит от температуры. Показать, что внутренняя энергия (на 1 моль) такого газа 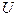 определяется выражением
определяется выражением
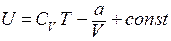
и что при адиабатическом квазистатическом изменении выполняется соотношение
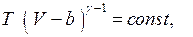 или
или 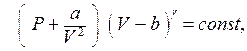
где 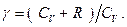 Кроме того, найти изменение температуры этого газа при его свободном расширении в вакуум.
Кроме того, найти изменение температуры этого газа при его свободном расширении в вакуум.
29. Доказать, что у газа ван-дер-Ваальса теплоемкость при постоянном объеме зависит только от температуры, и найти выражение для внутренней энергии и энтропии.
30. Пусть для некоторого твердого тела экспериментально найдено, что при температуре 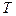 в интервале давлений
в интервале давлений 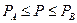 имеет место следующая зависимость:
имеет место следующая зависимость:
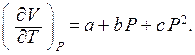
Насколько возрастет энтропия при сжатии тела от давления  до
до  при постоянной температуре
при постоянной температуре 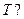
31. Доказать выражения для к.п.д. цикла Отто (рабочим веществом является идеальный газ):
 |
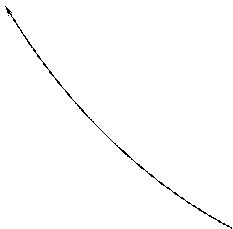

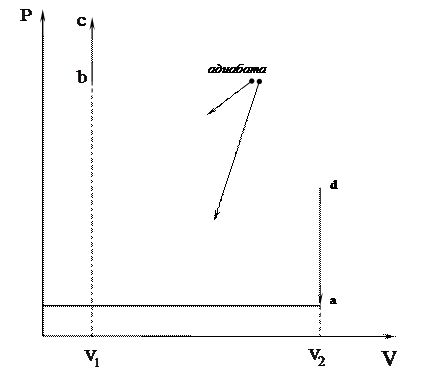 |
32. Доказать выражения для к.п.д. цикла Джоуля (рабочим веществом является идеальный газ):
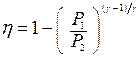
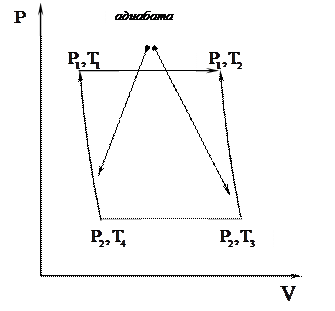 |
33. Доказать выражения для к.п.д. цикла Дизеля (рабочим веществом является идеальный газ):
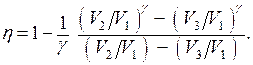
 При этом считать, что
При этом считать, что 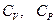 и
и  константы.
константы.
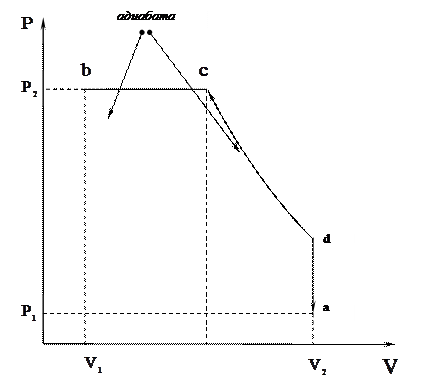 |






