| Дано: | Решение: | |
| ω (раствора) = 15% m (раствора) = 250г | 1.Рассчитать массу соли, необходимую для приготовления раствора с заданной концентрацией (ω = 15%):


| |
| m (H2O) =? m (соли) =? | ||
| 2.Рассчитать массу воды, необходимой для приготовления раствора: m (H2O) = m (раствора) – m (соли) m (H2O) = 250г – 37,5г = 212,5г | ||
| Ответ: | Для приготовления раствора с ω=15% потребуется 37,5 г соли и 212,5 г воды. |
Сколько граммов хлорида аммония потребуется, чтобы приготовить 1.6 кг раствора с массовой долей 10%?
| Дано: | Решение: | ||
| ω (раствора) = 10% m (раствора) =1,6 кг | 1.Перевести единицы: 1,6 кг = 1600 г | ||
2.Рассчитать m(NH4Cl), необходимую для приготовления раствора с заданной концентрацией (ω = 10%):


| |||
| m (NH4Cl) =? | |||
| Ответ: | Для приготовления раствора хлорида аммония с ω=10% потребуется 160г вещества. | ||
Сколько граммов воды потребуется для растворения 12 г хлорида натрия, чтобы получить раствор с массовой долей 5%?
| Дано: | Решение: |
| ω (раствора) = 5% m (NaCl) = 12 г m (H2O)=? | 1.Рассчитать массу раствора с заданной концентрацией ω = 5%:

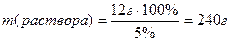
|
| 2.Рассчитать массу воды, необходимую для приготовления раствора: m (H2O) = m (раствора) – m (NaCl) m (H2O) = 240 г – 12 г = 228 г | |
| Ответ: | Для приготовления раствора хлорида натрия с ω=5% потребуется 228 г вещества. |
| 2.Определение массовой доли кристаллизационной воды | Обучающие задачи |
Рассчитать массовую долю кристаллизационной воды в молекуле медного купороса.
| Дано: | Решение: |
| V = 500 см3 Сm(Cu2+)= 0,2 мг/см3 m(CuSO4*5H2O) =? | 1.Рассчитать молярную массу (CuSO4*5H2O): М = 63,546 + 32,06 + 16*4 + 5*(2 + 16) = 249,61 г/моль |
| 2.Рассчитать массу воды в 1 моле кристаллогидрата: М (5H2O) = 5 * (2 + 16) = 90 г/моль | |
| 3.Рассчитать массовую долю кристаллизационной воды в молекуле кристаллогидрата: 249,61 г/моль (CuSO4*5H2O) –90 г/моль (воды) 100 % (CuSO4*5H2O) - x % (воды) х=36,06 % Ответ: Массовая доля кристаллизационной воды в молекуле CuSO4*5H2O составляет 36 %. |
При определении кристаллизационной воды в образце (CuSO4*5H2O) получены данные: масса пустого бюкса 8,5746 г, масса бюкса с веществом 9,3310 г, масса бюкса с веществом после высушивания 9,0610 г. Вычислить массовую долю кристаллизационной воды в образце.
| Дано: | Решение: | |
| m (бюкс с навеской) = 9,3310 г m (бюкса) = 8,5746 г m (б. с нав. после высуш.) = 9,0582 г ω(H2O)=? | 1.Рассчитать массу кристаллогидрата взятого на анализ:
m (навески) = m (бюкс с навеской) – m (бюкса)
m (навески) = 9,3310 г - 8,5746 г = 0,7564 г
2.Рассчитать массу кристаллизационной воды, выпарившейся при высушивании:
m (H2O) = m (бюкс с навеской) – m (б. с нав. после высуш.)
m (H2O) = 9,3310 г – 9,0582 г = 0,2728 г
3.Рассчитать массовую долю кристаллизационной воды:


| |
| Ответ: | Массовая доля кристаллизационной воды в образце составляет 36% | |
| 3. Молярная концентрация | Обучающие задачи |
1. Вычислить массу хлорида кальция необходимую для приготовления 250 мл раствора с молярной концентрацией C (CaCl2*6H2O) = 0.5 моль/л?
| Дано: | Решение: |
| V = 7,5г C(x) = 4,2г m (CaCl2*6H2O) =? | 1.Рассчитать молярную массу CaCl2*6H2O:
М= 40,08 + 35,453*2 + 6*(2 + 16)=218,986 г/моль
2.Рассчитываем навеску хлорида кальция:

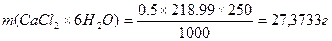 Ответ: Для приготовления 250 мл раствора CaCl2*6H2O с
С = 0,5 моль/л потребуется навеска равная 27,3733 г.
Ответ: Для приготовления 250 мл раствора CaCl2*6H2O с
С = 0,5 моль/л потребуется навеска равная 27,3733 г.
|
| 4. Молярная концентрация эквивалента. | Обучающие задачи |
1. Какая масса тетрабората натрия (Na2B4O7•10H2O) необходима для приготовления 100 мл раствора с молярной концентрацией эквивалента Сf (Na2B4O7•10H2O) = 0,1 моль/л?
| Дано: | Решение: |
| Vр-ра = 100 мл Сf = 0,1 моль/л m (Na2B4O7•10H2O) =? | 1.Рассчитать молярную массу Na2B4O7•10H2O:
М= (2•22,99+4•10,81+7•16)+10•18,02=381,42 г/моль
2. Рассчитать молярную массу эквивалента Na2B4O7•10H2O:
f =1/2
Мf = М • f
 3.Рассчитываем навеску тетрабората натрия:
3.Рассчитываем навеску тетрабората натрия:
 Ответ: Для приготовления 100 мл раствора Na2B4O7•10H2O с Сf = 0,1 моль/л потребуется навеска равная 1,9070 г.
Ответ: Для приготовления 100 мл раствора Na2B4O7•10H2O с Сf = 0,1 моль/л потребуется навеска равная 1,9070 г.
|
Задачи для самостоятельного решения






