Способы выражения концентраций растворов
Теоретическая часть
Концентрацией называют величину, измеряемуюколичеством растворенного вещества, содержащееся в определенной массе или объеме раствора или растворителя.
Массовая доля (ω) выражает отношение массы растворенного вещества (m1) к общей массе раствора (m):
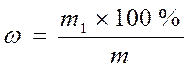
Массовая доля – количество граммов растворенного вещества в 100 г раствора.
Выражается в долях или процентах.
Молярная концентрация показывает, число молей растворённого вещества в одном литре раствора.
Обозначается C(x) и рассчитывается по формуле:
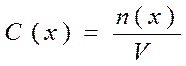 ; где
; где
- C(x) – молярная концентрация, (моль/л);
- n(x) – количество растворенного вещества, (моль);
- V – объем раствора, (л).
При приготовлении молярных растворов расчет твердого вещества, кристаллогидрата проводят по формуле:
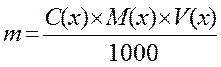 ; где
; где
- m – навеска, (г);
- C(x) – молярная концентрация раствора, (моль/л);
- M(x) – молярная масса вещества, (г/моль);
- V(x) – объем раствора, (мл);
- 1000 мл – объем раствора.
Если раствор готовят из концентрированного раствора, то объем его рассчитывают по формуле:
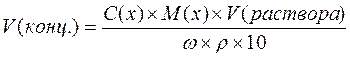 ; где
; где
- C(x) – молярная концентрация раствора, (моль/л);
- M(x) – молярная масса вещества, (г/моль);
- V(x) – объем раствора, (мл);
- ρ – плотность раствора, (г/мл);
- ω – массовая доля, (%);
- V(конц) – объем концентрированного раствора, (мл);
- 10 – пересчетный коэффициент.
Молярная концентрация эквивалента показывает, число моль эквивалентов растворённого вещества в одном литре раствора.

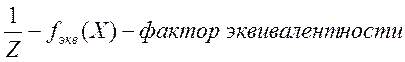
Эквивалент – это реальная или условная частица, которая может присоединить или вытеснить 1 протон водорода в кислотно-основных реакциях или быть эквивалентной 1 электрону в окислительно-восстановительных реакциях.
Фактор эквивалентности (fэкв.) – это число, показывающее, какая доля реальной частицы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции.
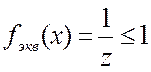
Молярная масса эквивалента вещества x – это масса одного моля эквивалента этого вещества. Она равна произведению фактора эквивалентности вещества в реакции на молярную массу вещества (x):

Молярная масса эквивалента кислоты равна её молярной массе, делённой на основность кислоты (если расчёт производят по формуле):
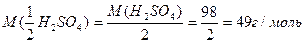
Фактор эквивалентности кислоты – величина обратная числу катионов водорода

*при расчёте по уравнению реакции учитывают стехиометрические коэффициенты реакции:
Пример: 2 NaOH + H2SO4 = Na2SO4 + 2 H2O
1 моль гидроксида натрия эквивалентен 0,5 моль серной кислоты. Следовательно, молярная масса эквивалента гидроксида натрия 40 г/моль, то молярная масса эквивалента серной кислоты для этой реакции:
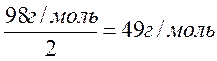
Для уравнения реакции: NaOH + H2SO4 = NaHSO4 + H2O
1 моль гидроксида натрия эквивалентен 1 молекуле серной кислоты, следовательно, молярная масса эквивалента серной кислоты для данной реакции равна 98 г/моль.
Фактор эквивалентности основания – величина обратная числу гидроксильных групп
Молярная масса эквивалента соли равна молярной массе соли, делённой на произведение степени окисления иона металла и числа его ионов в молекуле соли:

Фактор эквивалентности соли – величина обратная произведение степени окисления иона металла и числа его ионов в молекуле соли
Молярная масса эквивалента окислителя (восстановителя) равна молярной массе окислителя (восстановителя) делённой на число электронов, принятых или отданных одной молекулой данного вещества:
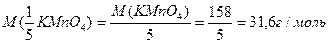
Фактор эквивалентности окислителя (восстановителя) – величина обратная числу электронов, принятых или отданных одной молекулой данного вещества:
KMnO4 – окислитель, присоединяет 5 электронов
MnO 4 - + 8 H + +5ẻ → Mn2+ + 4 H2O (окислитель)
Для приготовления растворов с молярной концентрацией эквивалента расчёт навески сухого вещества проводят по формуле:
 , где
, где
· Сf _ молярная концентрация эквивалента раствора (моль/л)
- Мf _ молярная масса эквивалента (г/моль)
- V раствора _ объём раствора (мл)
- m _ навеска вещества (г).
| 1.Приготовление растворов с известной массовой долей. | Обучающие задачи |
Вычислить массовую долю (%) NaNO3, полученного растворением 7,5г вещества в 42,5 г воды?
| Дано: | Решение: |
| m (NaNO3) = 7,5г m (H2O) = 4,2г | 1.Рассчитать m (раствора):
m (раствора) = m (NaNO3) + m (H2O)
m (раствора) = 7,5 г + 4,2 г = 11,7 г
2.Рассчитать массовую долю (%) NaNO3 в растворе:

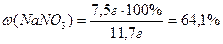
|
| ω (NaNO3) =? | |
| Ответ: | Массовая доля натрия нитрата составляет 64,1%. |




