| Параметр
| Обозначение,
единица
| Смысловое значение
|
| Осмотическое давление
| pосм, π, кПа
π=cRT, π= i cRT
| Избыточное гидростатическое давление, возникающее в результате осмоса и приводящее к выравниванию скоростей взаимного проникновения молекул растворителя через мембрану с избирательной проницаемостью
|
| Изотонический коэфициент
| i;
i=1 + α(ν – 1),
где ν — число ионов
на которое распадается
данный электролит;
α — степень
диссоциации
| Отношение общего числа частиц (молекул и ионов) растворенного вещества в растворе после диссоциации к исходному числу молекул вещества, учитывает межмолекулярные взаимодействия в реальных растворах
|
| Осмолярная концентрация
| c осм = i c(X), осмоль\л
| Суммарное молярное количество всех кинетически активных частиц, содержащихся в 1 л раствора, независимо от их формы, размера и природы
|
| Онкотическое давление
| π онк, кПа
| Осмотическое давление, создаваемое за счет наличия белков в биологических жидкостях организма
|
| Давление насыщенного пара
| p, кПа
| Давление пара, при котором при данной температуре в системе жидкость — пар наступает динамическое равновесие
vисп = vконд
|
| Относительное понижение давления насыщенного пара растворителя над идеальным, или бесконечно разбавленным, раствором нелетучего вещества
| 
| При постоянной температуре равно молярной доле растворенного вещества (первый закон Рауля)
|
| Температура кипения жидкости
| t кип
| При данной температуре давление насыщенного пар над жидкостью становиться равным внешнему давлению
|
| Температура замерзания жидкости (появление первых кристаллов растворителя)
| t зам
| При данной температуре давление насыщенного пара над жидкостью становиться равным давлению насыщенного пара над кристаллами этой жидкости
|
| Повышение температуры кипения или понижение температуры замерзания идеальных, или бесконечно разбавленных, растворов нелетучих веществ
| Δt кип = K эб с m (X)
Δt зам = K кр с m (X)
Δt кип = i K эб с m (X)
Δt зам = iKкр с m (X)
(i вводиться в формулу для растворов электролитов)
| Прямо пропорционально моляльной концентрации вещества в растворе (второй закон Рауля)
|
| Эбулиоскопическая и криоскопическая константы
| K эб, Kкр
| Численно равны повышению температуры кипения или, соответственно, понижению температуры замерзания одномоляльного идеального раствора (1 моль вещества в 1000г растворителя) нелетучего вещества по сравнению с чистым растворителем
|
| Константа диссоциации (ионизации)
|
Ка= [H+][ A-] (1)
[HA]
Кb= [BH+][ OH-] (2)
[B]
| Константа равновесия процесса диссоциации. Для кислоты HA, ионизация которой в воде дает H3O+ и A-, константа Кавыражается уравнением (1).
Для основания B, при ионизации которого образуются анион OH-- и протонированное основание BH+, константа Кbвыражается уравнением (2)
|
| Степень диссоциации
|
 где с i — концентрация молекул распавшихся на ионы;
с o— общая концентрация растворенных молекул
где с i — концентрация молекул распавшихся на ионы;
с o— общая концентрация растворенных молекул
 где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит
где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит
| Отношение числа продиссоциированных молекул к общему числу молекул электролита, введенных в раствор. Величина безразмерная. Степень диссоциации возрастает при разбавлении раствора, при повешении температуры раствора
|
| Закон разведения Оствальда
|
  при
при 
| С уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается
|
| Активность иона
|
a(X i), моль/л
a(X i)=γ(X i)c i (X i)
| Эффективная концентрация иона(Xi), соответственно которой он учавствует во взаимодействиях, протекающих в растворах сильных электролитов
|
| Коэффициент активности иона
|
γ(X i)
Уравнение Дебая—Хюккеля (при 25oC) для водных растворов
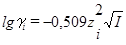 (первое приближение,
I<0,01 моль/л)
(первое приближение,
I<0,01 моль/л)
 (второе приближение,
I<0,1 моль/л)
(второе приближение,
I<0,1 моль/л)
| Показывает, во сколько раз активность иона отличается от его истинной концентрации в растворе сильного электролита
|
| Ионная сила раствора
| 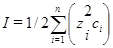 моль/л моль/л
| Характеризует интенсивность электростатического поля всех ионов в растворе.
|
| Ионное произведение воды
| K w= [H+][OH—]=const
[H+][ OH—]=1*10-14
(при Т=298 К)
| Величина постоянная при данной температуре для воды и любых водных растворов, равная произведению концентрации ионов водорода и гидроксид ионов
|
| Водородный показатель
| pH= --lg [H+]
pH= --lg a[H+]
pH= --lg (γc(H+))
| Количественная характеристика щелочности среды, равная отрицательному десятичному логарифму концентрации свободных ионов Н в растворе.
|
| Гидроксильный показатель рОН
| pOH= --lg [ OH—]
pOH + pH=14
(при 25о С)
| Количественная характеристика щелочности среды, равная отрицательному десятичному логарифму концентрации свободных ионов ОН в растворе.
|
| Активная кислотность
| pH
| Концентрация свободных ионов водорода, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение рН раствора
|
| Активная кислотность в растворах сильных кислот.
| [H+]акт =γ(H+)с(1/ z сильной к-ты)
где γ(H+)--коэффициент активности катиона водорода
| Зависит от концентрации кислоты и межионного взаимодействия
|
| Активная кислотность в растворах слабых кислот.
| [H+]акт =
 pH=1/2pK—1/2lg c(1/zслабой к-ты)
pH=1/2pK—1/2lg c(1/zслабой к-ты)
| Слабые кислоты присутствуют в растворах в ионизированной и молекулярной формах. Активная кислота зависит от природы и концентрации слабого электролита
|
| Потенциальная(резервная) кислотность
| [H+]пот = 
| Равна суммарной молярной концентрации эквивалентов слабых кислот.
|
| Общая кислотность
| [H+]общ =[H+]акт + [H+]пот
| Равна сумме молярных концентраций эквивалентов сильных и слабых кислот, содержащихся в растворе. Это общая аналитическая концентрация кислоты, которая устанавливается титрованием
|
| Константа гидролиза
| Гидролиз по аниону:
Кг= [HA] [ OH-] =
[ A-]
= Kw
Ка(HA)
Гидролиз по катиону:
Кг= Kw
Кb(B)
| Характеризует состояние равновесия при гидролизе солей
|
| Степень гидролиза
|

| Отношение числа частиц, подвергшихся гидролизу к их числу до начала гидролиза
|
| рН раствора соли, гидролизующейся по катиону
| pH=7 — 1/2pКb —1/2 lg cсоли
| При гидролизе по катиону в растворе возрастает концентрация ионов H
и рH водного раствора таких солей всегда меньше 7
|
| рН раствора соли, гидролизующейся по аниону
| pH=7 + 1/2pКb+ 1/2 lg cсоли
| При гидролизе по аниону в растворе возрастает концентрация ионов OH
и рH водного раствора таких солей всегда больше 7
|
| рН кислотной буферной системы
| 
| Кислотный буферный раствор содержит слабую кислоту и соль этой
кислоты(акцептор протона)
|
| рН основной буферной системы
| 
| Основный буферный раствор содержит слабое основание (акцептор протона) и соль этого основания (донор протона)
|
| Буферная емкость по кислоте
| 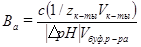
| Число моль-эквивалентов сильной кислоты, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину pH на единицу
|
| Буферная емкость по основанию
| 
| Число моль-эквивалентов щелочи, которое нужно добавить к одному литру буферного раствора, чтобы изменить величину pH на единицу
|
| Константа растворимости
|  Для электролита KtnAnm
Ks=[Ktm+] [Ann]m
ΔGo=-RT ln Ks
Для электролита KtnAnm
Ks=[Ktm+] [Ann]m
ΔGo=-RT ln Ks
| Произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при данных условиях
|
| Растворимость малорастворимого электролита
| 
| Молярность насыщенного раствора малорастворимого электролита при данных условиях
|
| Константа нестойкости
| 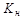
 где Me---комплексообразователь(атом, ион), L---лиганд
где Me---комплексообразователь(атом, ион), L---лиганд
| Константа равновесия, описывающая диссоциацию комплексного иона, используется для количественной характеристики устойчивости внутренней сферы комплексного соединения
|
| Координационное число
| k.ч.
| Число свободных атомных орбиталей, предоставляемых комплексообразователем, т. е. Число связей комплексообразователя и лиганда
|
| Дентатность лиганда
|
| Число электронных пар,
предоставляемых лигандом, для образования донорно-акцепторной связи с комплексообразователем
|

 где с i — концентрация молекул распавшихся на ионы;
с o— общая концентрация растворенных молекул
где с i — концентрация молекул распавшихся на ионы;
с o— общая концентрация растворенных молекул
 где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит
где i — изотонический коэффициент
v— число ионов на которое распадается данный электролит

 при
при 
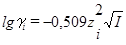 (первое приближение,
I<0,01 моль/л)
(первое приближение,
I<0,01 моль/л)
 (второе приближение,
I<0,1 моль/л)
(второе приближение,
I<0,1 моль/л)
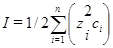 моль/л
моль/л
 pH=1/2pK—1/2lg c(1/zслабой к-ты)
pH=1/2pK—1/2lg c(1/zслабой к-ты)




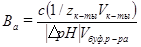

 Для электролита KtnAnm
Ks=[Ktm+] [Ann]m
ΔGo=-RT ln Ks
Для электролита KtnAnm
Ks=[Ktm+] [Ann]m
ΔGo=-RT ln Ks

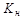
 где Me---комплексообразователь(атом, ион), L---лиганд
где Me---комплексообразователь(атом, ион), L---лиганд






