Равновесные и квазиравновесные тепловые процессы
Система молекул с постоянным количеством вещества n в объеме V находится в «состоянии теплового равновесия», если во всех макроскопически малых частях ее объема достаточно длительное время и давление Р, и температура Т одинаковы, т.е. являются параметрами состояния системы в целом. Состояние теплового равновесия может поддерживаться только в такой системе, через "границы" которой исключается перенос вещества и энергии. Такая система называется «термодинамически изолированной» [1].
В неизолированных системах тепловое равновесие отсутствует и наблюдается тот или иной тепловой процесс. Будучи изолированной, такая система за некоторое время спонтанно, благодаря тепловому движению молекул, придет в состояние равновесия [1]. Переход системы из неравновесного в равновесное состояние называют «процессом релаксации» и характеризуют «временем релаксации». Так, неравномерность давления в изолированной системе на расстоянии 10 см исчезает весьма быстро - за 10-4 – 10-5с, так как выравнивание давления происходит со скоростью звука (при 0° С в воздухе скорость звука равна 330 м/с). Выравнивание температуры определяется теплопроводностью системы и протекает медленно. Время температурной релаксации идеальных газов имеет порядок t = 103 – 104с на участке 10 см.
Все тепловые процессы являются, строго говоря, непрерывной последовательностью неравновесных состояний системы. Но если они протекают медленно по отношению ко времени релаксации (t >> t), то допустимо считать их непрерывной последовательностью равновесных состояний, так как, изменяясь постепенно, параметры состояния вследствие успевающей завершиться релаксации остаются практически одинаковыми во всех частях объема системы. Такие процессы называют равновесными. Они могут быть графически изображены на «диаграмме состояний». Поскольку определяющим для системы является время температурной релаксации, то всякий равновесный процесс принципиально процесс очень медленный (t ®¥). Такими, например, являются протекающие в условиях изменения температуры изобарический (Р = const) и изохорический (V = const ) процессы, если они осуществляются как равновесные.
Изотермический процесс протекает при постоянной температуре системы и принципиально является равновесным. На первый взгляд при таком процессе нет необходимости учитывать время температурной релаксации. Однако и этот процесс должен проводиться очень медленно, чтобы осуществляемый теплообмен системы с внешней средой не приводил к изменению ее температуры. Как угодно малое приращение внутренней энергии dU системы, возникающее за счет подведения малого количества теплоты d Q ® dU, с учетом времени температурной релаксации полностью должно успеть перейти в работу системы dU ®d A. Только в этом случае можно считать, что изотермический процесс выполняется: d Q ® d A, dU ® 0, dT ® 0 и T = const. Изотермический процесс - медленный принципиально. В идеале определяют его как бесконечно медленный. Реально тепловые процессы, включая изобарический и изохорический, проводят более или менее быстро, не обеспечивая полной температурой релаксации. В ряде случаев их можно рассматривать как равновесные только приближенно. Процессы, которые в определенных условиях с некоторым приближением можно рассматривать как равновесные, называют квазиравновесными. Такие процессы легче реализуются в системах с малым объемом, когда уменьшается время температурной релаксации, а также при сравнительно небольшом диапазоне изменения параметров состояния системы за время процесса.
Квазиравновесный адиабатный процесс
Адиабатный процесс проводится в системе с постоянным количеством вещества n при отсутствии теплообмена с внешней средой (dQ = 0). Для этого система должна быть термодинамически изолирована. При адиабатном процессе температура системы изменяется. Поэтому равновесный адиабатный процесс должен протекать настолько медленно, чтобы его длительность была много больше времени температурной релаксации системы, т.е. t >>  . Отсюда следует часто трудно выполнимое, жесткое требование к качеству тепловой изоляции системы.
. Отсюда следует часто трудно выполнимое, жесткое требование к качеству тепловой изоляции системы.
Чтобы избежать этого затруднения, на практике адиабатный процесс проводят как процесс квазиравновесный: объем системы изменяют настолько быстро, чтобы за время длительности процесса можно было пренебречь теплообменом системы с внешней средой, т.е. dQ ® 0. Ясно, что температурная релаксация системы за такой интервал времени не завершается, и неравномерность температуры в разных частях объема не позволяет считать такой адиабатный процесс равновесным. Однако, выбирая объем системы достаточно малым и, проводя процесс при незначительном изменении давления, объема и температуры системы, можно считать его квазиравновесным.
Адиабатный процесс в системе идеального газа с постоянным числом одинаковых молекул аналитически записывается либо уравнением (6.1), либо уравнением (6.2)
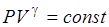 (6.1)
(6.1)
 (6.2)
(6.2)
где показатель адиабаты g определяется только «числом степеней свободы» i [1] молекулы газа и равен отношению теплоемкостей газа при постоянном давлении С P (изобарический процесс) и при постоянном объеме С V (изохорический процесс)
 (6.3)
(6.3)
 (6.4)
(6.4)
Рассмотрим относительное изменение параметров состояния системы, удовлетворяющее условию проведения квазиравновесного адиабатного процесса.
Задавшись приращениями 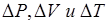 давления, объема и температуры, из формул (6.1) и (6.2) получим соответственно уравнения
давления, объема и температуры, из формул (6.1) и (6.2) получим соответственно уравнения


из которых следует, что относительные изменения объема и температуры зависят от относительного изменения давления следующим образом:

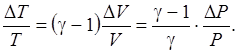
Для одно-, двух- и трехатомных молекул число степеней свободы соответственно равно i = 3, i = 5, i = 6. Пусть i = 5 и g = 1,4.
Условие квазиравновесия требует, чтобы приращения параметров состояния системы были малы. Особенно это относится к температуре. Пусть  = 0,01, тогда
= 0,01, тогда  V / V = 0,007 и
V / V = 0,007 и  Т / Т = 0,003. Проведем количественную оценку приращения параметров.
Т / Т = 0,003. Проведем количественную оценку приращения параметров.
В качестве наименьшего давления в системе примем атмосферное давление Р = 1,01×105 Па. Тогда приращение давления  = 1,01×103Па = 103мм вод.ст. Оно может быть измерено непосредственно U -образным жидкостным манометром, один вход которого соединен c системой, а второй, открытый - непосредственно с внешней средой.
= 1,01×103Па = 103мм вод.ст. Оно может быть измерено непосредственно U -образным жидкостным манометром, один вход которого соединен c системой, а второй, открытый - непосредственно с внешней средой.
Если в исходном состоянии система имеет комнатную температуру, например, Т = 300К, то по окончании адиабатного процесса расширения температура уменьшится на  Т = 1К (или на 1° С). Столь незначительное уменьшение температуры позволяет считать ее приблизительно постоянной. Следовательно, адиабатный быстропротекающий процесс в этих условиях вполне можно рассматривать как квазиравновесный.
Т = 1К (или на 1° С). Столь незначительное уменьшение температуры позволяет считать ее приблизительно постоянной. Следовательно, адиабатный быстропротекающий процесс в этих условиях вполне можно рассматривать как квазиравновесный.






