Из молекулярно - кинетической теории известно, что внутренняя энергия одного моля равна

где i - число степеней свободы данного газа. Число степеней свободы определяет число независимых координат, полностью описывающих положение молекулы газа в пространстве. Для идеального одноатомного газа необходимы три координаты, описывающие поступательное движение такой молекулы в пространстве. Следовательно ему приписывают три степени свободы.
Молекула двухатомного идеального газа рассматривается как совокупность двух материальных точек-атомов, жестко связанных недеформируемой связью. Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Таким образом, двухатомный идеальный газ обладает пятью степенями свободы. Трехатомные и многоатомные нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
 подставляя это выражение в (4)
подставляя это выражение в (4)
получим
 (10)
(10)
С учетом (10) выражение (7) примет вид
 (11)
(11)
С учетом (10) и (11) получим теоретическое значение коэффициента Пуассона
 (12)
(12)
II. Теория метода и описание установки
Величину γ можно определить с помощью установки (рис.1),
 состоящей из стеклянного баллона 1,герметично зарытого пробкой, через пробку в баллон пропущена трубка 2, на верхнем конце которой имеется кран 3, соединяющий полость баллона с атмосферой. Через трубку 4, пропущенную через пробку в баллон, полость баллона соединяется с V-образным манометром 5. Через трубку 6 полость баллона соединяется с насосом 7.
состоящей из стеклянного баллона 1,герметично зарытого пробкой, через пробку в баллон пропущена трубка 2, на верхнем конце которой имеется кран 3, соединяющий полость баллона с атмосферой. Через трубку 4, пропущенную через пробку в баллон, полость баллона соединяется с V-образным манометром 5. Через трубку 6 полость баллона соединяется с насосом 7.
Рис.1
В баллон при закрытом кране накачивается воздух. Давление воздуха в баллоне повысится и станет равным
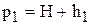
где h1 - избыток давления воздуха в баллоне над атмосферным давлением Н. Величина h1 измеряется манометром. Открывают на короткое время кран 3, чтобы давление в баллоне сравнялось с атмосферным (р2 = Н), после чего закрывают кран.
Пусть масса воздуха поcле накачивания насосом в сосуде объемом V равна m. При открывании крана часть воздуха выходит. Обозначим массу вышедшего воздуха через Δm, тогда масса оставшегося воздуха

Масса воздуха m1, которая заключается в объеме V, занимала перед открытием крана меньший объем Vi. Так как процесс кратковременный и заметного теплообмена между газом и стенками баллона нет, то его можно считать адиабатическим. Согласно уравнению Пуассона (для массы газа равной m1) получим
 (13)
(13)
Вследствие адиабатического расширения температура газа понизилась, а затем в результате теплообмена, температура его через небольшой промежуток времени станет равной комнатной. При этом давление газа поднимается до величины

Начальное и конечное состояние газа наблюдается при одинаковой температуре. Поэтому на основании закона Бойля-Мариотта получим
 (14)
(14)
Решая уравнения (13) и (14) относительно у, получим
 (15)
(15)
Разложим lg p1 или lg p3 в ряд Тейлора, ограничившись в этом случае двумя первыми членами:


Подставляя эти значения в формулу (15), получим окончательно
 . (16)
. (16)
III. Порядок выполнения работы и обработки
результатов измерений
1. Кран ставят так, чтобы полость насоса соединялась с баллоном.
2. Действуя насосом осторожно, нагнетают воздух в сосуд до тех пор, пока разность уровней воды в манометре достигнет 200-250 мм.
3. При накачивании воздух, сжимаемый под поршнем насоса нагревается, следовательно, необходимо выждать 2-3 мин. пока, благодаря теплообмену температура в баллоне не станет равной комнатной
4. После этого производят первый отсчет разности уровней в манометре h1; (в мм водяного столба).
5. Открывают кран, и в тот момент, когда уровни жидкости в обоих коленах манометра сравняются, быстро закрывают кран.
6. Выждав 2-3 мин., пока газ, охлажденный при адиабатическом расширении, нагреется до комнатной температуры, производят второй отсчет разности уровней в манометре h2.
7. Опыт следует повторить не менее пяти раз, изменяя в каждом случае ве личину h1.
8. Для каждой пары значений h1 и h2 по формуле (16) вычисляют величину γ коэффициента Пуассона.
9. Найти среднее арифметическое значение результатов измерений γ.
10. Вычислить теоретическое значение γтеор. по формуле (12), считать i==5. т.к. воздух более чем на 99% состоит из двухатомных молекул.
11. Найти относительную погрешность измерений коэффициента Пуассона у по формуле

12. Вычислить абсолютную погрешность  .
.
13. Результаты измерений и вычислений записать в таблицу 1.
Таблицу 1
| № опыта | h1, мм | h2, мм | γ | 
| γ теор. | 
| Ε,% |
14. Записать окончательный результат в виде

Контрольные вопросы
1. Уравнение состояния идеального газа.
2. Первое начало термодинамики, его применение к основным изопроцессам идеального газа.
3. Удельная и молярная теплоемкости, их связь между собой.
4. Уравнение Майера.
5. Коэффициент Пуассона, как он выражается через теплоемкости Сp и Сv, а также через число степеней свободы.
Литература
1. Трофимова, Т.И.. Курс физики [Текст]: учеб.пособ./Т.И.Трофимова.- М: Академия, 2004.- 560с.
2. Савельев, И.В. Курс общей физики [Текст]: в 5-ти кн.: учеб.пособ. / И.В. Савельев.- М.: Астрель: АСМ, 2005. кн.3:Термодинамика и молекулярная физика – 208 с.




