Говоря об агрегатных состояниях вещества, имеют в виду такие характеристики, как наличие или отсутствие собственной формы и собственного объема тела, а также способность к их сохранению. Известны три агрегатных состояния вещества: твердое, жидкое и газообразное. Тело в твердом агрегатном состоянии имеет собственный объем и форму и сопротивляется их изменению при внешнем воздействии
Тело в жидком агрегатном состоянии имеет собственный объем, но почти не сопротивляется изменению формы. Сила тяжести легко изменяет собственную форму жидкого тела, поэтому наблюдать собственную форму жидкого тела удается лишь в особых условиях, например, в условиях невесомости, а также у маленьких капель, лежащих на несмачиваемой ими поверхности. В реальных условиях жидкость принимает форму сосуда, в котором находится.
Тело в газообразном агрегатном состояние не имеет ни собственной формы, ни собственного объема: газы занимают весь предоставленный им объем и принимают форму заключающего их сосуда.
Различие в агрегатных состояниях связаны с соотношением абсолютных значений энергии межмолекулярного взаимодействия E мв и энергии теплового движения E т.
Если E мв намного больше E т, то тело является твердым. Если E т > E мв - тело является газообразным. Промежуточному соотношению энергий соответствует жидкое состояние.
Фазы или фазовые состояния в термодинамике – термодинами-чески равновесные (т.е. с постоянными во всех точках системы термодинамическими характеристиками) состояния вещества, различающиеся по физическим свойствам. Газовое, жидкое и кристаллическоесостояния (фазы) различаются характером движения структурных единиц (атомов, молекул) и наличием или отсутствием упорядоченной структуры.
Кристаллическая фаза характеризуется максимальной степенью упорядоченности в расположении частиц (атомов, ионов или молекул) в веществе. В кристаллической фазе реализуется как ближний порядок - регулярное упорядоченное расположение частиц на расстояниях, сравнимых с размерами частиц, так и дальний порядок - сохранение характера упорядочения частиц на расстояниях, значительно превышающих размеры частиц. Такое упорядоченное расположение частиц в кристаллической фазе соответствует минимуму энергии межмолекулярного взаимодействия.
В зависимости от условий кристаллизации одно и то же вещество может существовать в различных кристаллических модификациях, различающихся типом кристаллической структуры. Это явление называется полиморфизмом.
Жидкая фаза характеризуется меньшей по сравнению с кристаллической фазой степенью упорядоченности частиц в веществе. В жидкой фазе сохраняется лишь ближний порядок; дальний порядок разрушается.
Твердые тела в жидком фазовом состоянии называются аморфными. В газовой фазе нет ни ближнего, ни дальнего порядка.
Всегда ли соответствует агрегатное состояние фазовому? Нет, не всегда. Например, стекла являются твердыми по своему агрегатному состоянию и жидкими по своему фазовому состоянию. С другой стороны, жидкие кристаллы, получившие в последнее время широкое применение в технике, являются жидкостями по своему агрегатному состоянию и кристаллами по фазовому состоянию.
Переход вещества из одной фазы в другую называется фазовым переходом. Различают фазовые переходы I и II рода.
Фазовые переходы первого рода. К фазовым переходам I рода относятся плавление, испарение, возгонка и обратные им процессы - кристаллизация, конденсация, сублимация, а также - переход кристаллов из одной кристаллической модификации в другую. Температура перехода T к является строго определенной, хорошо воспроизводимой величиной, характерной для данного вещества при данном давлении.
|
| Рис. 1 |
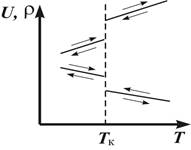
При фазовом переходе I рода меняются и степень упорядоченности в расположении частиц в веществе (например, при плавлении кристалла, для которого характерна максимальная упорядоченность и существование ближнего и дальнего порядка, получаем жидкость, где осуществляется только ближний порядок), и средние расстояния между частицами. Поэтому при фазовом переходе I рода скачкообразно изменяется и плотность, и внутренняя энергия вещества (рис. 1). Стрелки на рис. 1 указывают на обратимость процесса. Это одна особенность фазовых переходов первого рода.
Другой характерной особенностью фазовых переходов I рода является то, что они всегда сопровождаются поглощением или выделением тепла, так называемой теплоты перехода.
Теплота фазового перехода - это количество теплоты, которое необходимо сообщить веществу (или отвести от него) при равновесном изобарно-изотермическом (P = const, T = const) - переходе вещества из одной фазы в другую.
Процессы плавления, испарения, возгонки реализуются с поглощением тепла, которое идет на преодоление сил межмолекулярного взаимодействия, на разрушение упорядоченной структуры расположения частиц в веществе. Так как при этом не происходит изменения температуры тела, то эта теплота называется скрытой. При обратных процессах происходит выделение скрытой теплоты перехода.
|
| Рис. 2 |
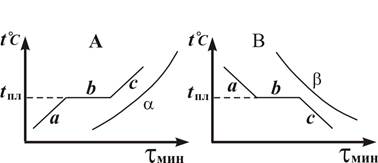
На рис. 2 показаны в качестве примера кривые изменения температуры веществ: кристаллизующегося (A,B) и аморфного (α, β) (при их нагревании и охлаждении). Участок b на кривых abc соответствует фазовому переходу:A - плавлению, B - кристаллизации. Температура плавления равна температуре кристаллизации. Зависимость температуры фазового перехода от давления определяется уравнением Клапейрона – Клаузиуса
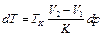 . .
| (1) |
Здесь dT - изменение температуры фазового перехода TK при изменении давления p на величину dp, V 2 и V 1 - объем вещества в двух разных фазах, K - теплота фазового перехода.
Из уравнения (I) следует, что при таких фазовых переходах, как плавление, кристаллизация, когда изменение объема невелико (разница в плотностях кристаллической и жидкой фазы одного и того же вещества мала), температура фазового перехода практически не зависит от давления. Так например, чтобы изменить ТK плавления льда на 1°С, надо изменить давление на ~ 1,3·107 Па.
Напротив, если фазовый переход сопровождается значительным изменением объема (испарение, возгонка), температура фазового перехода ТK сильно зависит от давления (всем известна зависимость температуры кипения воды от высоты над уровнем моря), исследуя зависимость ТK от давления, можно определить теплоту перехода K.
Теплота фазового перехода идет как на изменение внутренней энергии Δ U (работа по преодолению сил межмолекулярного притяжения), так и на работу по расширению тела p Δ V
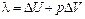 . .
| (2) |
При процессах плавления второй член в правой части уравнения (2) пренебрежимо мал по сравнению с первым, и вся теплота перевода идет на изменение внутренней энергии. При процессах испарения (или возгонки) вторым членом в уравнении (2) пренебрегать уже нельзя.
Фазовые переходы второго рода. При них внутренняя энергия и плотность изменяется непрерывно, а не скачком. Однако скачкообразно изменяются другие свойства вещества: теплоемкость, сжимаемость, коэффициент теплового расширения. Фазовые переходы второго рода происходят без поглощения или выделения теплоты.
К фазовым переходам второго рода относятся переход парамагнетик - ферромагнетик, сопровождаемый появлением макроскопического магнитного момента, переход диэлектрик - сегнетоэлектрик с появлением самопроизвольной спонтанной поляризации и др.
При фазовых переходах I рода происходит скачкообразное изменение первых производных термодинамического потенциала Гиббса системы, при фазовых переходах II рода скачкообразно изменяются вторые производные термодинамического потенциала Гиббса.
Термодинамический потенциал Гиббса g - есть функция, описывающая состояния системы, равная g = U + pV – TS, где U, р, V, Т, S - соответственно внутренняя энергия, давление, объем, температура и энтропия системы. Отсюда и возникло название этих явлений - фазовые переходы I и II рода
Испарение жидкостей. Испарение жидкостей - это фазовый переход I рода из жидкого состояния в газообразное.
Испарение происходит при любой температуре, но для каждой жидкости с ростом температуры скорость испарения увеличивается, так как растет число быстрых молекул, способных оторваться от поверхности жидкости, преодолев силы молекулярного притяжения. Так как при этом средняя энергия молекул, остающихся в жидкости, убывает, то жидкость охлаждается. Для поддержания неизменной температуры испаряющейся жидкости к ней надо подводить тепло.
Количество теплоты, необходимое для превращения единицы массы жидкости в пар при постоянной температуре, называется удельной теплотой испарения λ.
Величина λ уменьшается с ростом температуры жидкости, так как при этом возрастает кинетическая энергия молекул. Если с помощью внешнего источника тепла поддерживать постоянной температуру жидкости в закрытом сосуде, то наступит момент, когда число молекул, покидающих жидкость, становится равным числу молекул, возвращающихся в жидкость за то же время. Это состояние динамического равновесия. Плотность пара при этом постоянна, пар называется насыщенным, давление пара при этом называется упругостью насыщенного пара. При нагревании жидкости до такой температуры, при которой упругость её насыщенных паров становится равной внешнему давлению, испарение жидкости происходит не только с поверхности жидкости, но и в её толще, где начинают образовываться пузырьки пара. Такое бурное испарение называется кипением. Таким образом, температура кипения зависит от того внешнего давления, под которым находится жидкость. Эта зависимость определяется уравнением (1).
Энтропия.
Из термодинамики следует, что существует функция состояния системы, называемая энтропией S, и определяемая выражением:
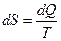 , где dQ – элементарное количество теплоты, получаемое системой при абсолютной температуре Т. При переходе системы из одного состояния в другое можно рассчитать изменение ее энтропии по формуле
, где dQ – элементарное количество теплоты, получаемое системой при абсолютной температуре Т. При переходе системы из одного состояния в другое можно рассчитать изменение ее энтропии по формуле
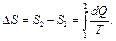
Согласно одной из формулировок второго начала термодинамики в адиабатически изолированной системе всегда Δ S ≥ 0, причем в обратимых процессах Δ S =0, а в необратимых Δ S > 0.
Понятие энтропии тесно связано с термодинамической вероятностью системы. термодинамической вероятностью макроскопического состояния называется число возможных микроскопических состояний, реализующих данное макроскопическое. Больцман установил, что:
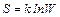 ,
,
где W - термодинамическая вероятность, k – постоянная Больцмана. Тогда изменение энтропии
Δ S = S 2 – S 1 = k ln W2 – k ln W1 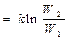 , ,
| (3) |
где W 1 и W 2 – термодинамические вероятности 1 и 2 состояний соответственно. Так как 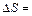
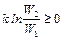 ,
,
следовательно W 2 ≥ W 1, поэтому второе начало термодинамики можно сформулировать следующим образом: все процессы в адиабатически изолированных системах протекают таким образом, что вероятность конечного состояния становится больше, чем начального или остается без изменения.
Поскольку в процессе фазового перехода температура не меняется, изменение энтропии системы при переходе из одной фазы в другую определяется выражением:
Δ S = S 2 – S 1 = 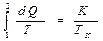 , ,
|
где К - теплота фазового перехода, а ТК - абсолютная температура фазового перехода.
Лабораторная работа 12






