Синтез гема
Гем синтезируется во всех тканях, но с наибольшей скоростью в костном мозге и. В костном мозге гем необходим для синтеза гемоглобина в ретикулоцитах, в гепатоцитах - для образования цитохрома Р450.
Первая реакция синтеза гема - образование 5-аминолевулиновой кислоты из глицина и сук-цинил-КоА идёт в матриксе митохондрий, где в ЦТК образуется один из субстратов этой реакции - сукцинил-КоА. Эту реакцию катализирует пиридоксальзависимый фермент аминолевулинатсинтаза.
Из митохондрий 5-аминолевулиновая кислота поступает в цитоплазму. В цитоплазме проходят промежуточные этапы синтеза гема: соединение 2 молекул 5-аминолевулиновой кислоты молекулу порфобилиногена, дезаминирование порфобилиногена с образованием гидроксиметилбилана, ферментативное превращение гидроксиметилбилана в молекулу уропор-фобилиногена III, декарбоксилирование последнего с образованием копропорфириногена III. Из цитоплазмы копропорфириноген III опять поступает в митохондрии, где проходять заключительные реакции синтеза гема. В результате двух последовательных окислительных реакций копропорфириноген III превращается в протопорфириноген IX, а протопорфириноген IX - в Протопорфирин IX. Фермент феррохела-таза, присоединяя к протопорфирину IX двухвалентное
железо, превращает его в гем. Источником железа для синтеза гема служит депонирующий железо белок ферритин. Синтезированный гем, соединяясь с α и β-полипепептидными цепями глобина, образует гемоглобин. Гем регулирует синтез глобина: при снижении скорости синтеза гема синтез глобина в ретикулоцитах тормозится.
4. Вторинні месенджери та їх роль в механізмах гормонального впливу на клітини-мішені
Сигнал на подальше включення каскаду біохімічних реакцій передається вторинними посередниками, або месенджерами — біомолекулами, що передають інформацію від гормону (первинного месенджеру) на ефекторні системи клітини. До вторинних месенджерів належать: циклічні нуклеотиди — циклічний аденозинмонофосфат (3',5'-АМФ; цАМФ) і циклічний гуанозинмонофосфат (3',5'-ГМФ, цГМФ), фосфоінозитиди та іони Са2+. Зростання внутрішньоклітинної (цитозольної) концентрації зазначених вторинних посередників здійснюється шляхом:
(1) активації аденілатциклази, що утворює циклічний АМФ;
(2) активації гуанілатциклази, що утворює циклічний ГМФ;
(3) активації фосфоліпази С, що призводить до включення фосфоінозитидного
каскаду — механізму мобілізації внутрішньоклітинного Са2+;
(4) надходження Са2+ з екстрацелюлярного простору за рахунок відкриття
кальцієвих каналів на плазматичній мембрані (механізм, більш притаманний
іонотропним рецепторам).
ефекторними механізмами, які реалізують трансформацію гормонального (регуляторного сигналу) через систему вторинних посередників у послідовність специфічних біохімічних реакцій клітини, є:
(1) цАМФ-залежне фосфорилювання ферментних білків (здійснюється через
цАМФ-залежні протеїнкінази);
(2) цГМФ-залежне фосфорилювання ферментних білків (здійснюється через
цГМФ-залежні протеїнкінази);
(3) Са2+/кальмодулінзалежне фосфорилювання ферментних білків (здійснюється
Са/кальмодулін-залежними протеїнкіназами);
(4) Са2+/фосфоліпідзалежне фосфорилювання ферментних білків (здійснюється
Cа/фосфоліпідзалежними протеїнкіназами);
(5) фосфорилювання ферментних білків через тирозинзалежні кінази;
5. нормальні і патологічні складові сечі
Загальний добовий об'єм сечі у здорової людини дорівнює в середньому 1,2-1,5 л. В умовах патології нирок та інших анатомо-функціональних систем організму ця кількість може суттєво
змінюватися в бік зменшення (олігурія, анурія) або різкого зростання об'єму добової
сечі {поліурія). Найбільш виражена поліурія спостерігається при нецукровому
діабеті - захворюванні, спричиненому порушенням продукції антидіуретичного гормону
(вазопресину) задньої частки гіпофіза. Суттєві патологічні зміни питомої ваги і осмоляр-
ності сечі спостерігаються при порушеннях фільтраційної та реабсорбційної функцій
нирок, що може супроводжуватися збільшенням або зменшенням виділення води та
мінеральних солей - гіперстенурія, гіпостенурія. коливання рН від 4,6 до 8,0 Найчастіше зсуви у рН сечі в кислий бік спостерігаються за умов некомпенсованого цукрового діабету, який
супроводжується надлишковим утворенням та виведенням із сечею кетонових тіл (ке-
тонурія). Біохімічний склад:
1) кінцеві нелеткі продукти нормального метаболізму
сечовина (20-35 г у добовій сечі), а також сечова кислота
(0,6-0,7 г/добу), креатинін, індикан, солі амонію. До цієї ж групи речовин, що екскре-
туються нирками, належать продукти катаболізму гормонів та вітамінів;
2) продукти біотрансформації чужорідних хімічних
Неорганічними компонентами сечі є катіони Na+, K+, Ca2+, Mg2+, NH4+, аніони СІ",
позитивні реакції на наявність у сечі людини білків (протеїнурія),
глюкози (глюкозурія), жовчних пігментів та продуктів їх перетворення (білірубіну,
уробіліну та ін.), жовчних кислот (холурія), кетонових тіл (кетонурія), гемоглобіну
(гемоглобінурія) спостерігається за умов виражених патологічних процесів.
6.катаболізм пуринових нуклеотидів
 Розщеплення пуринових нуклеотидів (АМФ та ГМФ) включає реакції:
Розщеплення пуринових нуклеотидів (АМФ та ГМФ) включає реакції:
- відщеплення фосфатної групи з утворенням нуклеозидів аденозину та гуанозину (фермент - 5'нуклеотидаза);
- дезамінування (на рівні аденозину - фермент аденозиндезаміназа або на рівні гуаніну - фермент гуаніндезаміназа);
- відщеплення від нуклеозидів пентозного залишку D-рибози (фермент нуклеозидаза) або пентозофосфату в цілому (ферменти - фосфорилази);
- подальший катаболізм гіпоксантину (що утворився з АМФ) або ксантину (що утворився з ГМФ) з утворенням кінцевого продукту сечової кислоти (2,6,8-триоксипурину)
Білет 2
Види жовтяниць. Причини виникнення
Причинами виникнення гіпербілірубінемії і розвитку жовтяниць є надмірне утворення білірубіну в організмі, пошкодження печінки з порушенням її детоксикаційної та екскреторної функцій або наявність механічних перешкод у системі жовчовивідних шляхів, що протидіють нормальному виведенню жовчі в кишечник. Розрізняють кілька типів жовтяниць.
Передпечінкова {гемолітична) жовтяниця — розвивається внаслідок патологічно підсиленого руйнування (гемолізу) еритроцитів та розщеплення гемоглобіну і надмірного накопичення в крові білірубіну. Причинами такого стану можуть бути резус-конфлікт у новонароджених, переливання несумісної крові, радіаційне ураження, дія гемотоксичних отрут. збільшення концентрації в крові
загального білірубіну, переважно за рахунок непрямої фракції
Печінкова {паренхіматозна) жовтяниця — розвивається внаслідок порушення
структури та ферментативних властивостей гепатоцитів в результаті дії пошкоджуючих
факторів вірусного, бактеріального, хімічного походження. значна гіпербілірубінемія
(збільшення концентрації загального білірубіну) Зростання в крові прямого білірубіну
Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі.
Ферментативні (спадкові) жовтяниці - виникають внаслідок генетичних ен-
зимопатій, що спричинені порушеннями експресії генів, які відповідають за синтез у
гепатоцитах ферментів кон'югації білірубіну його абсорбції
з крові або екскреції в жовч.
2. Блокування біосинтезу білка дифтерійним токсином (АДФ-рибозилювання факторів трансляції)
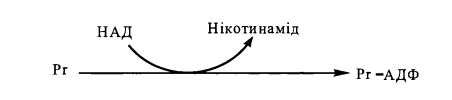 При АДФ-рибозилуванні відбувається приєднання до білка, що підлягає ковалентній модифікації, АДФ-рибозильного радикалу, який відщеплюється від складної молекули нікотинамідаденіндинуклеотиду (НАД)
При АДФ-рибозилуванні відбувається приєднання до білка, що підлягає ковалентній модифікації, АДФ-рибозильного радикалу, який відщеплюється від складної молекули нікотинамідаденіндинуклеотиду (НАД)
АДФ-рибозилування білків є механізмом регуляції багатьох видів клітинної активності, зокрема, експресії ядерного генетичного апарату. Особливим прикладом біологічного ефекту такої модифікації ферментного білка є дія холерного токсину, каталітична субодиниця якого АДФ-рибозилує аденілатциклазу мембран ентероцитів. Це, у свою чергу, супроводжується стимуляцією фосфорилування та активацією хлорного каналу мембран, який є відповідальним за транспорт у просвіт кишківника іонів СІ" та води, що і призводить до важкої діареї - головного клінічного прояву холери.
3. Джерело енергії для м’язового скорочення. АТФ, креатинфорфат. Особливості обміну в серцевому м’язі.
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
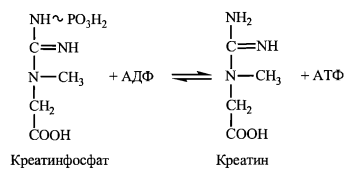
Генерація АТФ із креатинфосфату є найбільш швидким механізмом утворення АТФ при потребі термінового включення процесу м'язового скорочення. За рахунок дії креатинфосфокіназного (КФК) механізму можливе забезпечення інтенсивної роботи м'язів протягом 2-5 с - періоду, необхідного для підключення інших біоенергетичних механізмів. У період розслаблення м'язів відбувається ресинтез креатинфосфату за рахунок зворотної течії креатинкіназної реакції.
Міокард за своєю структурою та біохімічними властивостями близький до смугастих м'язів, зокрема до червоної скелетної мускулатури. Особливістю енергетичного обміну в міокарді є майже повністю аеробний характер, що зумовлює його високу чутливість до порушень у постачанні кисню, зокрема внаслідок звужень у коронарних артеріях. Як субстрат біологічного окислення міокард використовує здебільшого жирні кислоти, на окислення яких витрачається близько 70 % 02, що споживає серцевий м'яз (А. Я. Николаев, 1998). Частка жирних кислот у забезпеченні міокарда АТФ дещо зменшується після споживання їжі, а також в умовах фізичного навантаження; в зазначених умовах зростає окислення глюкози та молочної кислоти, відповідно.Регуляція м'язового скорочення в міокарді відбувається за механізмами, близькими до скелетних м'язів. Проте, на відміну від скелетних м'язів, головним джерелом Са2+ для скорочення кардіоміцитів є екстрацелюлярний кальцій, який при збудженні міокарда надходить у саркоплазму через канали плазматичних мембран.
4. Всмоктування вуглеводів. Порушення травлення і всмоктування. Недостатність лактази
Основні реакції розщеплення вуглеводів відбуваються в тонкому кишечнику за рахунок дії ферментів підшлункової залози, що потрапляють у порожнину дванадцятипалої кишки, і власних ферментів кишкового соку.
Панкреатична а-амілаза - це ендоглікозидаза, подібна до ферменту слини, яка гідролізує крохмаль та глікоген з утворенням суміші розгалужених і нерозгалужених олігосахаридів і деякої кількості мальтози і мальтотріози.
Р-амілаза - панкреатична екзоглікозидаза, яка відщеплює від нерозгалужених гомополісахаридних ланцюгів залишки мальтози.
Дисахаридази та олігосахаридази - ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування:
мальтоза (а-глюкозидаза) - фермент, що гідролізує мальтозу та відщеплює термінальні глюкозні залишки з нередукуючих кінців сс(1-»-4)-зв'язаних олігосахаридів;
мальтаза та ізомальтаза (а(1-»-6)-глікозидаза) завершують розщеплення гомополісахаридів, розпочате амілазами;
лактаза ф-галактозидаза) — фермент, що розщеплює лактозу (молочний цукор) до двох моносахаридів - галактози та глюкози; надзвичайно велике фізіологічне значення лактази в харчуванні дітей;
сахараза ф-фруктозидаза) - фермент кишечного соку, що гідролізує з утворенням глюкози і фруктози дисахарид сахарозу - основний компонент бурякового та тростинного цукру.
утворюється суміш моносахаридів, які всмоктуються клітинами кишкового епітелію і надходять у
кров.
Недостатність дисахаридаз
порушеннями у перетравлюванні та всмоктуванні відповідних цукрів.
Недостатність лактази
неспроможності кишкового соку розщеплювати молочний цукор і позначається як непереносимість лактози. зустрічається у вигляді низької активності лактази. Ця форма непереносимості лактози успадковується як автосомна рецесивна патологія і вперше проявляється в підлітковому періоді або у молодому віці.
Недостатність сахарози звичайно виявляється разом із недостатністю ізо-
мальтази у вигляді поєднаного дефекту - непереносимості двох дисахаридів. Ферментопатія проявляється після переводу новонароджених на мішане харчування з додаванням фруктових соків та інших продуктів, що містять рослинні цукри. вуглеводної диспепсії - діареєю, метеоризмом; новонароджені діти відстають у розвитку.
5. Орнітиновий цикл сечоутворення. Послідовність реакцій



синтез сечовини відбувається з аміаку та вугільної кислоти в результаті циклічного процесу, в якому каталітичну роль відіграють амінокислоти аргінін, орнітин та цитрулін
6. Порушення обміну медіаторів і модуляторів головного мозку при психічних розладах. Нейрохімічні механізми дії психотропних препаратів
Нейромедіатори (нейротрансмітери) - біомолекули, які забезпечують передавання імпульсів (хімічних сигналів) у нервовій системі з одного нейрона на інший, а також з нейрона на ефекторний орган. За хімічною природою нейромедіатори поділяють на такі сполуки: ацетилхолін,
біогенні аміни (катехоламіни — норадреналін, дофамін, серотонін), амінокислоти та їх похідні (у-аміномасляна кислота - ГАМК, гліцин, глутамат, аспартат), пептиди - нейропептиди (ендорфіни, енкефаліни, сполука Р тощо). Медіаторні функції в нервовій системі можуть також виконувати пролін, таурин, (З-аланін, аденозин, простагландини.)
Порушення обміну медіаторів призводить до захворювань нервової системи, порушень передачі нервових імпульсів.
Психотропні лікарські засоби - фармакологічні препарати, що застосовуються при порушеннях психічної діяльності людини. ланки синаптичної передачі в головному мозку, на які діють регулюючим і коригуючим чином психотропні препарати,різної спрямованості:
1) ферментативний синтез та розщеплення нейромедіатора;
2) депонування нейромедіатора у везикулах пресинаптичних закінчень;
3) вивільнення нейромедіатора в синаптичну щілину;
4) взаємодія нейромедіатора із постсинаптичними іонотропними та/або мета-
ботропними рецепторами та включення відповідної послідовності біохімічних і
біофізичних реакцій у мембрані, цитоплазмі й органелах чутливого нейрона;
5) взаємодія нейромедіатора із структурами пресинаптичної мембрани, що
відповідають за його зворотний захват (реаптейк) та ферментативну деградацію.
Найбільш поширеними є такі групи психотропних препаратів: нейролептики {антипсихотики), антидепресанти, анксіолітики.
Нейролептики (антипсихстичні препарати, антипсихотики) -лікарські засоби, які використовуються для лікування психозів, головним чином шизофренії, а також інших ендогенних (органічних) та екзогенних (психогенних) психічних розладів, що проявляються важкими психоемоційними порушеннями з явищами маячення, галюцинацій, збудження.
Антидепресанти - психофармакологічні засоби, які застосовують для лікування депресій різного генезу. Ця група препаратів отримала також назву тимолептиків, тобто "засобів, що покращують настрій"
Анксіолітики - препарати, що мають заспокійливу дію, послаблюючи стан психічної та емоційної напруги, тривоги
Задача: нецукровий діабет.
Білет3
Розпад гема
1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і
супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці"
2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину.
3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою
4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням.
5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів;
2. Паренхіматозна жовтяниця. Причини. Біохімічні показники
Печінкова {паренхіматозна) жовтяниця — розвивається внаслідок порушення
структури та ферментативних властивостей гепатоцитів в результаті дії пошкоджуючих
факторів вірусного, бактеріального, хімічного походження. значна гіпербілірубінемія
(збільшення концентрації загального білірубіну) Зростання в крові прямого білірубіну
3. Молекулярні механізми дії тиреоїдних гормонів.
Рецептори тиреоїдних гормонів локалізовані в ядрах клітин-мішеней. У взаємодії з гормонами беруть участь специфічні рецептори а-1 та Р-1, які є білками з м.м. 47 і 52 кДа, відповідно. Спорідненість цих рецепторів до Т3 значно більша, ніж до Т4. Молекули тиреоїдних рецепторів мають три структурних домени: N-термінальний домен; центральний ДНК-зв'язуючий домен з двома цинковими пальцями; С-термінальний домен, що сполучається з гормоном. Утворення комплексу гормон-рецептор призводить до конформаційних змін у молекулі рецептора; при цьому ДНК-зв'язуючий домен рецептора стає спроможним до взаємодії із специфічними сайтами на промоторах генів, які контролюють транскрипцію мРНК та синтез білків, що відповідають за прояви біологічних ефектів тиреоїдних гормонів.
4. Молекулярні механізми м’язового скорочення та розслаблення м’язів
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
Головним біохімічним регулятором скорочення та розслаблення м'язів є зміни цитозольноїконцентрації іонів Са2+, яка у стані спокою (розслаблення) становить близько 10"8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулуму, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секве-стрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10~5 моль/л, що ініціює молекулярні процеси, які є м'язовим скороченням.
5. Нейромедіатори. Рецептори для нейромедіаторів та фізіологічно активних сполук
Нейромедіатори (нейротрансмітери) - біомолекули, які забезпечують передавання імпульсів (хімічних сигналів) у нервовій системі з одного нейрона на інший, а також з нейрона на ефекторний орган. За хімічною природою нейромедіатори поділяють на такі сполуки: ацетилхолін,
біогенні аміни (катехоламіни — норадреналін, дофамін, серотонін), амінокислоти та їх похідні (у-аміномасляна кислота - ГАМК, гліцин, глутамат, аспартат), пептиди - нейропептиди (ендорфіни, енкефаліни, сполука Р тощо). Медіаторні функції в нервовій системі можуть також виконувати пролін, таурин, (З-аланін, аденозин, простагландини. Рецептори нейромедіаторів - мембранні білки (здебільшого глікопротеїни), що локалізовані в постсинаптичних мембранах нейронів або плазматичних мембранах клітин ефекторних органів і здатні до зв'язування фізіологічних ефекторів (нейромедіаторів, різних ФАС, психотропних сполук) і передавання зовнішньоклітинного хімічного сигналу всередину нейрона. За принципами молекулярної організації та функціонування, рецептори нейромедіаторів - це здебільшого іонотропні рецептори (рецептори І класу), тобто такі, що контролюють відкриття іонних каналів на мембрані для Са2+, Na+ і К+; в ролі первинних ефекторів, що передають хімічний сигнал на нервову клітину, в цьому разі виступають компоненти іонних каналів (розділ 23). Крім того, у фізіологічних ефектах
деяких нейромедіаторів та нейромодуляторів (зокрема, нейропептидів головного мозку, ацетилхоліну та деяких біогенних амінів) беруть участь і метаботропні рецептори (рецептори II класу), які активують внутрішньоклітинні біохімічні системи шляхом утворення цАМФ або цГМФ, включенням фосфоінозитидної системи та/або збільшенням цитозольної концентрації іонів Са2+. Крім нейромедіаторів, із зазначеними типами рецепторів можуть взаємодіяти численні лікарські засоби, нейротоксини, що активують (агоністи), гальмують, блокують (антагоністи) або модулюють біохімічні, нейрофізіологічні та психологічні (поведінкові) ефекти, опосередковані
збудженням специфічних рецепторів певних зон головного мозку.
6. Білковосинтезуюча система. Особливості генетичного коду
Властивості генетичного коду:
(1) код є універсальним для всіх біологічних систем - вірусів, бактерій, вищих організмів;
(2) код є однонаправленим, тобто інформативним тільки в тому випадку, коли зчитується "зліва направо" (в напрямку 5'—»3');
(3) код є безперервним, тобто має лінійний безперервний порядок зчитування - між кодонами немає "розділових знаків";
(4) код є таким, що не перекривається - після зчитування інформації з одного триплета "рамка зчитування" переміщується вправо відразу на три нуклеотиди;
(5) код є "виродженим", тобто кожна амінокислота кодується не одним, а декількома кодонами.
що з 64 комбінацій нуклеотидів 61 кодон є змістовним, тобто таким, що визначає включення до складу білка певної амінокислоти, а 3 кодони - беззмістовними, тобто такими, що не кодують жодної з амінокислот. Ці нонсенс-кодони (UAA, UAG, UGA) виконують роль сигналів термінаціїтрансляції
генетичного (біологічного) коду, тобто сукупності знаків, символів та системи правил, алгоритмів,
'згідно з якими структурна інформація, що міститься в нуклеїнових кислотах, може бути трансформована у специфічну первинну структуру поліпептидів, яка, у свою чергу, визначає всі біологічні властивості білкових молекул.
Компонентами білоксинтезуючої системи, що реалізують процес трансляції в прокаріотичних та еукаріотичних клітинах, є:
рибосоми - рибонуклеопротеїдні структури з константами седиментації 70s та 80s у прокаріотів та еукаріотів (відповідно), що взаємодіють у процесі трансляції з іншими компонентами системи білкового синтезу; мРНК (іРНК) або інший матричний полірибонуклеотид, що програмує послідовність включення амінокислот у поліпептидний ланцюг згідно з інформацією, яка міститься в генетичній ДНК, тРНК, що виконують функцію адапторів у процесі
трансляції, взаємодіючи з кодонами мРНК та певними амінокислотами - близько 20 типів різнихтРНК, відповідно до кількості амінокислот, які вони акцептують, аміноацил-тРНК-синтетази (АРС-ази) - ферменти, що активують амінокислоти та сполучають амінокислотні залишки з З'-кінцями акцепторних гілок тРНК. АРС-ази є ферментами з високою специфічністю як відносно певної амінокислоти, так і тРНК, що їй відповідає; регуляторні білки - білкові фактори ініціації (IF), елонгації (EF) та термінації, або рилізинг-фактори (RF); білкові фактори еукаріотів мають позначення elF, eEF та eRF, відповідно; коферменти - ГТФ, АТФ.
Білет4.
1. Орнітиновий цикл сечоутворення.
Див.2-5
2. Обтураційна жовтяниця
Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі.
3. Білки плазми крові. Альбуміни. Глобуліни. Фібриноген.
Загальна концентрація білків плазми крові людини складає 65-85 г/л, ця величина може змінюватися в бік зменшення (гіпопротеїнемія) у людей старечого віку та за умов патологічних станів, що супроводжуються пригніченням білкового синтезу та активацією розпаду тканинних білків (голодування; виснажливі інфекційні хвороби; стан після тяжких травм, оперативних втручань; кахексія при злоякісних новоутвореннях). поділяються на п'ять фракцій: альбуміни
(сироваткові альбуміни), а1,-глобуліни, а2-глобуліни, в-глобуліни та, у-глобуліни.
Альбуміни (сироваткові альбуміни) - багатодисперсна фракція білків плазми, які характеризуються високою електрофоретичною рухомістю та легкою розчинністю у воді та сольових розчинах. Завдяки високій гідрофільності альбуміни зв'язують значну кількість води, і об'єм їх молекули при умовах гідратації збільшується вдвічі.
забезпечує до 70-80 % онкотичного тиску білків плазми крові, зменшення концентрації альбумінів сироватки, наприклад за умов порушення їх синтезу в гепатоцитах при печінковій недостатності, може спричиняти перехід води із судинного русла до тканин і розвиток онкотичних набряків. Транспортні білки
Глобуліни - гетерогенна фракція білків крові, що виконують транспортні
(а-глобуліни - транспорт ліпідів, тироксину, кортикостероїдних гормонів; а-глобуліни -
транспорт ліпідів, іонів міді; в-глобуліни - транспорт ліпідів, вільного та гемового заліза) та
захисні функції (участь в-глобулінів в імунних реакціях як антитоксинів; у-глобуліни як
фракція імуноглобулінів).
Фібриноген — безбарвний білок, розчинений в плазмі крові. При активації системи згортання крові фібриноген піддається ферментатівному розщеплюванню ферментом тромбіном із утворенням мономеру фібрину, який під дією активного XIII фактора згортання крові полімеризується і випадає в осад у вигляді білих ниток полімеру фібрину. Плазма крові без фібриногену називається сироваткою крові.
4. Біологічний ефект альдостерону.
альдостерон - мінералокортикоїд, фізіологічною функцією якого є стимуляція реабсорбції іонів натрію в дистальних сегментах ниркових канальців та збільшення виділення калію. Молекулярні механізми дії альдостерону полягають у стимуляції синтезу білків, які реалізують транспорт Na+ через мембрани чутливих клітин нефронів. Функціонування альдостеронового механізму тісно сполучене з ренін-ангіотензиновою системою;головний біохімічний ефект дії альдостерону полягає в стимуляції реабсорбції Na+(a разом з ним і СІ") у дистальній частині канальців нефронів.
5. Особливості метаболізму нервової тканини
Загальний хімічний склад головного мозку характеризється наявністю білків (близько 8 % загальної маси тканин), значною кількістю ліпідів (10-12 %), вуглеводів (близько 1 %), інших низькомолекулярних біомолекул, неорганічних солей і води (77-78 %). надзвичайно високому вмісті ліпідів різноманітної хімічної структури. Біоенергетика мозку характеризується значною залежністю від постачання киснем, який використовується переважно на аеробне окислення глюкози. Основним споживачем метаболічної енергії в головному мозку, що використовується у формі АТФ, є процес генерації нервового потенціалу на мембрані нейронів, який вимагає постійного функціонування натрієвого насоса - мембранної Na+, К+-АТФази. Головною особливістю енергетичного обміну головного мозку є значне переважання рівня використання глюкози над іншими субстратами енергетичного обміну. У тканині головного мозку в реакції гідролітичного дезамінування АМФ постійно утворюється вільний аміак, який знешкоджується шляхом взаємодії з глутаматом, утворюючи глутамін, що виходить у кров.
6. Значення обміну мінеральних солей.
Мінеральні солі – іони, створюють осмотичний тиск, що є основною рушійною силою в русі води в організмі. При накопиченні іонів натрію в організмі розвиваються набряки, при його надлишковому виведені – міжклітинна дегідратація.
Білет 5
1. Механізм активації й функціонування каскадної системи згортання крові.

Види жовтяниць
Причинами виникнення гіпербілірубінемії і розвитку жовтяниць є надмірне утворення білірубіну в організмі, пошкодження печінки з порушенням її детоксикаційної та екскреторної функцій або наявність механічних перешкод у системі жовчовивідних шляхів, що протидіють нормальному виведенню жовчі в кишечник. Розрізняють кілька типів жовтяниць.
Передпечінкова {гемолітична) жовтяниця — розвивається внаслідок патологічно підсиленого руйнування (гемолізу) еритроцитів та розщеплення гемоглобіну і надмірного накопичення в крові білірубіну. Причинами такого стану можуть бути резус-конфлікт у новонароджених, переливання несумісної крові, радіаційне ураження, дія гемотоксичних отрут. збільшення концентрації в крові
загального білірубіну, переважно за рахунок непрямої фракції
Печінкова {паренхіматозна) жовтяниця — розвивається внаслідок порушення
структури та ферментативних властивостей гепатоцитів в результаті дії пошкоджуючих
факторів вірусного, бактеріального, хімічного походження. значна гіпербілірубінемія
(збільшення концентрації загального білірубіну) Зростання в крові прямого білірубіну
Післяпечінкова (обтураційна) жовтяниця — спричиняється неможливістю надходження жовчі у дванадцятипалу кишку внаслідок закупорки жовчних шляхів. знебарвленням калових мас внаслідок відсутності в них стеркобіліногену та стеркобіліну ("ахолічний" кал) і цілковитою відсутністю уробіліну в сечі.
Ферментативні (спадкові) жовтяниці - виникають внаслідок генетичних ен-
зимопатій, що спричинені порушеннями експресії генів, які відповідають за синтез у
гепатоцитах ферментів кон'югації білірубіну його абсорбції
з крові або екскреції в жовч.
3. Вітаміни – органічні харчові речовини (ну-и-ну, даже стихами говорят)
Вітаміни - біоорганічні сполуки, що є життєво необхідними компонентами обміну речовин; вітаміни не синтезуються в організмі людини як інші біомолекули, а надходять з компонентами харчування. На відміну від таких поживних речовин, як вуглеводи, ліпіди та білки, вітаміни належать до мікрокомпонентів харчування: їх добові потреби для людини складають міліграмові або мікрограмові кількості. Водорозчинні вітаміни
Вітамін В] (тіамін; антиневритний вітамін).
Вітамін В2 (рибофлавін).
Вітамін РР (вітамін В а ніацин; антипелагричний вітамін).
Вітамін В6 (піридоксин; антидерматитний вітамін).
Вітамін Вп (кобаламін; антианемічний вітамін).
Фолієва кислота (птероїлглутамат; антианемічний вітамін).
Вітамін Н(біотин; антисеборейний вітамін).
Пантотенова кислота (вітамін EL; антидерматитний вітамін).
Вітамін С (аскорбінова кислота).
Вітамін Р (вітамін проникності).
Жиророзчинні вітаміни
Вітамін А (ретинол; аксерофтол; вітамін росту).
Вітамін К (філохінон; антигеморагічний вітамін).
Вітамін Е (а-токоферол; вітамін розмноження).
Вітамін F (комплекс поліненасичених жирних кислот).
Вітамін D (кальциферол; антирахітний вітамін).
Вітамінна недостатність - стан, що розвивається внаслідок зменшення (або відсутності) певного вітаміну в організмі. Вітамінна недостатність супроводжується важкими розладами біохімічних та фізіологічних процесів і виникненням специфічної патології.
4. Молекулярні механізми м’язового скорочення та розслаблення м’язів
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
Головним біохімічним регулятором скорочення та розслаблення м'язів є зміни цитозольноїконцентрації іонів Са2+, яка у стані спокою (розслаблення) становить близько 10"8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулуму, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секве-стрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10~5 моль/л, що ініціює молекулярні процеси, які є м'язовим скороченням.
5. Енергетичний обмін в головному мозку людини. Значення аеробного окислення глюкози.
Загальний хімічний склад головного мозку характеризється наявністю білків (близько 8 % загальної маси тканин), значною кількістю ліпідів (10-12 %), вуглеводів (близько 1 %), інших низькомолекулярних біомолекул, неорганічних солей і води (77-78 %). надзвичайно високому вмісті ліпідів різноманітної хімічної структури. Біоенергетика мозку характеризується значною залежністю від постачання киснем, який використовується переважно на аеробне окислення глюкози. Основним споживачем метаболічної енергії в головному мозку, що використовується у формі АТФ, є процес генерації нервового потенціалу на мембрані нейронів, який вимагає постійного функціонування натрієвого насоса - мембранної Na+, К+-АТФази. Головною особливістю енергетичного обміну головного мозку є значне переважання рівня використання глюкози над іншими субстратами енергетичного обміну. У тканині головного мозку в реакції гідролітичного дезамінування АМФ постійно утворюється вільний аміак, який знешкоджується шляхом взаємодії з глутаматом, утворюючи глутамін, що виходить у кров.
6. Схема синтезу ІМФ
(1) взаємодія а-0-рибозо-5-фосфату з АТФ з утворенням 5-фосфорибозил-1-піро-
фосфату (ФРПФ);
(2) взаємодія ФРПФ із глутаміном з утворенням 5-фосфорибозиламіну;
(3) взаємодія 5-фосфорибозиламіну з гліцином з утворенням гліцинамід-рибозил-5-
фосфату (ГАР); о
(4) взаємодія ГАР з активною формою форміату (—С—Н) (К5,К10-метеніл-Н4-фо-
латом) з утворенням форміл-ГАР;
(5) взаємодія форміл-ГАР з глутаміном (донором аміногрупи) з утворенням форміл-
гліцинамідин-рибозил-5-фосфату(форміл-ГАМ);
(6) взаємодія форміл-ГАМ з АТФ із замиканням імідазольного кільця, тобто
утворенням сполуки, що містить п'ятичленне кільце пуринового циклу - аміноімідазол-
рибозил-5-фосфату (АІР);
(7) карбоксилування АІР з утворенням аміноімідазолкарбоксилат-рибозил-5-фос-
фату (АІКР);
(8) взаємодія АІКР із аспартатом (донором аміногрупи) з утворенням проміжної
сполуки - аміноімідазолсукцинілкарбоксамід-рибозил-5-фосфату (АІСКР);
(9) розщеплення АІСКР з елімінацією фумарату та утворенням аміноімідазолкарбо-
ксамід-рибозил-5-фосфату (АІКАР); О
(10) форматування АІКАР за рахунок (—С—Н)-групи №°-форміл-Н4-фолату з
утворенням формамідоімідазолкарбоксамід-рибозил-5-фосфату (ФАІКАР);
(11) дегідратація та циклізація ФАІКАР з утворенням першого пуринового нуклео-
тиду - інозинмонофосфорної (інозинової) кислоти, (ІМФ).
Білет 6
1. Мікросомальне окислення і реакції кон’югації в печінці. Компоненти окислення. Роль цитохрома Р-450
 1 фаза — окислювально-відновлювальні та гідролітичні реакції, що каталізуються мембранозв'язаними ферментами ендоплазматичного ретикулуму гєпатоцитів ("мікро- сомальними ферментами"). У результаті реакцій першої фази у складі субстратів біотрансформації утворюються функціональні групи -ОН, -СООН, -SH, -NH2; таким чином, ці реакції (функціоналізації, або прекон 'югації) призводять до збільшення полярності молекули ксенобіотика або ендогенного субстрату (наприклад, стероїду).
1 фаза — окислювально-відновлювальні та гідролітичні реакції, що каталізуються мембранозв'язаними ферментами ендоплазматичного ретикулуму гєпатоцитів ("мікро- сомальними ферментами"). У результаті реакцій першої фази у складі субстратів біотрансформації утворюються функціональні групи -ОН, -СООН, -SH, -NH2; таким чином, ці реакції (функціоналізації, або прекон 'югації) призводять до збільшення полярності молекули ксенобіотика або ендогенного субстрату (наприклад, стероїду).
2 фаза — реакції синтезу, або кон'югації, що ґрунтуються на приєднанні до молекулярних продуктів 1-ї фази (або вихідних субстратів, що вже мали у своєму складі полярні функціональні групи) залишків глюкуронової, сірчаної кислот, гліцину, глутаміну, глутатіону, метильного або ацетильного радикалів.
1) окислювальне гідроксилування аліфатичних сполук: 1а - алканів та алкенів:
R-CH3»-R-CH2OH
1 б - алкільних бічних ланцюгів циклічних сполук, наприклад:
С,Н,-СН, ►С,Н,-СН,ОН
2) окислювальне гідроксилування циклічних сполук
3) окислювальне дезалкілування,
4) реакції відновлення
Цитохром Р-450 гемопротеїн залежно від ізоформи, який має спектр поглинання СО-комплексу при 450 нм. виявлено близько 500 ізоформ цитохрому-450, що розрізняються за своєю субстратною специфічністю, особливостями первинної структури та фізико-хімічних властивостей. каталізі реакцій окислювального гідроксилування, що мають місце при синтезі і біотрансформації ендогенних гідрофобних сполук ліпідної природи, а саме - холестерину, фізіологічно активних стероїдів, жовчних кислот та деяких інших природних ліпідів, зокрема метаболізмі ейкозаноїдів.
Реакції кон 'югації в гепатоцитах
Реакції кон'югації з утворенням "парних" сполук - шлях детоксикації більшості ксенобіотиків, що мають функціональні групи -ОН, -СООН, -NH2, -SH. 1. Реакціїглюкуронування (УДФ), УДФ-глюкуронілтрансфераза, 2. Реакції сульфування, донором NH2
сульфатних радикалів у яких є біологічно активна форма сірчаної кислоти - 3'-фосфоаденозин-5'-фосфосульфат (ФАФС). 3. Реакції метилування та ацетилування - поширений тип кон'югації, якому підлягають як ксенобіотики, так і ендогенні субстрати; в цих реакціях беруть участь S-аденозилметіонін (О-метилування) та ацетил-КоА (N-ацетилування): 4. Реакції кон 'югації з гліцином. Поширеною реакцією є утворення гіпурової кислоти при взаємодії ендогенної амінокислоти гліцину із введеною в організм бензойною кислотою:
2. Розпад гема. Жовчні пігменти.
1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і
супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці"
2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину.
3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою
4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням.
5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів;
3. Молекулярні механізми м’язового скорочення та розслаблення м’язів
м'язове скорочення, в основі якого лежить переміщення товстих і тонких філаментів, потребує участі АТФ; циклічне перетворення АТФ в АДФ є необхідною передумовою як скорочення, так і
розслаблення м'язів. Гідроліз АТФ до АДФ та Фн здійснюється завдяки АТФ-азній активності
глобулярних головок S1 міозину.
A. У м'язі, що перебуває в стані спокою, S1-головки міозину не сполучені з актиновими філамен-тами. Продукти гідролізу АТФ (АДФ та Фн) зв'язані з міозином.
B. При збудженні м'яза S1-головки зсуваються в напрямку тонких філаментів і сполучаються з
нитками актину (G-субодиницями). Фн вивільняється з комплексу з міозином.
C. Вивільнення АДФ з комплексу з міозином супроводжується конформаційним зсувом у
просторовому розташуванні головки S1, що зв'язана з актином (зміщенням кута між головкою і віссю міофібрили з 90° на 45°).
D. Взаємодія з актином молекули АТФ супроводжується розривом зв'язку між актином і міозином. S1-головка знову віддаляється від тонкого філамента.
E. АТФ, що вивільнився, гідролізується до АДФ та Фн, завдяки АТФ-азній активності вільних головок міозину. Продукти гідролізу знову сполучаються з міозином. Актинові та міозинові філамента готові до нового циклу взаємодії та пересування.
Головним біохімічним регулятором скорочення та розслаблення м'язів є зміни цитозольноїконцентрації іонів Са2+, яка у стані спокою (розслаблення) становить близько 10"8-10-7 моль/л. Поширення потенціалу дії з сарколеми на трубочки Т-системи, що контактують із мембранами саркоплазматичного ретикулуму, спричиняє вихід Са2+ з канальців СР, які відіграють роль депо Са2+ в міоцитах (у комплексі з білком секве-стрином). Внаслідок цих процесів концентрація Са2+ в саркоплазмі досягає 10~5 моль/л, що ініціює молекулярні процеси, які є м'язовим скороченням.
4. Всмоктування вуглеводів. Порушення травлення і всмоктування.
Основні реакції розщеплення вуглеводів відбуваються в тонкому кишечнику за рахунок дії ферментів підшлункової залози, що потрапляють у порожнину дванадцятипалої кишки, і власних ферментів кишкового соку.
Панкреатична а-амілаза - це ендоглікозидаза, подібна до ферменту слини, яка гідролізує крохмаль та глікоген з утворенням суміші розгалужених і нерозгалужених олігосахаридів і деякої кількості мальтози і мальтотріози.
Р-амілаза - панкреатична екзоглікозидаза, яка відщеплює від нерозгалужених гомополісахаридних ланцюгів залишки мальтози.
Дисахаридази та олігосахаридази - ферменти, що синтезуються в тонкій кишці і спричиняють розщеплення до моносахаридів відповідних цукрів, які утворюються як продукти дії амілаз або надходять до травного каналу в складі рослинних продуктів харчування:
мальтоза (а-глюкозидаза) - фермент, що гідролізує мальтозу та відщеплює термінальні глюкозні залишки з нередукуючих кінців сс(1-»-4)-зв'язаних олігосахаридів;
мальтаза та ізомальтаза (а(1-»-6)-глікозидаза) завершують розщеплення гомополісахаридів, розпочате амілазами;
лактаза ф-галактозидаза) — фермент, що розщеплює лактозу (молочний цукор) до двох моносахаридів - галактози та глюкози; надзвичайно велике фізіологічне значення лактази в харчуванні дітей;
сахараза ф-фруктозидаза) - фермент кишечного соку, що гідролізує з утворенням глюкози і фруктози дисахарид сахарозу - основний компонент бурякового та тростинного цукру.
утворюється суміш моносахаридів, які всмоктуються клітинами кишкового епітелію і надходять у
кров.
Недостатність дисахаридаз
порушеннями у перетравлюванні та всмоктуванні відповідних цукрів.
Недостатність лактази
неспроможності кишкового соку розщеплювати молочний цукор і позначається як непереносимість лактози. зустрічається у вигляді низької активності лактази. Ця форма непереносимості лактози успадковується як автосомна рецесивна патологія і вперше проявляється в підлітковому періоді або у молодому віці.
Недостатність сахарози звичайно виявляється разом із недостатністю ізо-
мальтази у вигляді поєднаного дефекту - непереносимості двох дисахаридів. Ферментопатія проявляється після переводу новонароджених на мішане харчування з додаванням фруктових соків та інших продуктів, що містять рослинні цукри. вуглеводної диспепсії - діареєю, метеоризмом; новонароджені діти відстають у розвитку.
5. Класифікація гормонів: за місцем синтезу, хімічною природою, механізмом дії.
Гормони - фізіологічно активні сполуки (ФАС), що продукуються залозами внутрішньої секреції (ендокринними залозами) або іншими спеціалізованими клітинами і діють як сигнальні молекули та біорегулятори метаболічних процесів та фізіологічних функцій в організмі. Біологічні ефекти гормонів здійснюються у надзвичайно низьких концентраціях. Гормони, що синтезуються в ендокринних залозах ("справжні", істинні гормони), секретуються в кров'яне русло
і після перенесення спеціалізованими транспортними білками здійснюють свої біологічні ефекти, як правило, на відстані, тобто діють на віддалений чутливий орган або органи.
До "справжніх" гормонів належать:
- гормони гіпоталамуса та гіпофіза;
- гормони щитовидної залози;
- гормони паращитовидної залози;
-гормони ендокринних клітин підшлункової залози;
-гормони коркової частини надниркових залоз;
- гормони чоловічих та жіночих статевих залоз;
- гормони епіфіза.
Хімічна структура гормонів За хімічною будовою всі гормони поділяють на такі класи:
(1) білково-пептидні гормони (прості білки; глікопротеїни; пептиди): гіпоталамо-гіпофізарні гормони; гормони паращитовидної залози; гормони острівкової частини підшлункової залози; гастроінтестинальні гормони; нейропептиди; численні тканинні біорегулятори пептидної природи;
(2) гормони - похідні амінокислот: гормони щитовидної залози; гормоноїди мозкової частини надниркових залоз (катехоламіни); інші нейромедіатори з властивостями гістогормонів (серотонін, дофамін, гістамін); гормон епіфіза - мелатонін;
(3) гормони стероїдної природи: глюкокортикоїди та мінералокортикоїди кори надниркових залоз; чоловічі та жіночі статеві гормони; похідні вітаміну D;
(4) біорегулятори - похідні арахідонової кислоти (ейкозаноїди): простагландини, простацикліни, тромбоксани, лейкотрієни, ліпоксини.
6. Біосинтез піримідинових нуклеотидів


Білет 7
1. Жіночі статеві гормони. Механізм дії
До жіночих статевих гормонів належать:
естрогени - похідні естрану (С18-стероїди);
прогестагени - похідні прегнану (С2І-стеро'їди).
Діють естрогени шляхом зміни синтезу білків у клітині, хоча можуть надавати і зовнішньорецепторний ефект. Механізм дії. Е. вибірково накопичуються в органах-мішенях — матці, піхві, молочних залозах, передній частці гіпофіза, печінці, де зв’язуються зі специфічним позаядерним білком естрофіліном, рецепторами плазматичних мембран клітин-мішеней, утворюючи з ними гормон-рецепторні комплекси. Вони проникають у ядро, активують синтез ДНК і РНК, впливають на синтез білка.
2. Загальна схема біосинтезу ДНК. Ферменти реплікації ДНК у прокаріотів та еукаріотів.
Було встановлено, що в цих умовах синтезується певна кількість нової ДНК (точніше, полідезоксирибонуклеотиду), до складу якого входили дезоксинуклео- зидмонофосфати (дНМФ) із складу дНТФ, що були використані для біосинтезу. При цьому новий ланцюг ДНК утворювався за рахунок приєднання дНМФ до кінця одного з ланцюгів ДНК, що вже існувала (передіснуючої ДНК). Особливості синтезу ДНК в ДНК-полімеразній системі:
- ДНК-полімераза не може синтезувати повністю новий ланцюг ДНК, а спроможна лише приєднувати дНМФ до вже існуючого ланцюга;
- синтез нового ланцюга ДНК відбувається в напрямку 5'-3', тобто ДНК-поліме- раза послідовно приєднує нуклеотиди (дНМФ з наявних дНТФ) до 3'-кінця одного з ланцюгів ДНК ("ланцюга-затравки");
- для синтезу нового ланцюга ДНК необхідний також ланцюг-матриця; нуклеотиди сполучаються з З'-кінцем "ланцюга-затравки" відповідно до нуклеотидної послідовності в "ланцюгу-матриці" (тобто, за принципом комплементарності).
Ферменти біосинтезу ДНК у прокаріотів:
1) ДНК-полімераза І - білок з м.м. 103 кДа. Біохімічні функції:
5'—>3' - полімеразна активність (розглянута вище);
5'—>3' - екзонуклеазна активність (тобто спроможність видаляти нуклеотиди вище від напрямку синтезу);
З'—»5' - екзонуклеазна активність ("коригуюча" активність, або спроможність видаляти вже включений нуклеотид, якщо він включений помилково, тобто не є комплементарним ланцюга-матриці);
2) ДНК-полімераза II (білок з м.м. 120 кДа) не є основним в реплікації ДНК у прокаріотів; за існуючими уявленнями, переважною функцією цього ферменту є участь у репарації ДНК;
3) ДНК-полімераза III- головний фермент, що реалізує процес елонгації ДНК у Е. соїі.
Розпад гема.
1. Розрив тетрапірольного кільця гему (у складі гемоглобіну) шляхом окислювального розщеплення метинового містка між І та II кільцями протопорфіринового циклу; в результаті реакції червоний пігмент еритроцитів гемоглобін перетворюється на зелений кров'яний пігмент вердоглобін (холеглобін). Реакція каталізується ферментом НАДФН-залежною гемоксигеназою і
супроводжується виділенням монооксиду вуглецю. Перетворення гемоглобіну на вердоглобін внаслідок окислення гему спричиняє послідовну зміну забарвлення в ділянках гематом, що утворюють "синці"
2. Розпад вердоглобіну з відщепленням білкової частини, вивільненням іона заліза та утворенням тетрапірольної молекули білівердину.
3. Перетворення білівердину на білірубін шляхом відновлення метинового зв'язку між піроламиIII, IV. Реакція каталізується ферментом НАДФН-залежною білівер- динредуктазою
4. Зазначені етапи утворення жовчних пігментів (1-3) відбуваються в клітинах ретикулоендотеліальної системи, з яких білірубін надходить у кров, де адсорбується молекулами сироваткового альбуміну. Комплекс "сироватковий альбумін - білірубін" транспортується в печінку, де пігмент поглинається гепатоцитами і підлягає подальшим перетворенням.
5. Білірубін є ліпідорозчинною речовиною і у високих концентраціях проявляє мембранотоксичність, особливо щодо клітин головного мозку. Детоксикація білірубіну, яка полягає в перетворенні пігменту у водорозчинну (і менш токсичну) форму - глю- куронід білірубіну, відбувається в мембранах ендоплазматичного ретикулуму гепатоцитів. У процесі взаємодії білірубіну з УДФ-глюкуроновою кислотою (УДФГК) утворюються моно- та диглюкуроніди білірубіну: Реакція каталізується УДФ-глюкуронілтрансферазою. Основна частина білірубіну екскретується в жовч у формі диглюкуронідів;
4. Біохімія нейромедіаторів та фізіологічно активних сполук.
Нейромедіатори (нейротрансмітери) - біомолекули, які забезпечують передавання імпульсів (хімічних сигналів) у нервовій системі з одного нейрона на інший, а також з нейрона на ефекторний орган. За хімічною природою нейромедіатори поділяють на такі сполуки: ацетилхолін,
біогенні аміни (катехоламіни — норадреналін, дофамін, серотонін), амінокислоти та їх похідні (у-аміномасляна кислота - ГАМК, гліцин, глутамат, аспартат), пептиди - нейропептиди (ендорфіни, енкефаліни, сполука Р тощо). Медіаторні функції в нервовій системі можуть також виконувати пролін, таурин, (З-аланін, аденозин, простагландини. Рецептори нейромедіаторів - мембранні білки (здебільшого глікопротеїни), що локалізовані в постсинаптичних мембранах нейронів або плазматичних мембранах клітин ефекторних органів і здатні до зв'язування фізіологічних ефекторів (нейромедіаторів, різних ФАС, психотропних сполук) і передавання зовнішньоклітинного хімічного сигналу всередину нейрона. За принципами молекулярної організації та функціонування, рецептори нейромедіаторів - це здебільшого іонотропні рецептори (рецептори І класу), тобто такі, що контролюють відкриття іонних каналів на мембрані для Са2+, Na+ і К+; в ролі первинних ефекторів, що передають хімічний сигнал на нервову клітину, в цьому разі виступають компоненти іонних каналів (розділ 23). Крім того, у фізіологічних ефектах
деяких нейромедіаторів та нейромодуляторів (зокрема, нейропептидів головного мозку, ацетилхоліну та деяких біогенних амінів) беруть участь і метаботропні рецептори (рецептори II класу), які активують внутрішньоклітинні біохімічні системи шляхом утворення цАМФ або цГМФ, включенням фосфоінозитидної системи та/або збільшенням цитозольної концентрації іонів Са2+. Крім нейромедіаторів, із зазначеними типами рецепторів можуть взаємодіяти численні лікарські засоби, нейротоксини, що активують (агоністи), гальмують, блокують (антагоністи) або модулюють біохімічні, нейрофізіологічні та психологічні (поведінкові) ефекти, опосередковані
збудженням специфічних рецепторів певних зон головного мозку.
5. Роль печінки в обміні білків, жирів та вуглеводів
/. Вуглеводна (глікогенна) функція печінки Ця функція полягає в здатності гепатоцитів утворювати лабільні резерви вуглеводів, що використовуються для підтримання необхідних концентрацій глюкози в крові та постачання цього цукру в інші органи (насамперед, головний мозок) у періоди між прийомами їжі. Утворення й утилізація глюкозо-6-фосфату
Крім використання ліпідів для власних енергетичних та структурних потреб, печінці належить визначальна роль у регуляції окислення жирів іншими тканинами - функція, що реалізується шляхом утворення в гепатоцитах і секреції в кров триацилглщеролів (у формі лїпопротеїнів дуже низької щільності — ЛПДНЩ) та кетонових тіл. У печінці утворюється також основна частина холестерину, що використовується в периферичних тканинах для синтезу фізіологічно активних стероїдів. Роль печінки в білковому обміні цілісного організму полягає в утворенні більшості
білків плазми крові, які виконують важливі біохімічні та фізіологічні функції, регуляції розподілу амінокислот між окремими органами і тканинами та синтезі сечовини як кінцевого продукту азотистого катаболізму.
6. Потреба в ліпідах, роль лейкотрієпів, простагландинів, тромбоксанів. Ліпіди і захворювання.
Ліпіди - клас біоорганічних сполук, характерною ознакою яких є нерозчинність у воді й інших полярних розчинниках та здатність до розчинення в неполярних (гідрофобних) рідинах. Неполярні розчинники (діетиловий ефір, тетрахлорметан, хлороформ тощо) використовують для екстрагування ліпідів із біологічних об'єктів (крові, тканин т.і.). В організмі людини та тварин ліпіди виконують важливі функції як акумулятори та постачальники енергії, компоненти структури клітин, особливо біологічних мембран; певні представники ліпідів є фізіологічно активними речовинами (вітаміни, гормони). Лейкотрієни - гідроксипохідні арахідонової кислоти, спряжені трієни, що, на відміну від інших ейкозаноїдів, не містять у собі циклічної структури. Залежно від особливостей хімічної будови, розрізняють декілька типів лейкотрієнів. Простагландини та простацикліни — гідрокси- похідні 20-вуглецевих жирних кислот, що містять у своїй структурі п'ятичленний цикл. Разом ці сполуки складають підклас простаноїдів — похідних простанової кислоти, яка утворюється за рахунок замикання зв'язку між 8-м та 12-м
вуглецевими атомами в молекулі арахідонової (С204) кислоти. Простагландини позначаються скорочено ПГ (PG - Prostaglandin, англ.) з додаванням заголовної літери латинського алфавіту (А, В, D, Е, F, G, Н, І), цифрового індексу, що вказує на кількість подвійних звязків у бічному
ланцюзі, та (в деяких випадках) літери грецького алфавіту (позначає певний ізомер). Довжина бічних ланцюгів R у більшості простагландинів складає 7 або 8 вуглецевих атомів. Окремі представники простагландинів розрізняються наявністю та розташуванням кето- або гідроксильної групи в кільці або бічному ланцюгу, будовою бічних ланцюгів (ЬЦ, R8, R4), наявністю в них подвійних зв'язків. Своєрідну будову з наявністю внутрішньої циклічної кисневої структури має простагландин PGI2, що отримав назву простацикліну (рис. 25.9).
2. Тромбоксани - гідроксипохідні 20-вуглецевих жирних кислот, що містять у своїй структурі 6-членний кисеньвмісний цикл. Активна форма тромбоксанів - тромбоксани А - мають внутрішній атом кисню в гетероциклічному кільці.
Тромбоксани є фізіологічними антагоністами антитромботичних ефектів прос- тацикліну. На відміну від простацикліну, тромбоксани, особливо тромбоксан А2, що також утворюється в інтимі кровоносних судин, спричиняють скорочення гладеньких м'язів судин та сприяють агрегації тромбоцитів. Біохімічні механізми проагрегантної дії тромбоксану полягають у його позитивному впливі на мобілізацію з внутрішньоклітинних депо іонів Са2+, які спричиняють активацію скорочувальних білків тромбоцитів та їх адгезію до поверхні ендотелію.
4. Важливою функцією ейкозаноїдів різних класів, особливо простагландинів, лейкотрієнів та ліпоксинів, є їх участь у розвитку і регуляції такого загально- патологічного процесу, як запалення, яке є біологічним захистом тканин від дії пошкоджуючих факторів.
Стимулюють розвиток запального процесу – простагландини.
Білет 8
1. Етапи та механізми трансляції. Ініціація. Елонгація. Термі нація.
 1. Ініціація синтезу полідезоксирибонуклеотидних ланцюгів ДНК, якій передує утворення "затравних" (праймерних) ланцюгів РНК (РНК-праймерів), до 3'- ОН-груп яких здатні приєднуватися дНМФ, що утворюють нові (дочірні) ланцюги ДНК. Довжина цих праймерних ланцюгів складає в середньому від 10 до 200 нуклеотидів. Синтез РНК-праймерів відбувається за участю ферментів РНК-полімераз - так званих праймаз.
1. Ініціація синтезу полідезоксирибонуклеотидних ланцюгів ДНК, якій передує утворення "затравних" (праймерних) ланцюгів РНК (РНК-праймерів), до 3'- ОН-груп яких здатні приєднуватися дНМФ, що утворюють нові (дочірні) ланцюги ДНК. Довжина цих праймерних ланцюгів складає в середньому від 10 до 200 нуклеотидів. Синтез РНК-праймерів відбувається за участю ферментів РНК-полімераз - так званих праймаз.
2. Елонгація синтезу ДНК, яка відбувається за різними механізмами на лідируючому та відстаючому ланцюгах.
2.1. На лідируючому ланцюгу нарощування дНМФ здійснюється ДНК-поліме- разою III, що функціонує безперервно, утворюючи ланцюг ДНК від РНК-праймера до реплікативної вилки.
2.2. На відстаючому ланцюгу: а) спочатку при дії ДНК-полімерази III синтезуються окремі фрагменти Оказакі, кожен з яких починається з відповідного РНК-праймера і закінчується перед
початком передуючого йому РНК-праймера; б) після формування фрагментів Оказакі ДНК-полімераза І, за рахунок своєї 5'—>3'- екзонуклеазної активності, видаляє РНК-праймери і (за рахунок 5'—»3'-полімеразної активності) заміщує їх фрагментами ДНК;
в) розриви між окремими фрагментами Оказакі зшиваються спеціальним ферментом ДНК-лігазою.
2. Гормони гіпофіза
Передня частка гіпофіза (аденогіпофіз) продукує значну кількість гормонів, які стимулюють фізіологічні та біохімічні процеси в різних тканинах-мі






