Концентрация витамина в крови или моче.
 |  |
Норма
| Снижено (мало в пище, нарушено всасывание) в 5 раз больше физиологических доз | |||
Концентрация коферментов
 (в крови, клетках) (в крови, клетках)
| ||||
Норма
| Снижено (нарушен биосинтез, транспорт) Мегавитаминотерапия в 100 – 1000 раз больше | |||
 Активность витаминзависимых ферментных систем Активность витаминзависимых ферментных систем
| ||||
Не определяется витамин бесполезен (апофермент неактивен)
| Норма |  Активность фермента снижена Активность фермента снижена
| 
| Мегавита-мино-терапия |
| Ограничение белка | Мало белка | Апофермент дефектен |
Принадлежность витаминов в пищевым веществам привела к широкому назначению витаминных препаратов в лечебных и профилактических целях.
С расширением профилактического и особенно лечбноо применения появились и учащаются случаи интоксикации витаминами, получившие название гипервитаминозов. Более токсичными оказались жирорастворимые витамины D, А.
Антивитамины.
Это соединения, частично или полностью выключающие витамины из обменных процессов в организме путем их разрушения, инактивирования или препятствия их обмену.
Антиметаболиты.
Структуроподобные соединения (конкурентные ингибиторы) |  Вещества связывающие или разрушающие витамины (неконкурентные ингибиторы)
Вещества связывающие или разрушающие витамины (неконкурентные ингибиторы)
|
Структуроподобные соединения по структуре сходны с самим витамином, поэтому вступают с ними в конкуренцию за место связи их с апоферментом – образуется неполноценный фермент, не способный выполнять физиологические функции (развивается специфический гипо- или авитаминоз). Тиамин – окситиамин, рибофлавин – изорибофлавин.
Вещества, связывающие или разрушающие витамин – действуют на готовый витамин или кофермент. Из рыб семейства тресковых, пресноводных молюсков выделен фермент тиаминаза, которая разрушает витамин В1. Авидин(белок яиц) связывает В7 (биотин) необратимо.
Многие антивитамины используются как лекарственные препараты, так как обладают выраженным антибактериальным действием (очень чувствительны бактерии к витаминам, которые являются необходимым компонентом их жизнедеятельности, срок воспроизведения у бактерий очень короткий – отсюда возможность использования их как лекарственных веществ).
Витамин К – производные кумарина.
Аналог В6 (пиридоксина) – изониазид (на микобактерии туберкулеза), но при длительном назначении моет вызвать недостаточность В5, так как аналог коферментам НАД и НАДФ.
Антивитамины парааминобензойной кислоты – сульфаниламиды.
Атебрин, акрихин – антиметаболиты В2, блокируют образование ФАД. Эти препараты используются при лечении малярии, заражении паразитами (простейшие).
Витамин В5(РР).
Витамин РР – амин никотиновой кислоты входит в состав коферментов: НАД, НАДФ.
Никотиновая кислота синтезируется из триптофана через кинуренин и оксихинолиновую кислоту.
Никотинамид получил название антипеллагрического витамина, т.к. предотвращает развитие пеллагры. Пеллагра характеризуется специфическими проявлениями: симметрической эритемой кожи, стоматитом, глосситом, гастритом, диареей, энцефалопатией с психическими нарушениями.
НАД и НАДФ являются коферментами дегидрогеназ.
Участвуют в ряде процессов:
1. Биологическое окисление – НАД и [НАДФ] выполняют роль промежуточных переносчиков протонов и электронов между субстратом и флавинзависимыми дегидрогеазами.
2. НАДФН используется в синтезе жирных кислот, холестерина, как источник восстановительных эквивалентов.
3. НАДН обеспечивает превращение метгемоглобина в гемоглобин:
Метгемоглобин

 НАДН
НАДН
НАД+
Гемоглобин
При нарушении процесса в эритроцитах накапливается метгемоглобин и возникает анемия, т.к. метгемоглобин не связывает О2.
4. НАДФН необходим для восстановления глутатиона

Глутатион необходим для восстановления перекисей.
Снижение концентрации восстановленного глутатиона приводит к гемолитическому кризу. Больные погибают от тяжелой гемолитической анемии, вызванной накоплением перекиси. В эритроцитах нет митохондрий и это приводит к накоплению перекиси. В основе анемии лежит недостаточность глюкозо-6-фосфатдегидрогеназы – фермента пентозного пути окисления глюкозы. В основе развития медикаментозных гемолитических анемий также лежит дефект глюкозо-6-фосфатдегидрогеназы. Такая анемия возникает при использовании противомалярийного средства – примахин.
5. НАД входит в состав дегидрогеназ цикла Кребса.
6. НАД участвует в окислении жирных кислот.
Примеры реакций.
1. Окислительное декарбоксилирование пирувата



Эта реакция связывает гликолиз с ЦТК, сопровождается образованием АТФ.
2. Окислительное декарбоксилирование 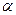 -кетоглутарата
-кетоглутарата



Это реакция ЦТК, на этой стадии идет образование АТФ.
3. Превращение малата в ЩУК в ЦТК



4. Окисление жирных кислот


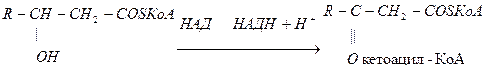
5. НАДФН+Н+ используется в синтезе жирных кислот
6. Синтез холестерина

7. НАД-зависимые дегидрогеназы участвуют в биологическом окислении.
SH2  НАД/НАДН+Н+
НАД/НАДН+Н+ 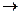 ФАД/ФАДН2
ФАД/ФАДН2 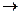 КоQ/КоQН2
КоQ/КоQН2 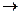 цит b
цит b 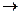 цит с
цит с 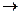 цит а
цит а 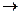 цит а3
цит а3 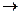 О2
О2
Никотинамид синтезируется из триптофана
Триптофан
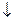 кинурениназа кинурениназа
| ||
 Кинуреновая кислота
В6 Кинуреновая кислота
В6
|     Кинуренин
1 Кинуренин
1  В6 В6
|  Антраниловая кислота Антраниловая кислота
|
 Ксантуреновая кислота Ксантуреновая кислота
| Оксикинуренин | Оксиантраниловая кислота
|
 Никотинамид Никотинамид
| Хинолиновая кислота |
Патология обмена витамина В5.
Никотинамид получил название антипеллагрического витамина, т.к. предотвращает развитие пеллагры.
Пеллагра характеризуется специфическими проявлениями: симметрической эритемой кожи, стоматитом, глосситом, гастритом, диареей, энцефалопатией с психическими нарушениями.
Пеллагра – заболевание 3-х «Д» - дермат, деменция, диарея.
Болезнь Хартнупа связана с нарушением всасывания триптофана и продуктов его обмена в почках. Недостаток триптофана приводит к снижению образования никотиновой кислоты и это вызывает развитие пеллагроподобных симптомов.
Витамин В6.
Витамин В6 включает 3 родственных соединения: пиридоксин, пиридоксаль и пиридоксамин.
Коферментная форма – пиридоксальфосфат (ПААФ).
Пиридоксальфосфат является коферментом аминотрансфераз и декарбоксилаз.  -аминолевулинатсинтаза в качестве кофермента также содержит пиридоксальфосфат. Витамин В6 принимает участие в обмене триптофана.
-аминолевулинатсинтаза в качестве кофермента также содержит пиридоксальфосфат. Витамин В6 принимает участие в обмене триптофана.
1. Реакции трансаминирования аминокислот

2. Декарбоксилирование аминокислот.

3. Синтез гема из глицина и сукцинил-КоА

 Н2N-СН2-СООН + НООС-СН2-СН2-СОSКоА
Н2N-СН2-СООН + НООС-СН2-СН2-СОSКоА 
НООС-СН2-СН2-СО-СН2NН2 
 Гем
Гем
4. Витамин В6 участвует в обмене серосодержащих аминокислот


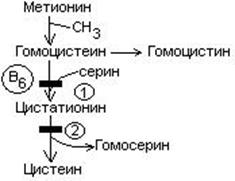
- Витамин В6 участвует в обмене триптофана.
Триптофан
 кинурениназа кинурениназа
| ||
 Кинуреновая кислота
В6 Кинуреновая кислота
В6
|     Кинуренин
1 Кинуренин
1  В6 В6
|  Антраниловая кислота Антраниловая кислота
|
 Ксантуреновая кислота Ксантуреновая кислота
| Оксикинуренин | Оксиантраниловая кислота
|
 Никотинамид Никотинамид
| Хинолиновая кислота |
В6 входит в состав кинурениназы, которая обеспечивает превращение кинуренина в антраниловую и оксикинуринина в оксиантраниловую кислоту (реакция 2).
В6 входит в состав кинуренинтрансаминазы, которая участвует в превращении кинуренина в кинуреновую кислоту и оксикинуренина в ксантурениновую кислоту (реакция 1).
При недостатке витамина В6 повышается экскреция кинуренина и ксантурениновой кислоты и это является ранним биохимическим проявлением недостаточности В6.
Энзимопатии, возникающие при В6 дефиците.
1. Врожденная гомоцистинурия – обусловлена дефектом цистатионсинтазы.
2. Врожденная цистатионурия – связяна с нарушением активности цистатионазы.
3. Наследственная ксантуренурия – дефект кинурениназы.
4. Пиридоксинзависимый судорожный синдром.
5. Пиридоксинзависимая анемия.
Гомоцистинурия – подвывих хрусталика, деформация скелета, негнущаяся походка, «чаплинская» постановка ног, тромбоз.
Цистатионинурия – психические нарушения, тремор, нарушение походки.
Ксантуренурия - нарушения интеллекта, судороги, аллергические проявления, стоматит, глоссит. Лечат введением больших доз витамина В6.
Пиридоксинзависимый судорожный синдром – снижение активности глутаматдекарбоксилазы. Нарушение образования тормозного медиатора - 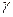 -АМК. Мегадозы В6.
-АМК. Мегадозы В6.
Пиридоксинзависимая анемия – нарушение синтеза гема. Лечат дозами витамина В6.
Обмен витамина Н (биотин).
Биотин (от греч. bios - жизнь), или коэнзим R.
Биотин синтезируется бактериями кишечника. Недостаточность биотина проявляется при употреблении большого количества сырого яичного белка или приема сульфаниламидных антибиотиков, подавляющих рост бактерий в кишечнике.
Биотин входит в состав биотинзависимых ферментов, осуществляющих карбоксилироание, т.е. включение СО2 в органические кислоты.
Тип катализируемой реакции – карбоксилирование.
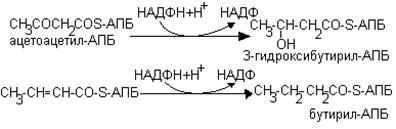
1. Карбоксилирование ацетил-КоА с образованием малонил-КоА
СН3СОSКоА 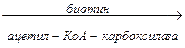 НООС-СН2-СОSКоА
НООС-СН2-СОSКоА
Подготовительным этапом биосинтеза жирных кислот.
2. Карбоксилирование пировиноградной кислоты с образованием ЩУК
СН3СОСООН  НООС-СН2-СО-СООН
НООС-СН2-СО-СООН
С помощью этой реакции пополняется пул дикарбоновых кислот в цикле Кребса. ЩУК является важнейшим условием работы цикла.
Образование ЩУК – начальный этап синтеза глюкозы из лактата и пирувата в процессе глюконеогенеза.
3. Карбоксилирование пропионил-КоА с образованием метилмалонил-КоА:
СН3СН2СОSКоА  НООС-СН(СН3)-СОSКоА
НООС-СН(СН3)-СОSКоА
4. 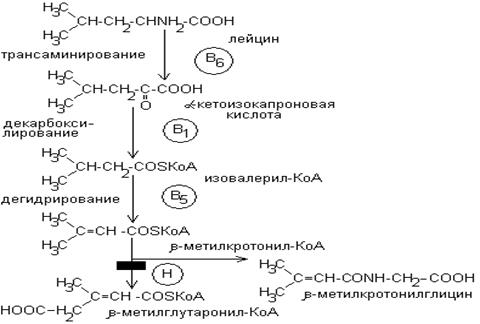
 -метилкротонилглицинемия – рвота, метаболический ацидоз.
-метилкротонилглицинемия – рвота, метаболический ацидоз.
В основе – дефект 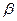 -метилкротонил-КоА-карбоксилазы.
-метилкротонил-КоА-карбоксилазы.
Диагноз – по увеличению концентрации 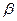 -метилкротонилглицина в моче.
-метилкротонилглицина в моче.
Лечение – биотин.
Пропионил-КоА образуется при расщеплении изолейцина, метионина, треонина, жирных кислот с нечетным числом атомов углерода. Метилмалонил-КоА изомеризуется в янтарную кислоту и это обеспечивает превращение пропионил КоА в ЦТК:
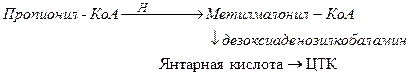
Патология:
Врожденная пропионатацидемия.
В основе заболевания лежит врожденный дефект пропионил-КоА-карбоксилазы, биотинзависимого фермента, катализирующего превращение пропионил-КоА в метилмалонил-КоА. В результате блока накапливается пропионил-КоА и развивается кетоацидоз. Приступы кетоацидоза провоцируются приемом в пищу белка.
Пропионил-КоА у таких больных включается вместо ацетил-КоА в синтез жирных кислот, что приводит к образованию аномальных жирных кислот с нечетным числом атомов углерода.
*Накопление аномальных жирных кислот вызывает тяжелые нейрологические нарушения.
Жирные кислоты с нечетным числом атомов углерода входят в состав миелиновых оболочек нервных стволов и изменяют их проводимость, что вызывет тяжелые нейрологические нарушения.
Пропионатацедемия – обезвоживание, мышечная слабость, коматозное состояние, тяжелый кетоацидоз.
В основе – дефект пропионил-КоА карбоксилазы (в фибробластах 2% от нормы).
Пропионовая кислота образуется при распаде метионина, треонина, изолейцина.
Диагноз – по повышению концентрации пропионовой кислоты в крови и снижению активности фермента в фибробластах.
Лечение – исключение или ограничение белка, иногда введение биотина.







