ѕеримидин €вл€етс€ одним из наиболее активных по отношению к электрофильным агентам гетероциклов, что объ€сн€етс€ его высокой π-донорной способностью и большим отрицательным π-зар€дом в орто-и пара-положени€х нафталинового кольца. »менно по ним и протекают все реакции электрофильного замещени€; до сих пор не известно случаев атаки электрофилами положений 5 и 8. –еакции электрофильного замещени€ в перимидинах очень чувствительны к стерическим помехам со стороны N-заместител€. Ћишь небольшие по размерам частицы (D+, с большим трудом —l+) могут вступать в положени€ 4 и 9 при наличии соседних N-метильных групп.
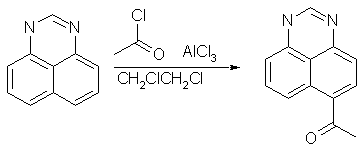
јцилирование
ѕеримидин - единственна€ гетероароматическа€ система с пиридиновым атомом азота, подвергающа€с€ сравнительно легкому ацилированию по ‘риделю Ч рафтсу. јцилирование лучше всего проводить с помощью карбоновых кислот в среде полифосфорной кислоты (ѕ‘ ). ƒл€ соединений с незамещенной группой NH реакци€ имеет €рко выраженный кинетический и термодинамический контроль. ѕри 70Ч85∞ образуетс€ главным образом 6(7)-ацилпроизводное (55Ч85%) нар€ду с небольшим количеством 9-изомера. ѕри 120Ч150∞ единственным продуктом реакции станов€тс€ 4(9)-ацилперимидины. ќдной из причин повышенной устойчивости последних €вл€етс€ наличие в них прочной внутримолекул€рной водородной св€зи.
Ќитрование
¬ зависимости от количества и концентрации азотной кислоты перимидины нитруютс€ (лучше всего в среде уксусной кислоты) до моно-, ди-, три- и тетранитропроизводиых, а ацеперимидины Ч до моно-и динитропроизводиых. ѕервое нитрование перимидинов со свободной группой NH сопровождаетс€ осмолением, что снижает выход. “ак, перимидин нитруетс€ действием 1 мол€ HNO3, образу€ 4(9)- и 6(7)-нитропроизводные в соотношении 2,5: 1 при общем выходе 30%.
√алогенирование
’лорирование перимидинов, сульфурилхлоридом в уксусной кислоте и N-хлорбензотриазолом (’Ѕ“) в апротонной среде. ’лорирование перимидина действием мол€ SO2—l2, приводит к образованию 6(7)- и 4(9)-хлорзамещенных в соотношении 8:1. ѕри действии 2 молей SO2—l2образуетс€ сложна€ смесь моно-, ди-и трихлорперимидинов, а 3 молей SO2—l2 - 4,6,7-трихлорперимидии с высоким выходом. ѕолучить с помощью SO2—l2 тетрахлорперимидин не удалось, но 2-метилперимидин хлорируетс€ избытком SO2—l2 дотетра-хлорпроизводного.
2.2 —интез 7(6)ацетил перимидина исход€ из 1, 8-ƒиаминонафталина
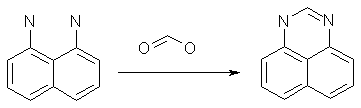
1, 8-ƒиаминонафталин (7,9 г, 0,05 моль) кип€т€т 1 ч с 15 мл муравьиной кислоты. —месь разбавл€ют вдвое водой, кип€т€т 2Ч3 раза с активированным углем, фильтрат охлаждают и нейтрализуют 25%-ным раствором аммиака. ¬ыпавший осадок отфильтровывают, хорошо промывают холодной водой и высушивают на воздухе, размазыва€ его тонким слоем на поверхности стекл€нной пластинки. ¬виду мелкокристалличности перимидина даже хорошо отжатый на фильтре продукт содержит значительное количество воды. ѕри высушивании в сушильном шкафу сырой продукт окисл€етс€. ¬ыход близок к количественному. ѕеримидин представл€ет собой желто-зеленые кристаллы с “пл 224-225Т—
|
|
|
«аключение
»звестно, что пиримидин относитс€ к так называемым π-амфотерным системам, т.е. обладает одновременно свойствами €рко π-избыточных и π-дефицитных соединений. ѕоэтому, пиримидин и его производные способны вступать как в реакции нуклеофильного, так и в реакции электрофильного замещени€. C другой стороны, имеютс€ данные о биологической активности различных производных перимидина. Ќекоторые производные €вл€ютс€ депрессантами и эффективными стимул€торами центральной нервной системы. 2-јминоперимидины обладают противомикробнойактивностью, а 2-ациламиноперимидины Ц фунгицидным действием. “аким образом, продолжение изучени€ реакционной способности пиримидина и синтез новых функциональных производных этого гетероцикла €вл€етс€ весьма перспективным и полезным направлением. ѕрактическа€ часть курсовой работы состо€ла в получении 7(6)ацетил пиримидина, €вл€ющемс€ ценным реагентом дл€ органического синтеза. Ќа первой стадии синтеза дл€ получени€ чистого пиримидина важную роль играет предварительна€ перегонка 1-8нафталиндиамина, так как перимидин плохо поддаетс€ перекристаллизации. Ѕыл получен пиримидин, пригодный дл€ дальнейшего использовани€. ¬ыход составил 99% от теоретического. ¬тора€ стади€ - ацилирование по ‘риделю- рафтсу важно не допустить попадани€ в реакционную смесь даже следов воды, дл€ этого примен€лась хлоркальциева€ трубка. ¬ыход ацетил пиримидина составил 60% или 0,756 г. потери св€занны с частичной растворимостью соединени€ в воде.
—писок литературы
1. ѕожарский ј. ‘., јнисимова ¬. ј., ÷упак ≈. Ѕ. ѕрактические работы по химии гетероциклов // »зд-во –√”. - 1988. - 158 с.
2. ƒальниковска€ ¬. ¬., омиссаров ». ¬., ѕожарский ј. ‘., ‘илиппов ». “. ѕеримидины // ’им.-фарм. журнал, 1978, є 7, —. 85.
3. ”спехи химии 1981 выпуск 9 с.1559-1594
4. Ћ. ѕакетт ќсновы современной химии гетероциклических соединений »зд-во мир Ц 1968 с.97-134.
5. ј.≈.јгрономов ё.—. Ўабаров Ћабораторные работы в органическом практикуме ћ. ’ими€ 1974.
6. ¬.». »вановский ’ими€ гетероциклических соединений ћ ¬ысша€ школа 1978.
7. ј.ј. ѕотехина —войства органических соединений Ћ. ’ими€ 1984.
8. ƒж. ƒжоуль . ћилс ’ими€ гетероциклических соединений ћ ћир 2004.
9. ».». √рандберг ќрганическа€ хими€ ƒрофа 2002 ј.Ќ.Ќесме€нов Ќ.ј. Ќесме€нов Ќачала органической химии ћ 1969.






