1. Записать схему реакции, которую требуется уравнять:
Na2SO3 + KJO3 + H2SO4 → Na2SO4 + J2 + K2SO4 + H2O
2. Определить степени окисления всех атомов, участвующих в реакции. Найти элементы, меняющие степень окисления и определить, в состав каких молекул или ионов они входят:
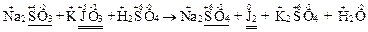
3. Определить характер среды и составить схемы полуреакций окисления и восстановления. Определить число электронов, участвующих в полуреакциях. Для них найти наименьшее общее кратное и дополнительные множители (коэффициенты) для каждой полуреакции:
Среда кислая, т.к. одно из исходных веществ – серная кислота.

4. Сложить уравнения полуреакций с учетом дополнительных множителей и получить сокращенное ионное уравнение реакции. Электроны при этом сокращаются:

Одинаковые ионы в левой и правой частях можно сократить:

5. Каждый ион дополнить таким количеством соответствующих противоионов, чтобы в сумме они образовали нейтральные молекулы веществ из уравниваемой реакции.
Число противоионов, добавленных в левой и правой частях, должно быть одинаковым. Недостающие ионы необходимо прибавить отдельно:
В правой части не хватает ионов 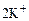 и
и  , их необходимо добавить отдельно:
, их необходимо добавить отдельно:

6. Составить молекулярное уравнение, объединив соответствующие ионы в молекулы, и расставить в нем коэффициенты:
2KJO3 +5Na2SO3 + H2SO4 = J2 + 5Na2SO4 + K2SO4 + H2O
Типы окислительно-восстановительных реакций
1. Межмолекулярные – ОВР, в которыхокислитель и восстановитель находятся в разных молекулах:

В данной реакции 2 молекулы азотной кислоты идут на восстановление до NO, а еще 6 – на связывание трех ионов меди. Поэтому общий коэффициент перед азотной кислотой равен 8:
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
2. Внутримолекулярные – ОВР, в которых окислитель и восстановитель находятся в одной молекуле.

3. Реакции диспропорционирования – ОВР, в которых окислителем и восстановителем является одна и та же частица.
а) Дисмутация – одна часть атомов восстанавливается, а другая часть тех же атомов окисляется:

б) Коммутация – разные вещества, содержащие атомы одного элемента в разных степенях окисления, превращаются в одно и то же вещество:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы:
Познакомиться с типами окислительно-восстановительных реакций. Изучить окислительно-восстановительные свойства некоторых веществ. Освоить методы уравнивания ОВР.
Оборудование и реактивы:
Растворы: йода J2 (спиртовый), сульфита натрия Na2SO3 (0,5н), дихромата калия K2Cr2O7 (0,5н), серной кислоты H2SO4 (2н), сульфата марганца(II) (0,5н), пероксида водорода H2O2 (3 %), перманганата калия KMnO4 (0,5н), гидроксида калия KOH (2н). Дихромат аммония (NH4)2Cr2O7 (тв.). Перманганат калия KMnO4 (тв.). Серная кислота H2SO4 (конц.). Вода.
Асбестированная сетка. Фарфоровая чашка. Пипетка. Стеклянная палочка. Спиртовка. Спички. Пробирки.
Опыт № 1. Восстановительные свойства сульфитов
В первую пробирку налить 1 мл водного раствора йода.
Во вторую налить 1 мл раствора дихромата калия и подкислить несколькими каплями разбавленной серной кислоты.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить изменение окраски раствора в обеих пробирках.
þ Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + J2 + H2O → Na2SO4 + HJ
б) Na2SO3 + K2Cr2O7 + H2SO4 → Na2SO4 + Cr2(SO4)3 + K2SO4 + H2O
2. Записать наблюдаемые явления.
3. Какая частица выполняет роль окислителя в каждом случае?
Опыт № 2. Окислительно-восстановительные свойства пероксида водорода и соединений марганца
В первую пробирку налить 1 мл раствора перманганата калия и подкислить его несколькими каплями разбавленной серной кислоты.
Во второй пробирке ионообменной реакцией получить нерастворимый гидроксид марганца(II).
В каждую пробирку добавить по 1 мл раствора пероксида водорода.
Отметить наблюдаемые изменения.
þ Запись результатов опыта:
1. Написать реакцию образования гидроксида марганца в ионной и молекулярной формах.
2. Расставить коэффициенты методом электронного баланса. Обозначить окислители и восстановители:
а) H2O2 + KMnO4 + H2SO4 → O2 + MnSO4 + K2SO4 + H2O
б) Mn(OH)2 + H2O2 → MnO2 + H2O
3. Написать реакцию разложения пероксида водорода, катализатором для которой является образующийся диоксид марганца. При этом образуется два вещества, в которых кислород проявляет степени окисления -2 и 0.
4. Почему пероксид водорода способен проявлять и окислительные, и восстановительные свойства?
5. Какие свойства – окислительные или восстановительные – могут проявлять соединения марганца KMnO4, MnO2 и Mn(OH)2? Ответ пояснить.
Опыт № 3. Влияние рН среды на окислительную способность перманганат-иона
В три пробирки налить по 1 мл раствора перманганата калия.
В первую добавить несколько капель разбавленной серной кислоты.
Вторую оставить без изменений.
В третью добавить несколько капель раствора гидроксида калия.
В каждую пробирку добавить по 1 мл раствора сульфита натрия. Отметить различные признаки реакции во всех пробирках.
þ Запись результатов опыта:
1. Расставить коэффициенты методом полуреакций:
а) Na2SO3 + KMnO4 + H2SO4 → Na2SO4 + MnSO4 + K2SO4 + H2O
б) Na2SO3 + KMnO4 + H2O → Na2SO4 + MnO2 + KOH
в) Na2SO3 + KMnO4 + KOH → Na2SO4 + K2MnO4 + H2O
2. Описать наблюдаемые явления в каждой пробирке.
3. В какой среде восстановление перманганат-иона протекает наиболее полно? Как рН среды влияет на окислительные способности окислителей?
Опыт № 4. Типы окислительно-восстановительных реакций
а) Взаимодействие перманганата калия с сульфатом марганца
В пробирку налить 1 мл раствора перманганата калия и добавить 1 мл раствора сульфата марганца.
Что наблюдается?
б) Взаимодействие йода с раствором щелочи
В пробирку налить 1 мл раствора йода. Прилить равный объем раствора гидроксида калия. Отметить изменение окраски.
в) Термическое разложение дихромата аммония («Вулкан»). ДЕМОНСТРАЦИОННЫЙ.






