ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Окислительно-восстановительные реакции – это реакции, протекающие с изменением степени окисления.
Степень окисления (СтО) – это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Степень окисления может быть положительной, отрицательной или нулевой. Атомы одного и того же элемента в разных соединениях проявляют различные степени окисления.
Степень окисления показывает, сколько электронов смещено от атома данного элемента (положительная степень окисления) или к атому данного элемента (отрицательная степень окисления). Смещение электронов происходит к наиболее электроотрицательному элементу.
Нулевую степень окисления имеют атомы в молекулах простых веществ (образованных атомами одного элемента). В них элементы имеют абсолютно одинаковые электроотрицательности и электроны не смещаются ни к одному из атомов.
Правила определения степени окисления
1. Существуют элементы, проявляющие во всех молекулах сложных веществ постоянную степень окисления:
– Элементы І группы главной подгруппы (щелочные металлы): Li+, Na+, K+, Rb+, Cs+, а также Ag+;
– Водород Н+ (кроме гидридов металлов  )
)
– Элементы ІІ группы главной подгруппы (щелочно-земельные металлы): Be+2, Mg+2, Ca+2, Sr+2, Ba+2; а также Zn+2;
–Элементы ІІІ группы главной подгруппы: B+3, Al+3;
– Кислород О-2, кроме пероксидов ( ,
,  ,
,  ), надпероксидов
), надпероксидов  , озонидов
, озонидов  и фторида кислорода
и фторида кислорода  .
.
2. Высшая степень окисления элемента равна номеру группы элемента (N) в таблице Менделеева. СтО max = N:
Cl+7(VII гр.), S+6(VI гр.), N+5(V гр.), Mn+7(VII гр.), Cu+2(II гр.).
Низшая степень окисления элемента равна: СтО min = N – 8:
Cl–(VII гр.), S–2(VI гр.), N–3(V гр.), C–4(IV гр.).
3. Степени окисления элементов в сложных веществах определяются, исходя из правила: сумма степеней окисления всех атомов в молекуле равна нулю, в ионе – заряду иона.
Пример: В молекуле дихромата калия K2Cr2O7 степени окисления калия и кислорода постоянны: К+, О‑2; степень окисления хрома является переменной, ее необходимо определить.
Так как сумма всех степеней окисления в молекуле равна нулю, можно составить уравнение, обозначив степень окисления хрома за х:
2(+1) + 2 х + 7(-2) = 0,
откуда х = 6.
Степень окисления хрома равна +6: 
Окисление – процесс отдачи электронов атомом, молекулой или ионом.
Частицы, отдающие электроны – восстановители.
В процессе окисления степень окисления восстановителя повышается.
Восстановление – процесс присоединения электронов атомом, молекулой или ионом.
Частицы, принимающие электроны – окислители.
В процессе восстановления степень окисления окислителя понижается.
Процесс передачи электронов от восстановителя к окислителю подчиняется правилу электронного баланса: число электронов отданных восстановителем всегда равно числу электронов принятых окислителем.
Существует два метода составления уравнений окислительно-восстановительных реакций: метод электронного баланса и метод полуреакций (ионно-электронный метод).
Метод электронного баланса
1. Записать схему реакции, которую требуется уравнять:
KMnO4 + KJ + H2SO4 → J2 + MnSO4 + K2SO4 + H2O
2. Определить степени окисления всех атомов, участвующих в реакции. Выявить элементы, меняющие степень окисления:
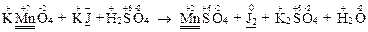
3. Составить схему электронного баланса, подставляя в нее то количество атомов окислителя и восстановителя, которое имеется в исходной реакции.
Число электронов, принятых окислителем, равно числу электронов, отданных восстановителем. Найти наименьшее общее кратное для числа электронов и дополнительные множители, которые становятся коэффициентами при окислителе и восстановителе:

4. Расставить коэффициенты перед окислителем и восстановителем в левой части, перед восстановленной и окисленной формами в правой части схемы (необходимо учитывать удвоенное число атомов в схеме электронного баланса):
2KMnO4 + 10KJ + H2SO4 → 5J2 + 2MnSO4 + K2SO4 + H2O
5. Уравнять атомы металлов, не меняющих степень окисления.
В левой части 12 атомов K, следовательно, в правой части перед K2SO4, содержащим 2 атома K, ставится коэффициент 6:
2KMnO4 + 10KJ + H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + H2O
6. Уравнять кислотные остатки.
В правой части 8 ионов  , поэтому перед H2SO4 ставится коэффициент 8:
, поэтому перед H2SO4 ставится коэффициент 8:
2KMnO4 + 10KJ + 8H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + H2O
7. Уравнять атомы водорода.
В левой части 16 атомов водорода, поэтому перед H2O необходимо поставить коэффициент 8:
2KMnO4 + 10KJ + 8H2SO4 → 5J2 + 2MnSO4 + 6K2SO4 + 8H2O
8. Проверить правильность подбора коэффициентов, подсчитав число атомов кислорода в обеих частях уравнения:
В левой части: 2·4 + 8·4 = 40. В правой части: 2·4 + 6·4 + 8 = 40. Коэффициенты расставлены верно.
Метод полуреакций (ионно-электронный метод)
Этот метод применяют при составлении уравнений окислительно-восстановительных реакций, протекающих в растворе. При этом рассматривают не отдельные атомы, а ионы или молекулы в том виде, в каком они существуют в растворе: неэлектролиты, слабые электролиты и малорастворимые вещества записывают в молекулярном виде, а сильные электролиты – в виде ионов.
В исходных ионах или молекулах может быть избыток или недостаток атомов кислорода по сравнению с образовавшимися частицами. Перенос этих атомов осуществляется при помощи катионов водорода 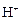 , гидроксид-ионов
, гидроксид-ионов  или молекул воды Н2О (в зависимости от характера среды, в которой протекает данная реакция).
или молекул воды Н2О (в зависимости от характера среды, в которой протекает данная реакция).






