При опреснении воды методом обратного осмоса пресную воду отделяют от растворенных в ней солей при помощи мембраны, проницаемой для воды, но непроницаемой для солей. Для этого необходимо наличие селективной мембраны, пропускающей только воду, но задерживающей растворенные в ней вещества. Если поместить такую мембрану между рассолом и пресной водой, тенденция к выравниванию концентраций по обе стороны мембраны заставит воду проникать через мембрану в рассол. Этому процессу можно воспрепятствовать, прикладывая давление со стороны рассола. При достаточно большом давлении проникновение воды через мембрану в рассол прекратится. Давление, необходимое, чтобы воспрепятствовать просачиванию воды через мембрану в раствор, называется осмотическим. Для морской воды при нормальных условиях осмотическое давление составляет приблизительно 25 атм.
Если прикладываемое к рассолу давление превысит осмотическое, то вода будет проходить через мембрану в обратном направлении, другими словами, пресная вода будет выдавливаться из рассола через мембрану. Достоинства: · высокое качество воды по взвесям, биологическим и органическим загрязнениям;· минимальные количество реагентов и суммарный сброс солей в окружающую среду;· возможность сброса концентрата без обработки в канализацию;· относительно низкие эксплуатационные затраты;· отсутствие агрессивных реагентов и необходимости их обработки.
Недостатки: - необходимость тщательной предподготовки;· желательность непрерывной работы обратноосмотической установки;· большие капитальные затраты;· большой расход питающей воды и объем сбросных вод;· большие энергозатраты.
3)Жесткость и щелочность природных вод, единицы измерения.
Щелочностью воды называется общее содержание в ней веществ, обуславливающих при диссоциации или в результате гидролиза повышенную концентрацию ионов ОН. Общей щелочностью воды Що называется выраженная в  суммарная концентрация содержащихся в воде анионов ОН, НСО3,СО3, РО4, НSiО3, SiO3 и некоторых солей слабых органических кислот (гуматов).Так как все перечисленные вещества реагируют с кислотой, то общая щёлочность воды определяется количеством кислоты, затраченной на титрование с индикатором метилоранжем. В природных водах щёлочность обуславливается обычно присутствием бикарбонатов, гидратов и гуматов. В зависимости от анионов, обуславливающих щёлочность, различают: а) гидратную щелочность Щг, обусловленную концентрацией в воде гидроксильных ионов ОН; б) карбонатную щелочность Щк, обусловленную концентрацией в воде карбонатных ионов СО3; в) бикарбонатную щелочность Щб, обусловленную концентрацией бикарбонатных ионов НСО3.
суммарная концентрация содержащихся в воде анионов ОН, НСО3,СО3, РО4, НSiО3, SiO3 и некоторых солей слабых органических кислот (гуматов).Так как все перечисленные вещества реагируют с кислотой, то общая щёлочность воды определяется количеством кислоты, затраченной на титрование с индикатором метилоранжем. В природных водах щёлочность обуславливается обычно присутствием бикарбонатов, гидратов и гуматов. В зависимости от анионов, обуславливающих щёлочность, различают: а) гидратную щелочность Щг, обусловленную концентрацией в воде гидроксильных ионов ОН; б) карбонатную щелочность Щк, обусловленную концентрацией в воде карбонатных ионов СО3; в) бикарбонатную щелочность Щб, обусловленную концентрацией бикарбонатных ионов НСО3.
В простейшем случае при отсутствии в воде фосфатного и других анионов слабых кислот, кроме карбонатного, гидроксильного или бикарбонатного, общая щёлочность воды может состоять только из гидратной щёлочности; из суммы гидратной и карбонатной щелочностей; только из карбонатной щелочности; из суммы карбонатной и бикарбонатной щелочностей; только из бикарбонатной щёлочности.
Общая жёсткость воды Жо равна сумме концентраций в ней катионов кальция (кальциевая жёсткость Жca) и магния (магниевая жёсткость Жmg) и выражается в миллиграмм-эквивалентах на килограмм или грамм-эквивалентах на тонну при измерении больших жёсткостей и в микрограмм-эквивалентах на килограмм при измерении малых жёсткостей.
Для пересчёта выраженных в мг на кг концентраций кальция и магния в мг экв деленный на кг их делят на эквивалентные веса этих катионов, т.е.

где: Сса и Сmg – концентрация в воде катионов кальция и магния,;
20,04 и 12,16 – эквивалентные веса кальция и магния.
Общая жёсткость воды подразделяется на карбонатную и некарбонатную.
Карбонатная жёсткость воды Жк в основном обуславливается присутствием в воде бикарбонатов кальция и магния Ca(HCO3)2 и Mg(HCO3)2, так как CaCO3 и MgCO3 малорастворимы в воде.
Некарбонатная жёсткость воды Жнк обуславливается наличием в воде хлоридов,сульфатов и других некарбонатных солей кальция и магния: CaCl2 и MgCl2, CaSO4, MgSO4, CaSiO3, MgSiO и другие.
Таким образом, общая жёсткость воды равна сумме кальциевой и магниевой жесткостей, с одной стороны, и сумме карбонатной и некарбонатной жесткостей с другой.
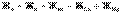
По величине общей жёсткости природных вод установлена следующая классификация:
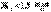 – малая жёсткость;
– малая жёсткость;
 – средняя;
– средняя;
 – повышенная;
– повышенная;
 – высокая;
– высокая;
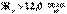 – очень высокая.
– очень высокая.
Билет №32






