Покажите, что изохорный, изотермический и адиабатные процессы являются частными случаями политропного процесса.
Процесс идеального газа, в котором теплоемкость является постоянной называется политропным, а линия процесс - политропой. Из определения политропного процесса следует, что основные термодинамические процессы - изохорный, изобарный, изотермический и адиабатный, если они протекают при постоянной теплоемкости, являются частными случаями политропного процесса.
Теплоемкость политропного процесса  может принимать самые разнообразные положительные и отрицательные значения от
может принимать самые разнообразные положительные и отрицательные значения от 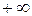 до
до 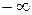 .
.
Количество теплоты, участвующее в политропном процессе. может быть выражено произведением теплоемкости процесса 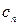 на разность температур
на разность температур  в конечном и начальном состояниях:
в конечном и начальном состояниях:
 и
и  (1)
(1)
Уравнение политропного процесса выводится на основании уравнения первого закона термодинамики:
 и
и 
Из этих уравнений найдем
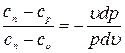
Обозначив выражение левой части уравнения через  , получим
, получим
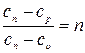 и
и 
Интегрируя полученное соотношение в пределах от начала до конца процесса, находим
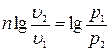
или
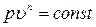 (1)
(1)
Полученное уравнение является уравнением политропного процесса.
Показатель политропы  принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных
принимает для каждого процесса определенное числовое значение. Для основных процессов: изохорных  , изотермических
, изотермических  и адиабатных
и адиабатных  .
.
Изобразите в диаграммах РV и TS процесс парообразования для водяного пара и объясните характерные области, линии и точки, нанесенные на них.
Фазовая  - диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов воды и пара от давления.
- диаграмма системы, состоящей из жидкости и пара, представляет собой график зависимости удельных объемов воды и пара от давления.
Пусть вода, масса которой 1  при температуре
при температуре  и некотором давлении
и некотором давлении 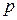 , занимает объем
, занимает объем 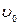 (отрезок
(отрезок  ) (рис.1).
) (рис.1).

Рисунок 1
Вся кривая  выражает зависимость удельного объема воды от давления при температуре
выражает зависимость удельного объема воды от давления при температуре  . Так как вода - вещество почти несжимаемое, то кривая
. Так как вода - вещество почти несжимаемое, то кривая  почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то ее температура будет повышаться и удельный объем увеличиваться. При некоторой температуре
почти параллельна оси ординат. Если при постоянном давлении сообщать воде теплоту, то ее температура будет повышаться и удельный объем увеличиваться. При некоторой температуре 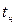 вода закипает, а ее удельный объем
вода закипает, а ее удельный объем 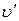 в точке
в точке 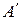 достигнет при данном давлении максимального значения. С увеличением давления растет температура кипящей жидкости
достигнет при данном давлении максимального значения. С увеличением давления растет температура кипящей жидкости 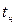 и объем
и объем 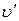 также увеличивается.
также увеличивается.
График зависимости 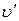 от давления представлен на рис.1 кривой
от давления представлен на рис.1 кривой  , которая называется пограничной кривой жидкости. Характеристикой кривой
, которая называется пограничной кривой жидкости. Характеристикой кривой  является степень сухости
является степень сухости  [1]. В случае дальнейшего подвода теплоты при постоянном давлении начнется процесс парообразования. При этом количество воды будет уменьшаться, количество пара увеличиваться. В момент окончания парообразования в точке
[1]. В случае дальнейшего подвода теплоты при постоянном давлении начнется процесс парообразования. При этом количество воды будет уменьшаться, количество пара увеличиваться. В момент окончания парообразования в точке 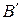 пар будет сухим насыщенным. Удельный объем сухого насыщенного пара обозначается
пар будет сухим насыщенным. Удельный объем сухого насыщенного пара обозначается 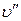 .
.
Если процесс парообразования протекает при постоянном давлении, то температура его не изменяется и процесс  является одновременно изобарным и изотермным. В точках
является одновременно изобарным и изотермным. В точках 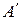 и
и 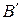 вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь тел называют двухфазной системой.
вещество находится в однофазном состоянии. В промежуточных точках вещество состоит из смеси воды и пара. Такую смесь тел называют двухфазной системой.
График зависимости удельного объема 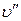 от давления представлен на рис.1 кривой
от давления представлен на рис.1 кривой  , которая называется пограничной кривой пара. Характеристикой кривой
, которая называется пограничной кривой пара. Характеристикой кривой  является степень сухости
является степень сухости  .
.
Точка 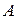 соответствует состоянию кипящей жидкости в тройной точке
соответствует состоянию кипящей жидкости в тройной точке  , а изобара
, а изобара  соответствует состояниям равновесия всех трех фаз (тройная тока на
соответствует состояниям равновесия всех трех фаз (тройная тока на  - диаграмме). Эта изобара при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
- диаграмме). Эта изобара при выбранном масштабе изображения кривых практически совпадает с осью абсцисс.
Если к сухому насыщенному пару подводить теплоту при постоянном давлении, то температура и объем его будут увеличиваться и пар из сухого насыщенного перейдет в перегретый (точка 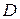 ).
).
Обе кривые 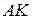 и
и  делят диаграмму на 3 части. Влево от пограничной кривой жидкости
делят диаграмму на 3 части. Влево от пограничной кривой жидкости 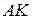 до нулевой изотермы располагается область жидкости. Между кривыми
до нулевой изотермы располагается область жидкости. Между кривыми 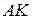 и
и  располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от
располагается двухфазная система, состоящая из смеси воды и сухого пара. Вправо от  и вверх от точки
и вверх от точки 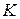 располагается область перегретого пара или газообразного состояния тела. Обе кривые
располагается область перегретого пара или газообразного состояния тела. Обе кривые 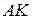 и
и  сходятся в одной точке
сходятся в одной точке 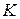 , которая называется критической точкой.
, которая называется критической точкой.
Критическая точка является конечной точкой фазового перехода жидкость - пар, начинающейся в тройной точке. Выше критической точки существование вещества в двухфазном состоянии невозможно. Никаким давлением нельзя перевести газ в жидкое состояние при температурах выше критической.
Область, заключенная между изотермой воды при температуре  (линия
(линия  ) и осью ординат, представляет собой область равновесного сосуществования жидкой и твердой фаз.
) и осью ординат, представляет собой область равновесного сосуществования жидкой и твердой фаз.
Графически на 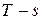 - диаграмме произвольный процесс нагрева жидкости, парообразования и перегрева пара при постоянном давлении изображается кривой
- диаграмме произвольный процесс нагрева жидкости, парообразования и перегрева пара при постоянном давлении изображается кривой  (рис.2).
(рис.2).
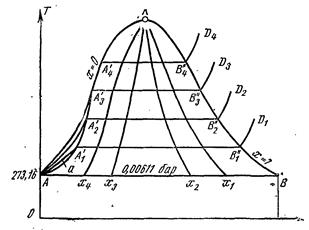
Рисунок 2
Если нанести на диаграмме ряд таких изобарных процессов и соединить характерные точки, то получим пограничные кривые кипящей жидкости 
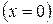 и сухого пара
и сухого пара 
 , которые сходятся в критической точке. На диаграмме нанесена изобара, соответствующая давлению в тройной точке, где
, которые сходятся в критической точке. На диаграмме нанесена изобара, соответствующая давлению в тройной точке, где 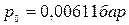 .
.
Пограничная кривая жидкости выходит из оси ординат при температуре  , так как, по определению, в тройной точке энтропия жидкости равна нулю. Следует отметить, что ввиду аномальности воды (максимальная плотность при
, так как, по определению, в тройной точке энтропия жидкости равна нулю. Следует отметить, что ввиду аномальности воды (максимальная плотность при  ) вблизи точки
) вблизи точки 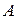 изобары жидкости имеют сложное строение, что, однако, мало сказывается на практических расчетах. Поэтому на рис.2 для упрощения изобары в области жидкости даны, как для нормальной жидкости.
изобары жидкости имеют сложное строение, что, однако, мало сказывается на практических расчетах. Поэтому на рис.2 для упрощения изобары в области жидкости даны, как для нормальной жидкости.
Пограничные кривые делят диаграмму на 3 части: влево от  располагается область жидкости, между кривыми
располагается область жидкости, между кривыми  и
и  - область влажного пара, вправо от
- область влажного пара, вправо от  и вверх от точки
и вверх от точки  - область перегретого пара. В области жидкости процесс нагрева 1
- область перегретого пара. В области жидкости процесс нагрева 1  воды от температуры
воды от температуры  до температуры кипения происходит по изобаре
до температуры кипения происходит по изобаре  , которая практически сливается с пограничной кривой жидкости.
, которая практически сливается с пограничной кривой жидкости.
На диаграмму наносят изобары, линии постоянных удельных объемов, а в области влажного пара - линии равных степеней сухости, в этой области влажного пара - линии равных степеней сухости, в этой области изобары представляют собой прямые линии, параллельные оси абсцисс, а в области перегретого пара - кривые линии  . Область диаграммы, лежащая ниже изобары тройной точки, изображает состояния смеси «пар + лед».
. Область диаграммы, лежащая ниже изобары тройной точки, изображает состояния смеси «пар + лед».
На 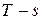 - диаграмме площадь, заключенная между линией обратимого процесса и осью абсцисс, изображает количество теплоты, сообщаемой 1 кг рабочего тела, равное
- диаграмме площадь, заключенная между линией обратимого процесса и осью абсцисс, изображает количество теплоты, сообщаемой 1 кг рабочего тела, равное 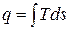 .
.






