Набухание - способность ионита увеличивать свой объем при погружении в воду. Оно приводит к растяжению пространственной сетки и проникновению диполей воды внутрь зерна ионита. Набухание характеризуется коэффициентом набухания, который представляет собой отношение удельных объемов набухшей и сухой смолы.
Полная обменная емкость смолы (ПОЕ) - максимальное количество ионов металла, поглощенное смолой. Ее значение индивидуально для данной смолы и определяется в статических или динамических условиях.
Статическая (равновесная) емкость (СОЕ) - емкость смолы при достижении равновесия в статических условиях с раствором определенного объема и состава. Если менять объем и состав раствора, то будет меняться и емкость. Следовательно, СОЕ - величина непостоянная.
Динамическая (рабочая) обменная емкость (ДОЕ) – количество ионов, поглощенное смолой при фильтрации раствора через слой смолы до проскока поглощаемого иона. Это тоже непостоянная величина и зависит от скорости пропускания раствора через смолу, величины зерен смолы и состава раствора. Рабочую емкость определяют графически по выходной кривой (рис. 1). Площадь, ограниченная выходной кривой и осями координат (S1 + S2), является полной динамической обменной емкостью (ПДОЕ). Площадь S1 соответствует рабочей емкости или емкости до проскока.
Процесс десорбции поглощенного смолой иона называют элюированием. Его характеризуют кривой элюирования (рис. 2). Если смола достаточно «нагружена», то после элюирования получают элюаты с концентрацией металла в сто и более раз выше, чем в исходных растворах.
 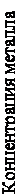  |
Рисунок 1 – Выходная кривая Рисунок 2 – Выходная кривая сорбции элюирования
Кинетика ионного обмена
Принципиальное отличие кинетики ионного обмена от кинетики выщелачивания состоит в следующем:
1. Отсутствует химическое взаимодействие между фиксированными ионами и противоионами. Поэтому химической стадии как таковой нет.
2. Коионы раствора не могут присутствовать во внутреннем объеме ионита. Это явление называется принципом «исключения коионов».
3. Во внутреннем объеме ионита при диффузии отдаваемых и поглощаемых противоионов, протекающей в двух противоположных направлениях, устанавливается единый коэффициент взаимодиффузии. Это вытекает из требования электронейтральности. Поэтому стадия внутренней диффузии двух противоионов объединяется в одну.
4. Диффузия выходящего из ионита противоиона в объем раствора сквозь его пограничный слой оказывает значительно меньшее влияние на скорость ионного обмена, чем диффузия входящего противоиона.
Таким образом, ионный обмен характеризуется тремя стадиями:
- диффузия поглощаемого ионитом противоиона из внутреннего объема к поверхности раздела ионит-раствор через пленку раствора, примыкающего к иониту.
- диффузия обменивающихся противоионов во внутреннем объеме ионита с единым коэффициентом взаимодиффузии.
- диффузия вытесняемого из ионита противоиона от поверхности раздела в объем раствора через пленку, примыкающую к иониту.
Поэтому скорость ионного обмена лимитируется либо скоростью диффузии через пленку жидкости, примыкающей к поверхности ионита (т.е. пленочной кинетикой), либо скоростью диффузии во внутреннем объеме ионита (т.е. гелевой кинетикой). В некоторых случаях обе стадии одновременно могут лимитировать процесс.
Простым и надежным способом определения лимитирующей стадии ионообменного процесса является метод прерывания процесса. Если после прерывания кинетическая кривая поглощения не имеет перегиба, то лимитирует пленочная кинетика. Если же после прерывания начальная скорость обмена оказывается выше, чем скорость до прерывания, то лимитирует гелиевая кинетика (рис.).

Рисунок – Кинетические кривые при гелевой и пленочной кинетике в случае прерывания ионного обмена




