«Химическая термодинамика»
1. Рассчитайте  химической реакции
химической реакции
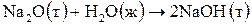
по значениям стандартных энтальпий образования веществ  (прил. 2). Укажите тип реакции (экзо- или эндотермическая).
(прил. 2). Укажите тип реакции (экзо- или эндотермическая).
Р е ш е н и е:
По данным (прил. 1), стандартные энтальпии образования 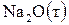 ,
, 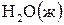 и
и  при 298 К равны соответственно –416, –286
при 298 К равны соответственно –416, –286
и –427,8 кДж/моль. Используя следствие закона Гесса, рассчитываем  химической реакции:
химической реакции:
∆ Н 0х.р = 2∆ Н 0 f (NaOH) – [∆ Н 0 f (Na2O) + Н 0 f (Н2О)]
2(–427,8) – [–416 + (–286)] = –153,6 кДж.
Реакция является экзотермической, так как  < 0.
< 0.
Ответ: –153,6 кДж.
2. Определите, как изменяется энтропия при протекании химического процесса  .
.
Р е ш е н и е:
В данном процессе при взаимодействии 1 моля кристаллического и
1 моля жидкого вещества образуются 2 моля кристаллического вещества, следовательно, система переходит в состояние с меньшим беспорядком
и энтропия уменьшается (D S < 0).
Ответ: уменьшается.
3. Рассчитайте величину 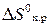 для процесса
для процесса
 ,
,
используя значения стандартных энтропий веществ.
Р е ш е н и е:
Используя справочные данные  ,
,
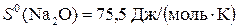 ,
,  ,
,
рассчитываем  :
:
∆ S 0298 = 2∙ S 0(NаОH) – [ S 0(Na2O) + S 0(H2O)] =
2∙64,16 – (75,5 + 70) = –17,18 Дж/К.
Ответ: энтропия уменьшается.  = –17,18 Дж/К.
= –17,18 Дж/К.
4. Рассчитайте изменение энергии Гиббса ( ) для процесса
) для процесса  по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
Р е ш е н и е:
При стандартных условиях ( )
)  можно рассчитать как разность суммарной энергии Гиббса образования продуктов реакции
можно рассчитать как разность суммарной энергии Гиббса образования продуктов реакции
и суммарной энергии Гиббса образования исходных веществ, с учетом стехиометрических коэффициентов.
Необходимые справочные данные:  .
.
∆ G 0 f (Na2O) = –378 кДж/моль, ∆ G 0 f (H2O) = – 237 кДж/моль
∆ G 0298 = 2∙∆ G 0 f (NaOH) – [∆ G 0 f (Na2O) + ∆ G 0 f (H2O)] =
= 2∙(–381,1) – [–378 + (–237)] = –147,2 кДж.
Значение  отрицательно, поэтому самопроизвольное протекание реакции возможно в прямом направлении.
отрицательно, поэтому самопроизвольное протекание реакции возможно в прямом направлении.
Ответ: возможно; –147,2 кДж.
5. Определите, возможно ли при 95oС самопроизвольное протекание процесса  . Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
. Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
Р е ш е н и е:
Переведем температуру в шкалу Кельвина:  . Для расчета D G 0368 воспользуемся уравнением
. Для расчета D G 0368 воспользуемся уравнением 
Используем изменения энтальпии и энтропии, рассчитанные для данного процесса в предыдущих задачах. При этом величину изменения энтропии необходимо перевести из Дж/К в кДж/К, поскольку значения  и
и  обычно измеряют в кДж, т. е.
обычно измеряют в кДж, т. е. 

Таким образом, 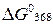 < 0, поэтому самопроизвольное протекание данного процесса при 95 oС возможно.
< 0, поэтому самопроизвольное протекание данного процесса при 95 oС возможно.
Ответ: возможно; –147,3 кДж.
6. Составьте термохимическое уравнение реакции взаимодействия 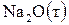 и
и 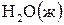 , если при этом образуется 1 моль
, если при этом образуется 1 моль  . В ответе приведите количество теплоты (Q), указанное в термохимическом уравнении.
. В ответе приведите количество теплоты (Q), указанное в термохимическом уравнении.
Р е ш е н и е:
Коэффициенты в термохимическом уравнении имеют смысл молей. Поэтому допустимы дробные значения коэффициентов и 1 моль гидроксида натрия может образоваться из 1/2 моля оксида натрия и 1/2 моля воды.
В результате расчета выяснено, что при образовании 2 молей 
в данной реакции выделяется 153,6 кДж теплоты, 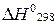 = –153,6 кДж. Поэтому при образовании 1 моль
= –153,6 кДж. Поэтому при образовании 1 моль  количество выделившейся теплоты будет в 2 раза меньше, т. е. 76,8 кДж. В термохимическом уравнении количество выделяющейся теплоты указывают со знаком «плюс»:
количество выделившейся теплоты будет в 2 раза меньше, т. е. 76,8 кДж. В термохимическом уравнении количество выделяющейся теплоты указывают со знаком «плюс»: 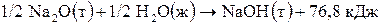 .
.
Ответ: Q = +76,8 кДж.
Задания для самоконтроля
1. Рассчитайте  химической реакции
химической реакции
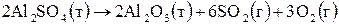
по значениям стандартных теплот образования веществ. Укажите тип реакции (экзо- или эндотермическая).
2. Рассчитайте 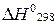 химической реакции
химической реакции

по значениям стандартных теплот образования веществ. Укажите тип реакции (экзо- или эндотермическая).
3. Рассчитайте 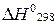 химической реакции
химической реакции

по значениям стандартных теплот образования веществ. Укажите тип реакции (экзо- или эндотермическая).
4. По значениям стандартных теплот образования веществ рассчитайте 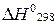 химической реакции
химической реакции

Укажите тип реакции (экзо- или эндотермическая).
5. Определите, как изменяется энтропия при протекании химического процесса  .
.
6. Определите, как изменяется энтропия при протекании химического процесса  .
.
7. Определите, как изменяется энтропия при протекании химического процесса  .
.
8. Используя значения стандартных энтропий веществ, рассчитайте величину  для процесса
для процесса
 ,
,
9. Используя значения стандартных энтропий веществ, рассчитайте величину  для процесса
для процесса
 ,
,
10. Используя значения стандартных энтропий веществ, рассчитайте величину  для процесса
для процесса
 ,
,
11. По значениям стандартных энергий Гиббса образования веществ
рассчитайте изменение энергии Гиббса  для процесса
для процесса

Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
12. Рассчитайте изменение энергии Гиббса  для процесса
для процесса  по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
13. Рассчитайте изменение энергии Гиббса  для процесса
для процесса  по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
по значениям стандартных энергий Гиббса образования веществ. Возможно ли самопроизвольное протекание реакции при стандартных условиях и 298 К?
14. Определите, возможно ли при 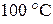 самопроизвольное протекание процесса
самопроизвольное протекание процесса  . Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
. Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
15. Определите, возможно ли при  самопроизвольное протекание процесса
самопроизвольное протекание процесса  . Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
. Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
16. Определите, возможно ли при  самопроизвольное протекание процесса
самопроизвольное протекание процесса  . Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
. Ответ обоснуйте, рассчитав величину изменения энергии Гиббса при данной температуре.
17. Составьте термохимическое уравнение реакции разложения  , если при этом образуется 1 моль
, если при этом образуется 1 моль  и 1 моль
и 1 моль  . В ответе приведите количество теплоты, указанное в термохимическом уравнении.
. В ответе приведите количество теплоты, указанное в термохимическом уравнении.
18. Составьте термохимическое уравнение реакции взаимодействия  и
и  , если при этом образуется 1 моль
, если при этом образуется 1 моль 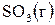 . В ответе приведите количество теплоты, указанное в термохимическом уравнении.
. В ответе приведите количество теплоты, указанное в термохимическом уравнении.
19. Составьте термохимическое уравнение реакции взаимодействия  и
и  , если при этом образуется 1 моль
, если при этом образуется 1 моль  . В ответе приведите количество теплоты, указанное в термохимическом уравнении.
. В ответе приведите количество теплоты, указанное в термохимическом уравнении.
Библиографический список
1. Борсоева, С. А. Химия: учеб. пособие / С. А. Борсоева, В. А. Миронова и др.; Сиб. гос. аэрокосмич. ун-т. – Красноярск, 2006.
2. Коровин, Н. В. Общая химия: учеб. пособие / Н. В. Коровин. – М.: Высш. шк., 2000.
3. Шелинский, Г. И. Основы теории химических процессов: учеб. пособие / Г. И. Шелинский. – М.: Просвещение, 2000.
4. Глинка, Н. Л. Общая химия: учеб. пособие / Н. Л. Глинка. – М.: Высш. шк., 2001.
ПРИЛОЖЕНИЯ
Приложение 1
Варианты и условия заданий
| № варианта | Реакция | Т, К | Количество вещества | |
| Масса | Объем | |||
| Fe3O4(т) +H2(г) = 3FeO(т) +H2O(г) | 10 кг FeO | |||
| H2(г) +CO2 = H2O(г) + CO(г) | 2 000 | 10 л CO2 | ||
| CO(г) + FeO(т) = CO2(г) +Fe(т) | 2 л CO2 | |||
| CH4(г) + CO2(г) = 2CO(г) + 2H2(г) | 1 600 | 4 л CO | ||
| PbO(т) + H2(г) =Pb(т) +H2O(г) | 1 кг PbO | |||
| 2CuCl(т) + H2(г) = 2Cu(т) + 2HCl(г) | 2 л H2 | |||
| CaCO3(т) = CaO(т) + CO2(г) | 7 л CO2 | |||
| MgCO3(т) = MgO(т) + CO2(г) | 100 л CO2 | |||
| 2PbSO4(т) = 2PbO(т) + 2SO2(г) + O2(г) | 20 кг SO2 | |||
| Ca(OH)2(т) = CaO(т) + H2O(г) | 5 кг CaO | |||
| 3Fe2O3(т) = 2Fe3O4(т)+ 1/2O2Iг) | 7 кг Fe2O3 | |||
| FeO(т) + H2(г) = Fe(т) + H2O(г) | 10 л H2 | |||
| Fe3O4(т) + 4H2(г) = 3Fe(т) + 4H2O(г) | 2 л H2 | |||
| C(графит) + 2H2O(г) = CO2(г) + 2H2(г) | 1 200 | 1 кг C | ||
| Al2O3(т) + C(графит) = 2Al(т) +3CO(г) | 5 моль Al2O3 | |||
| Fe3O4(т) + 4CO(г) = 3Fe(т) + 4CO3(г) | 1 000 | 1 кг Fe | ||
| Mg(т) + CO2(г) = MgO(т) + CO(г) | 1 кг Mg | |||
| TiCl4(ж) + 2Mg(т) = Ti(т) + 2MgCl2(г) | 10 кг Ti | |||
| Al2O3(т) + 3C(графит) = 2Al(т) + 3CO(г) | 3 л CO | |||
| H2S(г) + 3/2O2(г) = H2O(г) + SO2(г) | 1 л H2S | |||
| H2(г) + 1/2O2(г) = H2O(г) | 1 л O2 | |||
| 2CO2(г) + H2O(г) = C2H2(г0 + 1/2O2(г) | 2 л C2H2 | |||
| H2O2(г) = H2O(г) + 1/2O2(г) | 1 000 | 2 л H2O | ||
| C(алмаз) ®С(графит) | 3 000 | 1кг C(графит) | ||
| CaO(т) + CO2(г) + CaCo3(т) | 2 л CO2 | |||
| 2NaHCO3(т) = Na2CO3(т) + CO2(г) + H2O(г) | 5 кг Na2CO3 | |||
| C2H4(г) + H2(г) = С2H6 | 1 л C2H4 | |||
| KclO3(т) = KCl(т) + 3/2O2(г) | 2 л O2 | |||
| 2Al(т) + 3Cl2(г) = 2AlCl3(т) | 1 кг Al | |||
| Fe2O3(т) + 3CO(г) = 3CO2(г) + 2Fe(т) | 1 000 | 6 кг Fe |
Примечание: (г) – газ, (ж) – жидкость, (т) – твердое (кристаллическое) вещество.
Приложение 2






