ТермодинамическиЕ функциИ
Химических реакций
Методические указания к выполнению расчетной работы
для бакалавров технических специальностей
очной формы обучения
Красноярск 2011
УДК 54.075
Рецензент
кандидат химических наук, доцент Л. А. Жереб
(Сибирский государственный аэрокосмический университет
имени академика М. Ф. Решетнева)
Печатается по решению методической комиссии ИМИ
Термодинамические функции химических реакций: метод. указания к выполнению расчетной работы для бакалавров техн. спец. очной формы обучения / сост.: М. В. Чижевская; А. Л. Лелекова; Сиб. гос. аэрокосмич. ун-т. – Красноярск, 2011. – 16 с.
© Сибирский государственный аэрокосмический
Оглавление
Общие сведения...................................................................................... 4
Расчетная работа................................................................................... 5
Порядок выполнения расчетной работы........................................ 5
Пример выполнения расчетной работы......................................... 7
Примеры решения типовых задач по теме «Химическая
термодинамика»............................................................................... 9
Задания для самоконтроля............................................................. 12
Библиографический список................................................................ 13
Приложения
Приложение 1. Варианты и условия заданий....................................... 14
Приложение 2. Термодинамические свойства некоторых
простых веществ и химических соединений
при стандартных условиях.......................................... 15
Общие сведения
Методические указания к выполнению расчетной работы включают краткие теоретические сведения о термодинамических функциях химических реакций; алгоритм выполнения расчетной работы; примеры определения термодинамических характеристик различных реакций; методику решения задач по химической термодинамике; варианты для самостоятельной работы студентов; вопросы для самоконтроля.
При освоении теоретического материала в методические указания включена методика решения задач по химической термодинамике.
Приведенные в методических указаниях вопросы и тесты для самоконтроля повышают эффективность в усвоении материал и повышают процент знаний по дисциплине.
Методические указания составлены на основании типового учебного плана и учебной программы по курсу «Химия» для бакалавров технических специальностей Сибирского государственного аэрокосмического университета, одобренной УМО по образованию.
Теоретические сведения
Основной термодинамической функции химических процессов является свободная энергия Гиббса (потенциал Гиббса) –  , которая характеризует возможность протекания реакции в конкретных условиях для изобарно-изотермического процесса (p = const, T = const).
, которая характеризует возможность протекания реакции в конкретных условиях для изобарно-изотермического процесса (p = const, T = const).
Если  < 0, то реакция протекает самопроизвольно в прямом направлении.
< 0, то реакция протекает самопроизвольно в прямом направлении.
Если  = 0, то реакция находится в состоянии химического равновесия.
= 0, то реакция находится в состоянии химического равновесия.
Если  > 0, то реакция не может протекать самопроизвольно
> 0, то реакция не может протекать самопроизвольно
в прямом направлении.
Изменение энергии Гиббса связано с изменением энтальпии ( )
)
и энтропии ( ) химического процесса:
) химического процесса:
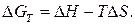
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности или невозможности осуществления процесса.
В самопроизвольных процессах энергия Гиббса убывает ( < 0), при достижении равновесия она принимает минимальное значение
< 0), при достижении равновесия она принимает минимальное значение
(G = G min), а ее приращение обращается в ноль ( = 0).
= 0).
Самопроизвольно протекают реакции в том случае, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, т. е.  < 0.
< 0.
Увеличение энергии Гиббса ( > 0) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
> 0) свидетельствует о невозможности самопроизвольного осуществления процесса в данных условиях.
Если же  = 0 и
= 0 и 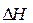 =
=  , то система находится в состоянии химического равновесия и в этом случае
, то система находится в состоянии химического равновесия и в этом случае  . Если Т р < 0, то термодинамическая реакция невозможна в реальных условиях.
. Если Т р < 0, то термодинамическая реакция невозможна в реальных условиях.
В соответствии с уравнением 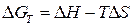 самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, т. е. когда
самопроизвольному протеканию процесса способствует уменьшение энтальпии и увеличение энтропии системы, т. е. когда 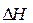 < 0 и
< 0 и  > 0:
> 0:
– эндотермические процессы (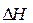 > 0) будут протекать самопроизвольно при высоких температурах, если
> 0) будут протекать самопроизвольно при высоких температурах, если  > 0, т. е. когда |
> 0, т. е. когда |  | > |
| > | 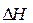 |
|
и тогда  < 0;
< 0;
– эндотермические реакции (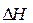 > 0) не протекают самопроизвольно при
> 0) не протекают самопроизвольно при  < 0 ни при каких условиях (для любых Т), т. е когда |
< 0 ни при каких условиях (для любых Т), т. е когда |  | < |
| < | 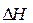 |
|
и тогда  > 0;
> 0;
– экзотермические реакции (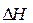 < 0) будут протекать самопроизвольно при
< 0) будут протекать самопроизвольно при  > 0 (при любых температурах) и при
> 0 (при любых температурах) и при  < 0 (при низких температурах), т. е.
< 0 (при низких температурах), т. е. 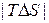 <
< 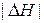 .
.
РасчетнАЯ РАБОТА
Цель работы
1. Рассчитать изменение энергии Гиббса для химической реакции при изобарно-изотермических условиях при стандартной температуре 298 К
и указанной в индивидуальном варианте задания (прил. 1).
2. Установить температуру, при которой наступает состояние химического равновесия для заданного процесса.
3. Зная изменение энергии Гиббса реакции, вычислить значение константы равновесия химической реакции при 298 К и заданной температуре.
4. Сделать пересчет энтальпии на заданную массу (объем или количество) вещества.
5. Проанализировать влияние величин ΔН0 и ΔS0 реакции и изменение температуры на величину потенциала Гиббса.
6. Сделать вывод о том, является ли рассматриваемая реакция самопроизвольной в прямом направлении.
Порядок выполнения расчетной работы
1. Записать уравнение химической реакции и условия задания в соответствии с номером варианта (прил. 1).
аА + вВ ↔ сС + dD
Температура:_______
Масса (или объем):_______
2. Выписать значения Δ Н 0обр. и S 0. для исходных реагентов и продуктов реакции (прил. 2):
| Вещество | Δ Н 0обр, кДж/моль | S 0, Дж/моль·K |
| A | ||
| B | ||
| C | ||
| D |
3. Применив следствие закона Гесса, рассчитать стандартное изменение энтальпии реакции

4. Вычислить изменение энтропии реакции в стандартных условиях:

5. Пользуясь соотношением  , вычислить изменение потенциала Гиббса при стандартной температуре 298 К.
, вычислить изменение потенциала Гиббса при стандартной температуре 298 К.
6. Вычислить Δ GТ при заданной температуре, полагая, что Δ Н 0 и Δ S 0 не зависят от температуры

7. Используя полученные значения  и
и  , рассчитать константу химического равновесия (K р) при 298 К и заданной температуре из уравнения:
, рассчитать константу химического равновесия (K р) при 298 К и заданной температуре из уравнения:

8. Определить температуру, при которой наступает состояние химического равновесия при  = 0.
= 0.
При химическом равновесии  = 0, следовательно, |
= 0, следовательно, |  | = |
| = |  |. Таким образом,
|. Таким образом,  .
.
9. Рассчитать количество теплоты, поглощенной или выделенной в ходе реакции на заданный объем (массу или количество) вещества:
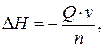
где Q – тепловой эффект реакции; n – стехиометрический коэффициент (заданного вещества); ν – количество вещества,  здесь m – заданная масса вещества, М – молярная масса вещества
здесь m – заданная масса вещества, М – молярная масса вещества
или
 ,
,
где V – заданный объем газообразного вещества; Vm – молярный объем газа (22,4 моль/л).
10. Сделать вывод, является ли рассматриваемая реакция самопроизвольной в прямом направлении. Проанализируйте влияние величины  ,
,  и изменения температуры на величину
и изменения температуры на величину  .
.






