Лекция 3
Тема: Взаимное влияние атомов в молекулах органических соединений
Цель: изучение электронного строения органических соединений и способов передачи взаимного влияния атомов в их молекулах.
План:
1. Индуктивный эффект
2. Виды сопряжения.
3. Ароматичность органических соединений
4. Мезомерный эффект (эффект сопряжения)
Индуктивный эффект
Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.).
· Электроотрицательность – способность атома притягивать электронную плотность другого атома для осуществления химической связи.
Чем больше величина Э.О. данного элемента, тем сильнее он притягивает электроны связи. Величины Э.О. были установлены американским химиком Л. Полингом и этот ряд называется шкалой Полинга.
Э. О. атома углерода зависит от состояния его гибридизации, т.к. атомы углерода, находящиеся в различных видах гибридизации отличаются друг от друга по Э. О. и это зависит от доли s-облака в данном виде гибридизации. Например, атом С в состоянии sp3-гибридизации обладает наименьшей Э.О. так как на долю р-облака приходится меньше всего s-облака. Большей Э.О. обладает атом С в sp- гибридизации.
Все атомы, составляющие молекулу находятся во взаимной связи друг с другом и испытывают взаимное влияние. Это влияние передаётся по ковалентным связям с помощью электронных эффектов.
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону атома с большей Э,О.
· Полярность ковалентной связи – это неравномерное распределение электронной плотности между связанными атомами.
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта.
· Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании ϭ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну две связи. Направление смещения электронной плотности всех σ-связей обозначают прямыми стрелками.→
Например: СH3δ+ < → CH2δ+< → CH2δ+< →Clδ- Э.О. Сl > Э.О. С
СH3δ+< → CH2δ+< → CH2δ+< →OHδ- Э.О. ОН > Э.О. С
· Атом или группа атомов, смещающие электронную плотность ϭ-связи от атома углерода на себя называются электроноакцепторными заместителями и проявляют отрицательный индуктивный эффект (-I-эффект).
Ими являются галогены (Cl, Br, I), OH-, NH2-, COOH, COH, NO2, SO3H и др.
· Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект (+I-эффект).
+I-эффектпроявляют алифатические углеводородные радикалы, СН3, С2Н5 и др.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена группа СН3 проявляет +I-эффект, так как атом углерода в ней находится в sp3-гибридном состоянии, а атомы углерода при двойной связи в sp2-гибридном состоянии и проявляют большую электроотрицательность, поэтому проявляют -I-эффект и являются электроноакцепторами.
 пропен-1
пропен-1
Сопряженные системы. Виды сопряжения.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
Ранее было показано, что в молекулах, имеющих только ϭ-связи, взаимное влияние атомов в случае их различной Э,О. осуществляется через индуктивный эффект. В молекулах, представляющих собою сопряженные системы, проявляется действие другого эффекта – мезомерного, или эффекта сопряжения.
· Влияние заместителя, передающееся по сопряженной системе π-связей, называется мезомерным эффектом (М).
Прежде, чем говорить о мезомерном эффекте необходимо разобрать вопрос о сопряженных системах.
Сопряжение имеется в молекулах многих органических соединений (алкадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.).
Соединения с чередующимся расположением двойных связей, образуют сопряженные системы.
· Сопряжение – образование единого электронного облака в результате взаимодействия неги негибридизованных рz- орбиталей в молекуле с чередующимися двойными и одинарными связями.
 |
Простейшим сопряженным соединением является бутадиен-1,3. Все четыре атома углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-
гибридизации. Все эти атомы лежат в одной плоскости и составляют σ-скелет молекулы (см. рисунок).
Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт условия для их взаимного перекрывания. Перекрывание этих орбиталей происходит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между атомами С-2 и С-3. При перекрывании четырёх рz-орбиталей происходит образование единого π-электронного облака, т.е. сопряжение двух двойных связей. Этот тип сопряжения называется π, π-сопряжением, т. к взаимодействуют орбитали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадлежат определённым связям, они делокализованы т. е равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопровождается выделением энергии, которая называется энергией сопряжения. Такие молекулы более устойчивы, чем системы с изолированными двойными связями. Объясняется это тем, что энергия таких молекул ниже. В результате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарная становится короче, а двойная – длиннее.
Система сопряжения может включать и гетероатомы. Примером π,π-сопряженных систем с гетероатомом в цепи могут служить α и β – ненасыщенные карбонильные соединения. Например, в акролеине (пропен-2-аль) СН2 = СН – СН = О.
Цепь сопряжения включает три sp2-гибридизованных атома углерода и атом кислорода, каждый из которых вносит в единую π-систему по одному р-электрону.
р,π-сопряжение. В р,π-сопряженных системах в образовании сопряжения принимает участие атомы с неподеленной донорной электронной парой. Это могут быть: Cl, O, N, S и др. К таким соединениям относятся галогениды, эфиры, ацетамиды, карбкатионы. В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома. Делокализованная трехцентровая связь образуется путем перекрывания двух р-орбиталей sp2-гибридизованных атома углерода и одной р-орбиталью гетероатома с парой электронов.
|

Образование аналогичной связи можно показать в амидной группе, являющейся важным структурным фрагментом пептидов и белков. Амидная группа молекулы ацетамида включает два гетероатома азот и кислород. В р, π-сопряженииучаствуют π-электроны поляризованной двойной связи карбонильной группы и донорная электронная пара атома азота.
|
 р, π-сопряжение
р, π-сопряжение 
Сопряжение может возникать и в циклических системах. К ним в первую очередь относятся арены и их производные. Простейшим представителем является бензол. Все атомы углерода в молекуле бензола находятся в sp2-гибридизации. Шесть sp-гибридных облака образуют каркас бензола. Все ϭ-связи (С – С и С – Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и параллельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью ϭ-скелета и охватывает все атомы углерода цикла. π-электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей.
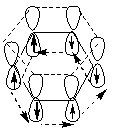

Ароматичность
Это понятие, включающее различные свойства ароматических соединений ввёл немецкий физик Э. Хюккель (1931).
Условия ароматичности:
· плоский замкнутый цикл
· все атомы С находятся в sp2 – гибридизации
· образуется единая сопряженная система всех атомов цикла
· выполняется правило Хюккеля: “В сопряжении участвуют 4n+2 p-электронов, где n = 1, 2, 3... ”
Простейший представитель ароматических углеводородов – бензол. Он удовлетворяет всем четырем условиям ароматичности.
Правило Хюккеля: 4n+2 = 6, n = 1.
 Нафталин
Нафталин
| Нафталин – ароматическое соединение Правило Хюккеля: 4n+2 = 10, n = 2. |
 Пиридин
Пиридин
| Пиридин – ароматическое гетероциклическое соединение. |
Мезомерный эффект
В отличие от несопряженных в которых электронное влияние заместителей передается по σ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) π-системы, называют эффектом сопряжения или мезомерным эффектом.
· Мезомерный эффект (+М, -М) – передача электронного влияния заместителя по сопряженной системе.
При этом заместитель становится частью сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная, нитро группа, сульфогруппа и др.), неподелённую пару электронов гетероатома (галогены, амино-, гидроксильную группы), вакантную или заполненную одним или двумя электронами р-орбиталей. Обозначается буквой М и изогнутой стрелкой  Мезомерный эффект может быть «+» или «–».
Мезомерный эффект может быть «+» или «–».
• Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект. Они содержат атомы с неподеленной электронной парой или отрицательным зарядом и способны к передаче своих электронов в общую сопряженную систему, т. е. являются электронодонорами.(ЭД). Они направляют реакции SE в положения 2,4,6 и называются ориентантами I рода
 Примеры ЭД:
Примеры ЭД:
 Фенол
Фенол
| р, p-сопряжение Гидроксильная группа –ОН проявляет +М. |
Заместитель, притягивающий электроны из сопряженной системы, проявляет –М и наз-ся электроноакцептором (ЭА). Это заместители, имеющие двойную связь
 |
 Акролеин
Акролеин
|
 p, p - сопряжение
Альдегидная группа проявляет – М. p, p - сопряжение
Альдегидная группа проявляет – М.
|
 бензальдегид
бензальдегид
Таблица 1 Электронные эффекты заместителей
| Заместители | Ориентанты в С6Н5-R | I | М | ||
 Аlk (R-): СН3-, С2Н5-... Аlk (R-): СН3-, С2Н5-...
| Ориентанты I рода: направляют ЭД заместители в орто- и пара- положения | + | |||
–  Н2, –NНR, –NR2 Н2, –NНR, –NR2
| – | + | |||
–  Н, – Н, –  Н, – Н, –  R R
| – | + | |||
–Н  L L
| – | + | |||
   

| Ориентанты II рода: направляют заместители в мета- положения | – | – |
Рекомендуемая литература
Основная
1. Лузин А. П., Зурабян С. Э., Н. А. Тюкавкина, Органическая химия (учебник для учащихся средних фармацевтических и медицинских заведений), 2002 г. С.42-46, 124-128.
Дополнительная
1. Егоров А. С., Шацкая К. П. Химия. Пособие – репетитор для поступающих в вузы
2. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии М., 1998. С. 57-61.






