Лабораторно-практичне заняття № 20. ____________________
Тема: Вивчення складу крові та його значення.
Завдання: запишіть склад крові у %.
________________________________
Дослід № 1. Взяття крові та синовіальної рідини у тварин
Кров беруть у тварин з додержанням правил асептики і антисептики. На шкірі в місці пункції вистригають або вибривають шерсть. При необхідності шкіру миють теплою водою з милом та просушують марлевою серветкою, дезінфікують 70%-вим розчином етилового спирту або 5%-вим спиртовим розчином йоду.
Мета роботи. Засвоїти техніку взяття проб крові у різних видів тварин.
Прилади і матеріали. Тварини різних видів (велика рогата худоба, коні, вівці, кози), стерильні ножиці Купера, голки для взяття крові, штатив з пробірками, гумовий джгут, етиловий спирт, 5%-вий розчин йоду, ефір, марля чи вата, спиртовий розчин ефіру, 3,8%-вий розчин цитрату натрію.
Хід роботи. У коней, великої рогатої худоби та овець велику кількість крові беруть з яремної вени на межі верхньої та середньої третини шиї. Тварину фіксують і нижче місця взяття крові накладають гумовий чи звичайний джгут або вену здавлюють пальцями. Це сприяє наповненню вени кров'ю і вона краще простежується. Після підготовки шкіри кровопускальною голкою проколюють її, а потім — судину під кутом 45° проти руху крові.
Витікаючу з голки кров направляють по стінці в пробірку чи циліндр. Після взяття необхідної кількості крові знімають джгут або перестають здавлювати вену пальцями. На шкіру в місці введення голки накладають вату, змочену спиртом, притискують її до тіла тварини і виймають голку. Останнім часом для взяття крові у великої рогатої худоби використовують прилади-автомати різної конструкції. В кожнім з таких автоматів є металевий корпус, тримач для пробірки, ударний механізм з пружиною та голкотримач.
Невелику кількість крові у коня, великої рогатої худоби, свині, вівці, кози, кроля чи дрібніших тварин можна взяти шляхом проколу стерильною голкою крайової чи вушної вени або надрізавши скальпелем кінчик вуха. Першу краплю крові знімають стерильною ватою, а наступні її краплі беруть для дослідження.
У свиней велику кількість крові одержують з краніальної порожнистої вени або при надрізі кінчика хвоста стерильним скальпелем чи ножицями. Після взяття необхідної кількості крові місце надрізу хвоста дезінфікують, а його кінчик вище нанесеної рани здавлюють протягом декількох хвилин бинтом або одягають на нього гумове кільце.
У собак велику кількість крові беруть із вени сафени, для чого тварину кладуть на бік і фіксують. У ділянці верхньої третини стегна накладають джгут. Після наповнення вени голкою проколюють шкіру та стінку судини. Кров беруть у шприц. Після взяття необхідної кількості крові джгут знімають, шкіру в місці введення голки притискають до тіла ватою і витягують голку з тканини. Рану протирають спиртом чи 5%-вим розчином йоду.
У кролів найчастіше всього кров беруть безпосередньо з серця. Для цього тварину фіксують на правому боці, готують місце пункції та вводять голку в третій міжреберний проміжок зліва на 3-4 см вище зовнішнього краю грудної кістки.
У морських свинок кров беруть з серця, для чого роблять пункцію в точці найбільш сильного поштовху. Кінчик голки ставлять біля лівого краю грудної кістки. Швидким рухом проколюють шкіру і всі тканини в напрямку до середньої площини в ділянці грудної порожнини на глибину 1,5-2 см. Голка, яка правильно введена в серце, буде рухатися в такт скороченню його м'яза. Голку з'єднують зі шприцом і в нього беруть кров. Щоб попередити її зсідання, спочатку голку та шприц змочують 2-3 краплями розчину гепарину. Невелику кількість крові у морських свинок одержують шляхом надрізу краю вуха або проколу його голкою, попередньо змазавши шкіру вушної раковини ксилолом.
У мишей та щурів кров беруть з судини хвоста шляхом надрізу його кінчика ножицями.
У птахів кров одержують з підкрильцевої вени. Вона проходить під шкірою з внутрішньої сторони крила. Попередньо в цьому місці вищипують пір'я, шкіру дезінфікують та протирають розчином гепарину, через те, що кров у птиці швидко загусає. В пробірку або на годинникове скло, в яке збирають кров, також наносять 2-3 краплі 1%-вого розчину гепарину. Невелику кількість крові у птахів найчастіше беруть шляхом надрізу або проколу голкою гребеня або сережок, а у гусей та качок — проколу м'яких тканин у ділянці міжпальцевих перетинок.
У риб невелику кількість крові одержують із підшкірної або глибокої хвостової артерії. Кров у риб можна також брати із серця, при цьому ін'єкційну голку вводять за сагітальною лінією між грудними плавниками з одночасним легким нахилом у бік голови.
У жаби невелику кількість крові можна одержати при ампутації пальців лапки або пункцією шкірної вени, яка розміщена посередині черева. Кров також одержують пункцією з оголеного серця.
Для отримання синовіальної рідини коня фіксують у станку. Готують поле операції в ділянці гомілково-надп'ясткового суглоба. Синовіальну рідину отримують шляхом пункції гомілково-надп'ясткового суглоба через передньо-внутрішній або задньо-зовнішній (при загнутій кінцівці) вивороти суглобової капсули і стабілізують 3,8%-вим розчином цитрату натрію у співвідношенні 1:9.
Висновок: ________________
__________________________________
Дослід № 2. Одержання плазми та сироватки крові.
Мета роботи. Засвоїти методику одержання плазми та сироватки крові.
Прилади і матеріали. Тварини, ножиці, стерильні голки для взяття крові, етиловий спирт, ефір, 5%-вий розчин йоду, пробірки, 1% -вий розчин гепарину, 5%-вий розчин цитрату натрію, вата, джгут.
Хід роботи. Для отримання плазми в градуйовану пробірку наливають 0,5 мл 5%-вого розчину цитрату натрію, або 2-3 краплі 1 %-вого розчину гепарину. В неї беруть у тварини 4,5 мл крові. Вміст пробірки добре перемішують і центрифугують протягом 20 хв при 3000 об/хв. Формені елементи осядуть на дно, а плазма буде над ними (рис. 36). Вона має світло-жовтий колір. Кров з антикоагулянтом можна і не центрифугувати, а залишити в пробірці на декілька годин при кімнатній температурі. Вона також розшарується на дві частини — плазму та формені елементи.
Для одержання сироватки кров беруть у пробірку без антикоагулянту і ставлять в термостат при температурі 37-38° С на 40-60 хвилин. Кров зсідається з утворенням згустка темно-вишневого кольору. Згусток крові, який утворився, відділяють стерильною дротинкою або піпеткою від стінки пробірки. На початку згусток пухкий і займає майже весь простір пробірки. Далі він ущільнюється і зменшується в об'ємі, настає ретракція. Навколо нього рідина жовтого кольору — сироватка.

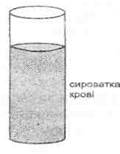
Рис. 36. Отримання плазми та сироватки крові.
Висновок: ________________
__________________________________
Дослід № 3. Ретракція кров'яного згустку.
Ретракція — процес скорочення, ущільнення згустку крові з наступним виділенням з нього сироватки. Тривалість ретракції згустку залежить від вмісту в крові тромбоцитів, фібриногену, іонів кальцію, температури оточуючого середовища та інших факторів (рис. 37).
Мета роботи. Ознайомлення з методикою визначення ретракції згустку крові та з'ясування цього процесу в організмі тварин.
Прилади і матеріали. Тварина, стерильні голки для взяття крові, ножиці, термостат, штатив, центрифужні пробірки з поділками, скляна паличка, спирт етиловий, ефір, вата, марлеві серветки.
Хід роботи. В чисту центрифужну пробірку з поділками беруть з яремної вени тварини 5 мл крові. В кров паралельно до стінки пробірки ставлять скляну паличку з негладкою поверхнею або металевий стрижень і закріпляють його пробкою. Пробірку ставлять у термостат при температурі 57° С на 12-15 годин або залишають при кімнатній температурі (20' С) на добу. За цей час кров у пробірці зсядеться і зі згустку виділиться сироватка. Скляну паличку виймають з пробірки, а разом з нею і згусток. За шкалою пробірки визначають об'єм (в мл) виділеної сироватки і вираховують його відношення до об'єму (в мл) взятої для дослідження крові за формулою:
Х=А/Б,
де X - коефіцієнт ретракції згустка;
А - кількість виділеної сироватки крові;
Рис. 37. Ретракція кров'яного згустку.
Висновок: ________________
__________________________________
Дослід № 4. Одержання фібрину та дефібринованої крові.
Мета роботи. Освоїти методику одержання фібрину та дефібрино\ваної крові.
Прилади і матеріали. Тварини, ножиці, стерильні голки кровопускальні, склянка, дерев'яна чи пластмасова паличка, етиловий спирт, ефір, 5%-вий розчин йоду, вата, джгут.
Хід роботи. Кров беруть у тварин в склянку і розмішують декілька хвилин спеціальною паличкою, на яку осідають нитки фібрину (рис. 38). Паличку виймають з склянки, фібрин знімають з палички, промивають водою до білого кольору. Кров, яка залишилась у склянці, є дефібринованою. Вона в подальшому не зсідається. З неї можна одержати сироватку шляхом відстоювання або центрифугування.
Рис. 38. Одержання фібрину.
Висновок: ________________
__________________________________
Лабораторно-практичне заняття № 21. ____________________
Тема: Дослідження фізико-хімічних властивостей крові.
Дослід № 1. Визначення гематокритного числа.
У сільськогосподарських тварин відносні об'єми плазми і формених елементів залежать від стану здоров'я. Тому їх визначення має клінічне значення.
Мета роботи. Засвоїти метод визначення об'єму формених елементів і плазми крові.
Прилади і матеріали. Кров різних тварин, гематокрит, центрифуга, скляні гематокритні трубочки, гепарин, оксалат алюмінію, оксалат натрію, годинникове скло, вата, марля.
Хід роботи. Відносні об'єми формених елементів і плазми крові визначають з допомогою гематокрита (рис. 39). До його складу входять дві скляні трубочки, відкалібровані на 100 рівних поділок. Для цього також можна використати піпетки Панченкова, у яких треба відрізати верхню частину, а нижню, довжиною 10-11 см, використати як гематокритну трубочку. Для попередження зсідання крові використовують різні методи. На шкіру тварини в місце уколу голки кладуть невелику кількість кристаликів оксалату натрію або трубочки попередньо обробляють протизсідальною речовиною. Кращий результат отримують, якщо трубочку перед використанням промити гепарином (3 мг/мл) і висушити при кімнатній температурі. В кожну трубочку набирають кров, старанно перемішують її з антикоагулянтом, видуваючи на годинникове скло і знову відсмоктуючи. Отвори наповненої кров'ю трубочки закривають гумовим кільцем. Трубочку поміщають в гнізда гематокриту, центрифугують 30 хв. при 5000 об/хв. Кров чітко розділяється на два шари — еритроцитів та плазми. За кількістю кожного з них визначають вміст у крові формених елементів і плазми. У жуйних і коней вміст формених елементів в середньому складає 0,35-0,45 л/л, а плазми — 0,55-0,65 л/л (літрів на літр).
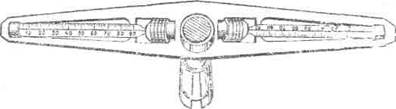
Рис. 39. Гематокрит.
Висновок: ___________________________________________________
Дослід № 2. Визначення в’язкості крові.
Мета роботи. Ознайомлення з методом визначення в'язкості крові, плазми і сироватки.
Прилади s матеріали. Тварина, віскозиметр, кров, сироватка.
Хід роботи. В'язкість визначають за швидкістю витікання крові із капіляра віскозиметра в порівнянні зі швидкістю витікання води при тих же температурі і атмосферному тиску. Віскозиметр (рис. 40) тримають у вертикальному положенні. В один його капіляр набирають воду, в другий — сироватку чи кров до відмітки "0". Потім відкривають крани і відмічають час витікання води і сироватки чи крові. Швидкість витікання обернено пропорційна в'язкості. Час витікання сироватки чи крові треба розділити на час витікання води. Одержаний результат і буде складати рівень в'язкості сироватки чи крові в порівнянні з водою.
За відсутності віскозиметра можна використати мікропіпетки місткістю 0,1-0,2 мл.
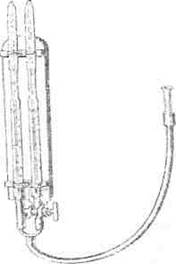
Рис. 40. Віскозиметр.
Висновок: ________ ________
__________________________________
Дослід № 3. Визначення щільності крові
Мета роботи. Засвоїти методи визначення щільності крові.
Прилади і матеріали. Хлороформ, бензол, циліндр, кров, піпетка.
Хід роботи. Для цього досліду готують суміш з щільністю в межах 1,05-1,055, в яку входять дві частини хлороформу та 5,5 частини бензолу. В скляний циліндр місткістю 100 мл наливають 70-80 мл цієї суміші. З допомогою піпетки в неї обережно випускають краплю крові (рис. 41). Якщо крапля осідає на дно, то до суміші добавляють ще хлороформу, а якщо плаває на поверхні, — бензолу. Це роблять до тих пір, поки крапля не зупиниться в суміші на середньому рівні. Тоді щільність крові і суміші буде однаковою. За допомогою ареометра визначають щільність суміші, а значить — і крові.
За відсутності ареометра щільність або питому вагу крові визначають так. У мірний циліндр беруть 20 мл бензолу (питома вага 0,88) і 10 мл хлороформу (питома вага 1,485). В суміш вносять 1-2 краплі крові. Якщо крапля опускається на дно, то в суміш додають хлороформ, якщо спливає, — бензол. їх додають до тих пір поки крапля крові не займе середнє положення, тобто питома вага крові буде такою ж, як і суміші. Після цього вираховують питому вагу крові. Наприклад, в циліндр взято 20 мл бензолу і 10 мл хлороформу, додали 1 мл бензолу і 2 мл хлороформу, одержали суміш з 21 мл бензолу і 12 мл хлороформу з загальним об'ємом 33 мл.
Питома вага суміші: (21 x 0,88 – 12 x 1,485) / 33 = 1,100
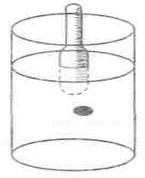
Рис. 41. Визначення щільності крові.
Висновок: ________________
__________________________________
Лабораторно-практичне заняття № 22. ____________________
Тема: Визначення буферних властивостей крові.
Дослід № 1. Визначення буферних властивостей крові.
У крові здорових тварин спостерігається постійний рівень концентрації водневих іонів (рН), не дивлячись на значні її зміни в тканинах. Вона регулюється декількома механізмами і підтримується буферними системами.
Мета роботи. Ознайомлення з методикою визначення буферних властивостей крові.
Прилади і матеріали. Сироватка крові різних видів тварин, бюретки, склянки, очні та мірні піпетки, іономір, 0,1 N розчин соляної кислоти, 0,1 N розчин їдкого натрію, індикатори: 0,1%-вий розчин метилоранжу, 0,1%-вий розчин фенолфталеїну, дистильована вода, вата, марля.
Хід роботи. Виявлення лужного буфера проводиться в двох паралельних пробах. В першу склянку (контрольна проба) беруть 10 мл дистильованої води, а в другу — 10 мл дистильованої води з 1 мл сироватки крові. В кожну пробу вносять по 2 краплі 0,1%-вого розчину метилоранжу. їх титрують, починаючи з контрольної проби, 0,1 N розчином соляної кислоти до виникнення слабкомалинового кольору, тобто до кислої реакції. Враховують витрату розчину кислоти в краплинах і визначають, на скільки більше необхідно добавити соляної кислоти до сироватки порівняно з водою, щоб реакція її стала кислою.
Виявлення кислотного буфера проводиться також при наявності контролю. Для цього в першу склянку наливають 10 мл дистильованої води (контроль), а в другу — 10 мл дистильованої води та 1 мл сироватки крові. В кожну склянку добавляють по 2 краплі 0,1%-вого розчину фенолфталеїну. Рідину перемішують і титрують, починаючи з контролю, 0,1 N розчином їдкого натрію до виникнення рожево-червоного забарвлення. Визначають, скільки крапель розчину їдкого натрію пішло на титрування лише води та суміші води з сироваткою крові. Потім вираховують, у скільки разів більше необхідно додати їдкого натрію, щоб у другому випадку, порівняно з першим, реакція була лужною.
Кислотний та лужний резерв крові (буферність) визначають шляхом титрування. В дві градуйовані бюретки наливають: в одну 0,1 N розчин соляної кислоти, в другу — 0,1 N розчин лугу. В дві скляночки беруть по 5 мл дистильованої води, в одну додають дві краплі розчину фенолфталеїну і титрують розчином лугу до появи рожевого (малинового) кольору. В другу склянку додають 2 краплі розчину метилоранжу і титрують розчином кислоти до появи оранжево-червоного кольору. Враховують кількість розчинів кислоти і лугу, витрачені на титрування. Кислотний і лужний резерв визначають шляхом розрахунку. Наприклад, на 5 мл води пішло 0,2 мл 0,1 N розчину кислоти (або лугу), а на 100 мл буде використано X. Кислотний або лужний резерв дорівнює:
(100 х 0,2):5 = 4.
Висновок: ________________
__________________________________
Дослід № 2. Визначення вмісту гемоглобіну в крові.
Гемоглобін — основна складова частина еритроцитів — хромопротеїд, в гемі якого міститься двохвалентне залізо, його кількість в крові залежить від віку, виду, породи, фізіологічного стану тварин і інших факторів. Визначенню гемоглобіну в крові надається велике значення в клінічній практиці, для цього використовують різні методи.
В нормі вміст гемоглобіну складає (г/л): у великої рогатої худоби — 84,4-117,8; у свиней — 92-114; у коней — 90-149; у овець — 82-113.
Мета роботи. Визначити вміст гемоглобіну в крові різних тварин.
Прилади і матеріали. Кров тварин, штатив з пробірками, гемометр Салі, 0,1 N розчин соляної кислоти, дистильована вода, мірні піпетки, капіляр для гемометра місткістю 0,02 мл, вата, марля.
Хід роботи. Колориметричне визначення гемоглобіну проводиться гемометром, в комплект якого входять мікропіпетки і скляна паличка (рис. 42).
Прилад складається із пластикового корпусу з трьома гніздами для пробірок. В задній стінці корпусу вмонтовано матове, білого кольору скло, яке розсіює світло. В бокові гнізда встановлені однакового розміру запаяні пробірки з стандартним розчином солянокислого гематину, а в середнє гніздо — градуйована пробірка для крові, яку досліджують. На всіх пробірках є дві кругові контрольні мітки. Нижча з них відповідає ємності 0,2 мл, а верхня — 2 мл.
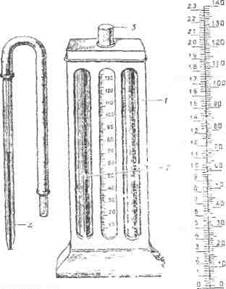
Рис. 42. Гемометр:
1 - корпус приладу; 2 - пробірки з стандартними розчинами; З - градуйовані пробірки; 4 - піпетки для одержання крові.
Для визначення гемоглобіну в градуйовану пробірку гемометра наливають 0,1 N розчин соляної кислоти до нижньої поділки. В капілярну піпетку, додану до приладу, беруть 0,02 мл крові. Кінець піпетки витирають ватою, опускають її на дно пробірки в розчин соляної кислоти і видувають кров. Піпетку, не витягуючи з пробірки, декілька разів промивають розчином з верхнього шару. Після цього вміст пробірки старанно перемішують і залишають на 5 хв у штативі для повного гемолізу еритроцитів. Гемоглобін, вступаючи в реакцію з соляною кислотою, утворює солянокислий гематин, який має коричневе забарвлення. Через 5 хв у пробірку краплями, постійно перемішуючи скляною паличкою, додають дистильовану воду до тих пір, поки колір рідини не зрівняється з кольором стандартного розчину. За малою шкалою пробірки (від 0 до 23) визначають вміст гемоглобіну в г%, а за великою (від 0 до 140) — у відносних одиницях гемометра (од. Салі). Якщо на пробірці нема великої шкали, то відносний вміст гемоглобіну вираховують шляхом множення на 6 кількості гемоглобіну, приведеної в г%, оскільки 1 г% його відповідає 6 одиницям.
Гемоглобін визначають також за допомогоюі автоматичного приладу "Культер", який показує його кількість в грамах на 100 мл на спеціальнім табло або записує на бланку.
Висновок: ________________
__________________________________
Лабораторно-практичне заняття № 23. ____________________
Тема: Підрахунок кількості еритроцитів.
Дослід № 1. Підрахунок кількості еритроцитів під світловим мікроскопом.
Еритроцити складають основну масу клітин крові, їх кількість у крові кожного виду тварин є відносно постійною. Вона може змінюватися в залежності від віку, статі, продуктивності, фізіологічного стану тварини і інших умов.
Мета роботи. Засвоїти методику підрахунку кількості еритроцитів у крові різних видів тварин.
Прилади і матеріали. Різні види тварин або проби крові від них, голки для взяття крові, ножиці, мікроскоп, змішувач для еритроцитів, пробірки, камера Горяєва, покривне скло, 1%-вий розчин хлористого натрію, вата, марля, 75%-вий розчин йоду, 2-5 мікропіпетки місткістю 0,02 мл (рис. 43).
Хід роботи. Спочатку готують обладнання. Камеру Горяєва та покривні скельця промивають водою, висушують на повітрі чи з допомогою марлі і знежирюють етиловим спиртом, а потім ефіром. Такі ж маніпуляції виконують із мікропіпетками, але воду та знежирюючі речовини послідовно 2-3 рази набирають в них і випускають. Для зручності в роботі до мікропіпеток приладнують гумову грушу або ж гумовий шланг довжиною 60-70 см. Через нього всмоктується в піпетку необхідна кількість крові.
Далі готують 1%-вий розчин хлористого натрію, його розливають по 4 мл в пробірки, які ставлять у штатив. Пробірок з розчином має бути стільки, скільки планується взяти для дослідження проб крові.
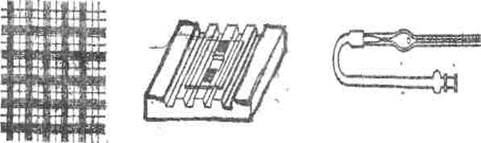
а б в
Рис. 43. а – сітка камери Горяєва; б – кмера Горяєва; в – еритроцитарний змішувач Горяєва.
Кров у тварини беруть з вуха, дотримуючись правил асептики. Першу її краплю знімають ватою з шкіри. З другої краплі крові набирають в мікропіпетку 0,02 мл і випускають в пробірку з 4 мл 1%-вого розчину хлористого натрію. Мікропіпетку промивають ще 2-3 рази в розчині цієї ж пробірки та в аналогічному розчині, який налитий в окрему склянку чи пробірку. В останньому випадку розчин хлористого натрію набирають в мікропіпетку, а потім видаляють з неї в зливний стакан. Після цього мікропіпетку можна застосовувати для взяття проби крові у наступної тварини. Пробу крові старанно розмішують в розчині хлористого натрію, для чого пробірку з нею закривають гумовою пробкою і декілька разів перевертають вниз, а потім знову вгору. Таким чином, якщо 0,02 мл крові добавляють до 4 мл 1%-вого розчину хлориду натрію, то розводять її в 200 разів (4 мл: 0,02 мл = 200). Таке ж розведення крові буде і при застосуванні змішувача для еритроцитів. В нього беруть кров до поділки 0,5,а 1 %-вий розчин хлористого натрію — до поділки 101. Заправлений змішувач затискують між великим та вказівним пальцями і струшують протягом 2-3 хв для перемішування крові.
В умовах практичної роботи застосовують і такий методичний прийом. У тварин з вуха беруть по 2-3 мл крові в пробірки з 2-3 краплями антикоагулянту і 1 %-вого розчину гепарину. В лабораторії пробу крові з гепарином готують для подальшого дослідження так, як і нативну.
В пробах крові, яку розбавили в 200 разів, підраховують кількість еритроцитів. Для цього застосовують камеру Горяєва. На її поверхню притирають накривне скло до появи райдужних кілець. З допомогою піпетки під край накривного скла поміщають краплю розбавленої крові, яка в силу капілярності заповнює камеру Горяєва. Візуально контролюють, щоб в камері під склом не було бульбашок повітря. Камеру ставлять на столик мікроскопа (окуляр х 10, об'єктив Х40, бінокулярна насадка х 15) і через 1-2 хв, коли всі еритроцити осядуть і не будуть рухатись, починають їх підрахунок при зменшеному отворі діафрагми і опущеному конденсорі. Еритроцити рахують в п'яти великих квадратах (в кожному з яких є по 16 малих квадратиків), розміщених по діагоналі, бо еритроцити в камері можуть розподілятися нерівномірно 3 цією метою в полі зору мікроскопа знаходять перший великий квадрат в лівому верхньому кутку сітки і підраховують у ньому всі еритроцити. Потім камеру пересувають так, щоб в поле зору потрапив другий великий квадрат по діагоналі і т.д.
Для одержання більш точного результату прийнято підраховувати еритроцити, які розміщені не тільки в середині квадратика, а і на його лівому та верхньому боках.
При підрахунку еритроцитів враховують такі дані. Одна сторона маленького квадратика сітки в камері Горяєва дорівнює 1/20 мм, а глибина — 1/10 мм. Тому об'єм камери над одним квадратиком складає 1/4000 куб. мм (1/20 ммх 1/20 мм х 1/10 мм).
Кількість еритроцитів в 1 мкл (куб. мм) вираховують за формулою:
Х = (Н х 4000 х 200): 80,
де X — кількість еритроцитів в 1 мкл крові;
Н — кількість еритроцитів, підрахованих в 5 великих квадратах;
4000 — коефіцієнт переводу до об'єму 1 мкл;
200 — ступінь розведення крові;
80 — кількість малих квадратиків в 5 великих квадратах.
При спрощенні ця формула має такий вигляд: Х = Н х 10000.
Висновок: ________________
________________________________
Лабораторно-практичне заняття № 24. ____________________
Тема: Підрахунок кількості лейкоцитів та тромбоцитів.
Дослід № 1. Підрахунок кількості лейкоцитів під світловим мікроскопом.
Лейкоцити, або білі клітини крові, мають у цитоплазмі ядро і їх розміри в декілька разів більші ніж еритроцитів. Вони беруть участь в захисті організму тварини від чужих антигенів (бактерій, токсинів тощо) і т.п. Кількість лейкоцитів є характерною для кожного виду тварин, але вона може змінюватися в залежності від віку, стану здоров'я, годівлі тварин та інших умов. Важливе значення для оцінки фізіологічного стану тварин має не тільки підрахунок їх загальної кількості в крові, але і визначення співвідношення окремих видів лейкоцитів, їх фагоцитарної активності і інших показників.
Мета роботи. З'ясувати методику підрахунку кількості лейкоцитів у різних видів тварин.
Прилади і матеріали. Проби крові різних видів тварин, мікроскоп, пробірки, камера. Горяєва, змішувач лейкоцитів (рис. 44) або мікропіпетка місткістю 0,02 мл, 5%-вий розчин цитрату натрію, рідина Тюрка, спирт етиловий, вата, марля.
Хід роботи. Обладнання готують як і для підрахунку еритроцитів. Рідину Тюрка одержують шляхом змішування таких компонентів: 3 мл льодяної оцтової кислоти, 1 мл 1%-вого розчину генціанвіолету, до 100 мл дистильованої води. В цій рідині оцтова кислота гемолізує еритроцити/а генціанвіолет — забарвлює ядра лейкоцитів.
Кров беруть з вуха тварини в пробірку з антикоагулянтом (5% -вий розчин цитрату натрію чи 1%-вий розчин гепарину), або ж її досліджують в нативному вигляді, В будь-якому випадку спочатку готують розведення крові в 20 разів. Для цього використовують змішувач лейкоцитів або мікропіпетку місткістю 0,02 мл. В змішувач набирають кров до мітки 0,5,а потім — рідину Тюрка, до мітки 11, У мікропіпетку набирають 0,02 мл крові. її кінчик витирають ватою. Кров вносять у пробірки, що мають по 0,4 мл рідини Тюрка. Мікропіпетку, не виймаючи з пробірки, промивають два-три рази рідиною, яка в ній знаходиться. Вміст пробірки добре перемішують.
На наступному етапі в розведеній крові підраховують кількість лейкоцитів, Для цього з нею виконують такі ж дії, як і при підрахунку еритроцитів. Різниця полягає лише в тому, що лейкоцити рахують в камері Горяєва під меншим збільшенням мікроскопа(окуляр х7,об'єктив х20,бінокулярна посадка х15) в 100 великих нерозкреслених квадратах (умовно 1600 маленьких). Загальну кількість лейкоцитів (в 1 мкл крові) вираховують за формулою:
Х = (Н х 4000 х 20): 1600,
де Н — кількість лейкоцитів, підрахованих в 100 великих квадратах;
4000 — коефіцієнт переводу до об'єму в 1 мкл;
20 — розведення крові;
1600 — кількість малих квадратиків камери Горяєва.
Частіше застосовують цю формулу в спрощеному вигляді: Х=Н х 50.

Рис. 44. Лейкоцитарний змішувач.
Висновок: ________________
________________________________
Дослід № 2. Підрахунок кількості тромбоцитів під світловим мікроскопом.
Тромбоцити (кров'яні пластинки) — округлої або овальної форми клітини без ядер. В їх центрі є зернистість, яка забарвлюється метиленовою синькою в блакитний колір. Тромбоцити беруть участь в зсіданні крові.
Мета роботи. Ознайомлення з методикою підрахунку тромбоцитів.
Прилади і матеріали. Тварини, голки для взяття крові, ножиці, мікроскоп, змішувач для еритроцитів, камера Горяєва, розбавник для крові, етиловий спирт, ефір, 5%-вий розчин йоду, вата, марлеві серветки.
Хід роботи. Кров беруть з судин вуха тварини в змішувач для еритроцитів до мітки 0,5. її розбавляють в 200 разів розчином, який готують таким чином. До 100 мл дистильованої води додають 3,8 г цитрату натрію, 0,57 г хлориду натрію, 0,15 г метиленової синьки. Розчин доводять до кипіння, охолоджують і фільтрують. Потім до нього вносять ще 2-3 краплі формаліну.
Рідину в меланжері добре перемішують і залишають у спокої на 10-15 хв для зафарбування тромбоцитів метиленовою синькою. Після цього вміст меланжера перемішують ще раз, перші 2-3 краплі видаляють на вату, а наступну краплю вносять під притерте накривне скло камери Горяєва. Камеру розміщують на столику мікроскопа і під великим збільшенням (окуляр х 10,об'єктив Х40,бінокулярна насадка х15) рахують кров'яні пластинки в 25 великих квадратах, кожний з яких розкреслений на 16 маленьких квадратиків.
Їх кількість в 1 мкл крові вираховують за формулою: Х = (Н X 4000 X 200) / 400, де Н — кількість тромбоцитів, підрахованих в 400 маленьких квадратиках.
Інші цифри формули мають аналогічне значення, як і при визначенні кількості еритроцитів чи лейкоцитів. Цю формулу краще застосовувати в спрощеному вигляді:
Х = Н х 2000.
Висновок: ________________
________________________________
Лабораторно-практичне заняття № 25. ____________________
Тема: Дослідження швидкості осідання еритроцитів. Гемоліз.
Дослід № 1. Дослідження швидкості осідання еритроцитів.
Еритроцити мають певну масу і тому можуть осідати в крові навіть тоді, коли вона оброблена з метою запобігання осіданню. Швидкість їх осідання у різних тварин різна. Вона залежить від фізико-хімічних властивостей плазми, фізіологічного стану тварини та інших умов. У здорових коней швидкість осідання еритроцитів складає 40-70 мм/год, у великої рогатої худоби — 0,5-1,5, у свиней — 2-9, у птахів — 1,5-3 мм/год.
Мета роботи. Ознайомитися з методикою і визначити швидкість осідання еритроцитів крові різних тварин. Вияснити вплив плазми крові на ШОЕ.
Прилади і матеріали. Кров коня, корови, кролика, курки, апарат Панченкова (рис. 45), еритроседіометр Неводова, 5%-вий розчин цитрату натрію, годинникове скло, етиловий, спирт, вата, марля.
Хід роботи 1. Швидкість осідання еритроцитів частіше визначають з допомогою апарата Панченкова, який складається з штатива і набору капілярних піпеток діаметром 1 мм. На кожній піпетці є 100 поділок. В середині є відмітка 50 або літера Р, що означає "розчин", а в верхній частині на рівні 0 стоїть літера К, яка є позначкою слова "кров".
Перед роботою піпетку промивають розчином цитрату натрію. Потім його набирають до мітки Р і виливають на годинникове скло. Далі тією ж піпеткою набирають двічі кров з вуха дослідної тварини до мітки К і вносять на скло в розчин цитрату натрію. Кров і розчин добре перемішують піпеткою та струменем повітря, який видувають з неї. Цитратну кров беруть з годинникового скла в піпетку до поділки К, яку ставлять у штатив. Для цього вказівним пальцем закривають верхній кінець піпетки, а нижній ставлять на гумову прокладку приладу, яка завдяки еластичності фіксує (притискає) піпетку до верхнього бортика в вертикальному положенні. Реєструють час початку досліду і відмічають швидкість осідання еритроцитів через кожні 15 хв. протягом 1 години, а остаточний облік результатів проводять через 24 години. Еритроцити, які осіли, добре видно в піпетці в вигляді темно-червоного стовпчика, а над ним — плазма блідо-жовтого кольору.
2. Швидкість осідання еритроцитів за Неводовим частіше визначають у коней. Для цього використовують еритроседіометр, який являє собою градуйовану пробірку висотою 17 см і діаметром 0,8-0,9 см з поділками від 0 до 100 зверху вниз. В еритроседіометр вносять 15-20 мг цитрату або оксалату натрію. Кров беруть у коня з яремної вени в еритроседіометр до поділки 0. Вміст змішують обе режним перевертанням пробірки декілька разів і ставлять її вертикально в штатив. Результат осідання еритроцитів враховують через кожні 15 хв на протязі години.
Рис. 45. Апарат Накченкова.
Висновок: ________________
________________________________
Дослід № 2. Гемоліз.
Гемоліз — процес виходу гемоглобіну з еритроцита, внаслідок пошкодження і руйнування його оболонки. Він відбувається під дією різних несприятливих факторів і патологічного стану організму.
Мета роботи. Ознайомлення з явищем гемолізу та причини, що його викликають.
Припади і матеріали. Кров тварин, штатив з пробірками, піпетки місткістю 5 мл, очні піпетки, концентрований розчин аміаку, етиловий спирт (70°), 0,9%-вий розчин хлориду натрію, 0,1 N розчин НСІ, хлороформ, дистильована вода, вата, кров після одногодинної витримки в морозильній камері холодильника (-20°С).
Хід роботи. В 7 пронумерованих пробірок наливають: у першу 5 мл 0,9%-вого розчину хлориду натрію, в другу — 5 мл дистильованої води, в третю — 4 мл 0,9%-вого розчину хлориду натрію і 1 мл хлороформу, в четверту — 4 мл 0,9%-вого розчину хлориду натрію і 1 мл концентрованого розчину аміаку, в п'яту — 3 мл 0,9%-вого розчину хлориду натрію і 2 мл етилового спирту, в шосту — 3 мл 0,9%-вого розчину хлориду натрію та 2 мл 0,1 N розчину соляної кислоти. В сьому пробірку наливають кров, яку протягом однієї години витримали в морозильній камері холодильника (-20°С). В кожну пробірку вносять по п'ять крапель стабілізованої крові, вміст добре перемішують і залишають у штативі на 10 хв. Наявність чи відсутність гемолізу еритроцитів визначають за появою прозорості рідини та її кольором в пробірці.
Висновок: ________________
________________________________
Дослід № 3. Осмотична резистентність еритроцитів.
Резистентність — властивість еритроцитів протистояти гемолізу. Осмотична резистентність — стійкість еритроцитів до гемолізу в гіпотонічних розчинах. Вона є показником здатності еритроцитів протистояти зниженню осмотичного тиску крові.
Мета роботи. Ознайомитися з методикою та визначити осмотичну резистентність еритроцитів крові.
Прилади і матеріали. Стабілізована кров, ряд розчинів хлористого натрію (0,1 %; 0,2 %; 0,3 % і т.д. до 1,0%-вого).
Хід роботи. У кожну пробірку наливають по 5 мл розчину хлористого натрію певної концентрації: від 0,1 % до 1,0 %. В пробірки додають по 2-3 краплі стабілізованої крові. Через 20-30 хвилин відмічають стан вмісту пробірки. Прозорість рідини вказує на гемоліз, мутність — на резистентність (стійкість) еритроцитів до даної концентрації солі. Визначають показник максимальної резистентності еритроцитів до пониженого осмотичного тиску, тобто найменшу концентрацію розчину, де відсутній гемоліз.
Висновок: ________________
________________________________
Лабораторно-практичне заняття № 26. ____________________
Тема: Умови, які впливають на швидкість зсідання крові.
Дослід № 1. Умови, які впливають на швидкість зсідання крові.
Мета роботи. З'ясувати дію різних факторів на зсідання крові у однієї і тієї самої тварини.
Прилади і матеріали. Тварина, голки для взяття крові, ножиці, водяна баня, банка з льодом, 5%-вий розчин хлористого кальцію, спирт етиловий, ефір, 5%-вий розчин йоду, вата. 5%-вий розчин цитрату натрію.
Хід роботи. Необхідні 4 чисті сухі пронумеровані пробірки; в другу пробірку наливають 1 мл 5%-вого розчину цитрату натрію. Заздалегідь готують водяну баню і банку з льодом. Після цього у тварини беруть з яремної вени по 2 мл крові в кожну пробірку. Відмічають час заповнення пробірок кров'ю і зразу розміщують пробірки в такі умови: першу і другу залишають при кімнатній температурі (20°С), третю ставлять в банку з льодом, четверту в водяну баню з температурою 38-40°С. Періодично спостерігають за кров'ю в пробірках, нахиляючи в одну сторону, і відмічають час її зсідання в кожній з них. Після цього продовжують дослід з кров'ю в пробірці № 2. Пересвідчившись, що в ній кров перебуває в рідкому стані, розливають її в дві пробірки рівними частинами. В першу частину крові добавляють 0,5 мл 5%-вого розчину хлористого кальцію і відмічають час його внесення. Вміст пробірки добре перемішують і спостерігають, що відбулося з кров'ю, порівнюючи її з другою частиною. Результати аналізують і роблять висновки.
Висновок: ________________
________________________________
Дослід № 2. Спостереження аглютинації еритроцитів.
Мета роботи. Провести спостереження явища аглютинації еритроцитів.
Прилади і матеріали. Предметне скло, набір сироваток, кролик. Явище аглютинації еритроцитів використовується при визначенні груп крові. В сироватці крові є клейкі речовини — аглютиніни (альфа, бета), а в еритроцитах — речовини, які здатні склеюватись, аглютиногени (А і В). За наявністю чи відсутністю цих речовин і ділять кров на різні групи.
Хід роботи. Для виявлення явища аглютинації на предметне скло наносять по одній краплі сироватки II та III груп. Проколюють крайову вену вуха кролика. З допомогою предметного скла вносять краплю крові в одну краплю сироватки, а другим краєм скла — в другу краплю і старанно розмішують. Через одну-дві хвилини наступає реакція аглютинації (гемаглютинації), тобто еритроцити склеюються і випадають в осад у вигляді дрібненьких грудочок, видимих неозброєним оком. За наявністю аглютинації в тій чи іншій краплині сироватки визначають групу крові.
Висновок: ________________
________________________________
Лабораторно-практичне заняття № 27. ____________________
Тема: Визначення часу зсідання крові.
Дослід № 1. Визначення часу зсідання крові.
Зсідання крові — складна захисно-пристосувальна реакція організму, направлена на попередження крововтрати. На процес зсідання впливає багато факторів та речовин крові. Він відбувається з різною швидкістю у різних тварин.
Мета роботи. Ознайомлення з методикою визначення швидкості зсідання крові у тварин.
Прилади і матеріали. Тварини, інструменти для взяття крові, стерилізатор, предметне скло, секундомір,
капронова нитка на паличці, центрифужні пробірки, водяна баня, спирт етиловий, ефір, 5%-вий розчин йоду, вата, марлеві серветки.
Хід роботи. 1. Метод Битюкова Є. І. У хірургічний стерилізатор наливають воду і підігрівають її до 57°С. Замість кришки на бокові сторони стерилізатора кладуть підставку з двох скляних паличок, з'єднаних гумовими трубками. На підставці розміщують обезжирене предметне скло, на яке наносять 1-2 краплі досліджуваної крові і відмічають час. Через кожні ЗО сек в краплю занурюють чисту суху капронову нитку, закріплену підковоподібно на дерев'яній паличці або сірникові, роблять нею 2-3 рухи в середині краплі і піднімають. Як тільки за ниткою почнуть тягнутися волокна фібрину, то секундоміром реєструється час зсідання крові.
2. З вушної раковини тварин беруть 1 -2 краплі крові. При кімнатній температурі її розмішують на предметному склі. Через кожну хвилину скло нахиляють і спостерігають за краплею крові, повторюючи цей захід до тих пір, поки в ній не утвориться згусток, який не буде змінювати форму.
Час від нанесення краплі крові на скло до формування згустка буде відповідати швидкості зсідання крові. У великої рогатої худоби кров зсідається за 5-6 хв, у свиней — за 10-15 хв, у коней — за 8-10 хв.
Висновок: ________________
________________________________
Дослід № 2. Приготування та фарбування мазків для визначення лейкоцитарної формули (лейкограми).
При оцінці фізіологічного стану організму тварин важливе значення має не тільки підрахунок загальної кількості лейкоцитів, а і визначення кількісного чи відсоткового співвідношення певних форм білих клітин крові — лейкоцитарної формули. Для цього необхідно приготувати мазки крові і пофарбувати їх.
Мета роботи. Приготувати і пофарбувати мазки крові, провести деференціацію і підрахунок різних форм лейкоцитів. Визначити лейкограму.
Прилади і матеріали. Тварини, голки для взяття крові, ножиці, предметне скло з шліфованим краєм, метиловий спирт, етиловий спирт, фарба Романовського-Гімза, ванночка, колба з дистильованою водою, ефір, 5%-вий розчин йоду, вата, марля.
Хід роботи. Кров беруть у тварин з вуха. Після проколу судини краплю крові наносять на край сухого обезжиреного предметного скла, яке тримають між великим і середнім пальцями лівої руки. Попереду краплі під кутом 45° підводять шліфований край накривного скла так, щоб утворений стеклами кут був рівномірно наповнений кров'ю (рис. 46). Рухом правої руки від себе краплю розподіляють тонким шаром по поверхні предметного скла. Мазок буде добрим, якщо кров розміщується на поверхні скла в вигляді рівномірної смужки, яка не виходить за його краї.

Рис. 46. Приготування мазків.
Мазок висушують на повітрі і фіксують. Для цього його кладуть у ванночку. З допомогою піпетки на нього наливають метиловий спирт на 3-5 хв, або суміш ефіру з абсолютним етиловим спиртом в співвідношенні 1:1 на 15-20 хв, чи хлороформ на декілька секунд. Мазок виймають з ванночки, висушують і фарбують одним із описаних нижче способів. Для цього беруть дві скляні палички, скріплюють їх паралельно гумовими трубками і кладуть у вигляді підставки над ванночкою або кюветою. На ній розміщують предметні стекла мазком вверх і фарбують.
Фарбування за Романовським-Гімза, Готову фарбу попередньо розводять дистильованою водою. Для цього на кожен мл води додають 2-3 краплі фарби, її виливають на мазок, який тримають в вологій камері 30-40 хв. (в залежності від температури повітря і активності фарби). Потім фарбу змивають дистильованою водою, а препарат висушують на повітрі. Добре пофарбований мазок буде рожево-фіолетового кольору, недофарбований — рожево-червоного, а перефарбований — темно-фіолетового.
Мазки крові зручно фарбувати в спеціальних пластмасових або фарфорових ванночках. Мазки ставлять у вертикальному положенні, а потім туди добавляють розведену фарбу.
Фарбування за Гіапенгеймом-Кркжовим. Цей метод виконується у два етапи без попередньої фіксації мазків, бо в склад фарби входить фіксуючий реактив. На першому етапі на сухий мазок наливають 2 мл готової фарби Май-Грюнвальда на 5 хв, а потім 2 мл дистильованої води і перемішують їх за допомогою піпетки. Через 2 хв цю суміш зливають.
У другий етап на мокрий ще мазок наливають фарбу Романовського-Гімза на 20 хв, після чого її змивають дистильованою водою. Препарат висушують на повітрі. При такому комбінованому фарбуванні більш чітко видно зернистість і структуру ядра клітини.
Висновок: ________________
________________________________






