Для розглядання питань рівноваги необхідно уточнити визначення поняття система. Фізичною або хімічною системою називають сукупність взаємодіючих тіл. Якщо ця взаємодія визначається фізичними закономірностями, то розуміють фізичну систему, хімічними — хімічну систему і т.д.
Біологічною системою в залежності від рівня розглядання живої природи звичайно називають сукупність взаємодіючих молекул в клітині (клітинно-молекулярний рівень), клітин в організмі (організменний рівень), організмів в популяції (популяційний рівень) та різних популяцій в навколишнім середовищі (біогеоце-нологічний). Відносно до технології очевидно має сенс ввести поняття біохімічної системи, під якою належить розуміти сукупність взаємодіючих тіл (мікроорганізмів та компонентів) середовища, які підлягають законам біохімічних перетворень.
Технологічною системою можна називати сукупність вико-нуємих в певній послідовності технологічних операцій над пере-роблюємим продуктом. Технологічну систему можна сформувати із різних окремих елементів в різній комбінації, але при цьому повинна бути чітко сформульована технологічна мета системи у вигляді кількісних та якісних характеристик.
Закони рівноваги систем пристосовані до фізичних, хімічних та біологічних систем. Системи, які знаходяться в рівновазі, не змінюють свого стану протягом часу. Стан системи визначається її відстанню від стану рівноваги. Наприклад, при взаємодії сушильного агенту і висушуємого матеріалу найбільша швидкість сушіння має місце при найбільших значеннях вологості матеріалу та найменшому вологоутриманні сушильного агенту, тобто при найбільшому віддаленні від кривої рівноваги стану. Для виводу системи з рівноваги необхідно на неї якимось чином вплинути зовні шляхом зміни температури, тиску, концентрації та інше.
Всі хіміко-технологічні процеси діляться на зворотні та незво-ротні. Незворотні процеси перебігають лише в одному напрямку. Більшість процесів технології є незворотними або проходять при таких технологічних режимах, при яких процеси можуть пе-
ребігати тільки в одному напрямку (сушіння, ректифікація, адсорбція, подрібнення, пресування і ін.). Інші процеси є зворотними (абсорбція, кристалізація) навіть при прийнятих технологічних режимах. Хімічні реакції, як правило, зворотні в тому відношенні, що в залежності від умов вони можуть перебігати як в прямому, так і в зворотному напрямі. Проте в умовах виробництв багато хімічних реакцій практично незворотні. Наприклад, реакція, яка проходить при гасінні вапна
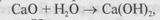
практично незворотна. Незворотним є також багато складних реакцій, які уявляють собою сукупність ряду стадій. Наприклад, реакція бродіння
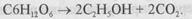
В гетерогенних системах зворотними називають такі процеси, в яких можливий перехід речовини або енергії (теплоти) як із однієї фази в іншу, так і навпаки. Всі зворотні хіміко-технологічні процеси проходять як правило поблизу стану рівноваги та наближаються або прямують до рівноваги, при якій швидкості прямого та зворотного процесів вирівнюються, в результаті чого співвідношення компонентів у взаємодіючій системі залишається незмінним, поки не зміняться зовнішні умови. При зміні температури, тиску або концентрації одного з компонентів рівновага порушується і в системі самочинно проходять дифузійні та хімічні процеси, які ведуть до відновлення рівноваги в нових умовах. До хімічної рівноваги можливо вжити другий закон термодинаміки в загальному виді, тобто однією із умов хімічної рівноваги в ізольованій системі є максимум ентропії S. Подальший приріст ентропії обов'язковий для всіх самочинних процесів в стані рівновагий, не проходить, тобто dS = 0.
Закономірності рівноваги дозволяють визначити лише максимально можливий (теоретичний) вихід продукту. Проте теоретичний вихід у виробничих умовах звичайно не досягає через зменшення сумарної швидкості різних перетворень (хімічних,
біохімічних та інших
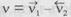 за мірою зниження величини рухомої сили. В незворотних процесах, тобто при v = 0, швидкістьреакції прямує до нуля
за мірою зниження величини рухомої сили. В незворотних процесах, тобто при v = 0, швидкістьреакції прямує до нуля 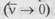 при повному витраченні одного з початкових реагентів. В зворотних процесах (v
при повному витраченні одного з початкових реагентів. В зворотних процесах (v 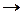 0) при
0) при
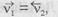 тобто при досягненні рівноваги. Наприклад, швидкість технологічного процесу по цільовому продукту при хімічних перетвореннях є результуючою швидкістю прямої, зворотної та побічних
тобто при досягненні рівноваги. Наприклад, швидкість технологічного процесу по цільовому продукту при хімічних перетвореннях є результуючою швидкістю прямої, зворотної та побічних
реакцій, а також дифузії початкових речовин в зону реакції та продуктів із цієї зони.
Вплив основних параметрів технологічного режиму на рівновагу в гомогенних та геторогених системах визначається принципом Ле-Шателье, який визначає другий закон термодинаміки. В системі, виведеної зовнішніми діями із стану рівноваги, проходять зміни, спрямованні на послаблення дій, які виводять систему з рівноваги. Для прикладу розглянемо використання принципу Ле-Шательє до екзотермічної оеакітії синтезу

 - кількість молей речовин А, В та D;
- кількість молей речовин А, В та D;
Q — тепловий ефект реакції. Позначаючи об'єми речовин через v, припустимо, що реакція йде зі зменшенням об'єму, тобто
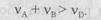
исновні умови, які впливають на кількість одержаного продукту, — температура t, тиск Р та концентрація С (співвідношення в реакційному об'ємі) реагуючих речовин СА, СВ і CD. Для зрушення рівноваги вправо, тобто збільшення кількості продукту (підвищення рівноваги виходу), відповідно з принципом Ле-Шателье необхідно понизити температуру t та концентрацію продукту С, тобто вивести продукт із реакційної зони, а також збільшити тиск Р та концентрації початкових речовин СА і СВ в рекційній зоні. При чому підвищення СА буде сприяти більш повному перетворенню речовин, а також підвищенню СВ, тобто сприяти більш повному перетворенню речовини А. Ці обставини використовують в харчовій промисловості, наприклад, при випічці мучних кондитерських виробів з бездріжджевого тіста для його розпушення використовують хімічну реакцію між лимонною кислотою та содою
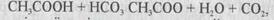
и poj^jibictii лкиї виділиться вуглекислий газ, який розпушує тісто. Реакція повинна проходити при надлишку соди, тобто присутність кислоти, яка погіршує якість тіста, небажана.
В гетерогенних екзотермічних процесах абсорбція якого-не-будь компоненту газової суміші рідиною відповідно з принципом Ле-Шательє рівноважна концентрація газу в рідині або рівноважна ступінь абсорбції газового компоненту (вихід продукту) збільшується при зниженні температури та підвищенні загального тиску, а також при зменшенні парціального тиску поглиненого
компоненту над рідиною. Зменшення парціального тиску над рідиною може бути досягнене при виведенні продукту із зони абсорбції. Наприклад, осадження його у вигляді твердих кристалів. Підвищення концентрації (парціальний тиск) поглинаємого компоненту в суміші збільшує рівноважну концентрацію його в рідині, але степінь абсорбації може не з мінюватись.
Розчинність кристалічних речовин в рідині відповідно з принципом Ле-Шателье підвищується з підвищенням температури, якщо цей процес є ендотермічним, оскільки енергія, яка витрачається на руйнування кристалічних ґраток, більше теплоти
сільвації молекул.
Константа рівноваги служить кількісною мірою встановлення рухомої рівноваги та визначається взагалі як величина термодинамічна. Проте її можна одержати також із закону дії мас, згідно з яким швидкість діючої реакції в даний момент часу прямо пропорціональна добутку молярних концентрацій реагуючих речовин. Для реакції синтезу швидкість прямої реакції
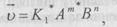
А швидкість зворотної реакції
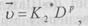
— константи швидкостей прямої та зворотної реакцій;
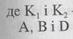 — молярні концентрації (або парціальні тиски) реагуючих компонентів в даний момент часу, тобто величини, змінні в часі. Константа рівноваги К обчислюється як відношення константи швидкості прямої пеакції до зворотної при рівновазі, тобто при рівності
— молярні концентрації (або парціальні тиски) реагуючих компонентів в даний момент часу, тобто величини, змінні в часі. Константа рівноваги К обчислюється як відношення константи швидкості прямої пеакції до зворотної при рівновазі, тобто при рівності
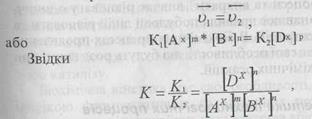
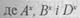 - концентрації або парціальні тиски реагуючих компонентів в стані рівноваги. Для газів константу рівноваги можна виразити через парціальні тиски реагуючих компонентів Рі, кон-Центоашї компонентів Сі (наприклад, в моль/
- концентрації або парціальні тиски реагуючих компонентів в стані рівноваги. Для газів константу рівноваги можна виразити через парціальні тиски реагуючих компонентів Рі, кон-Центоашї компонентів Сі (наприклад, в моль/ 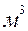 ) та нарешті через
) та нарешті через
їх мольні частки Ni. Відповідно одержують константи рівноваги, які позначують Кр, Кс, Кn. Вони пов'язані між собою рівняннями
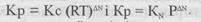
Де p- загальний тиск газової суміші;
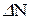 — приріст числа молей газів після реакції.
— приріст числа молей газів після реакції.
Для модельної реакції

Для одержання безрозмірних значень константи рівноваги в формулу підставляють відносні величини. Наприклад, відношення дійсних парціальних тисків до стандартних, рівним 0,1 МПа. Для розчинів користуються мольними концентраціями, або ж концентраціями іонів. Рівняння для обчислення рівноваги не годиться, оскільки рівноваги концентрацій звичайно не відомі і визначаються тільки при відомих початкових концентраціях. Чисельні значення констант рівноваги для різних реакцій визначаються дослідами або розраховуються аналітично в залежності від температури та тиску, наведено у вигляді таблиць, номограм в довідниках. Для їх визначення за дослідними даними константи виражають через вихід продукту.
Використовуючи принцип Ле-Шательє до конкретних процесів, можна встановити величину зміни параметрів, які необхідні для виміру стану системи.
Використовуючи правило фаз Гібса
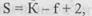
можна встановити кількість змінних (число ступенів свободи S), які визначають рівновагу системи при числі компонентів системи K та числі
фаз f
Дисципліна "Процеси та апарати" вивчає рівновагу одиничних процесів та встанавлює правила побудови ліній рівноваги та ліній робочих концентрацій. В біохімічних процесах проявлення законів рівноваги має свої особливості, які будуть розглянуті при аналізі кінетики біохімічних реакцій.






