Лабораторная работа № 6
«Определение коэффициента поверхностного натяжения методом Ребиндера»
Цель работы: Используя измерительную установку определить коэффициент поверхностного натяжения. Рассмотреть сущность физического явления поверхностного натяжения.
.
Вопросы теории (исходный уровень):
Сущность физического явления поверхностного натяжения. Коэффициент поверхностного натяжения и методы его определения. Капиллярные явления, их значение в биологических системах. Газовая эмболия.
(самостоятельная подготовка)
Содержание занятия:
1. Выполнить работу по указаниям в руководстве к данной работе.
2. Оформить отчет.
3. Защитить работу с оценкой.
4. Решить задачи.
Задачи.
1. Чему равен коэффициент поверхностного натяжения скипидара, если с помощью пипетки, диаметр кончика трубки которой 1,2 мм, его можно дозировать каплями по 0,01 г?
2. При переливании крови капельным методом необходимо было поддерживать частоту 40 капель в минуту. Какого диаметра должен быть кончик трубки капельницы, чтобы 250 мл крови перелить за 1,5 ч?
3. 3. В кровеносном сосуде образовался пузырек воздуха. В результате течения крови пузырек воздуха деформировался, образовав поверхности с радиусами кривизны 0,1 и 0,5 мм. Определить дополнительное давление в сосуде, возникающее в результате деформации пузырька воздуха.
4. В кровеносном сосуде образовалась цепочка из четырех пузырьков воздуха. Под действием давления крови р пузырьки деформировались, образовав поверхности с радиусами кривизны R, r1 и r2 (r1 = r2 = r; R > r). Определить дополнительное давление, обусловившее закупорку сосуда.
5. Определить плотность воздуха в пузырьке радиусом 5× 10-3 мм , находящемся в артерии, давление крови в которой равно 100 мм рт. ст., а температура 370 С. Атмосферное давление считать нормальным.
Лабораторная работа № 6.
«Определение коэффициента поверхностного натяжения методом Ребиндера»
Приборы и принадлежности: 1) установка для определения поверхностного натяжения; сосуды объемом 50 см3 с дистиллированной водой, растворы хлорида натрия.
Силы, действующие на молекулы поверхностного слоя со стороны молекул, расположенных ниже этого слоя, значительно превосходят силы, действующие на поверхностный слой со стороны молекул воздуха. Поэтому молекулы поверхностного слоя втягиваются внутрь жидкости. Для перемещения молекул из жидкости на ее поверхность требуется совершить работу, т. е. поверхностный слой обладает потенциальной энергией. Любое изменение поверхности требует затрат энергии, называемой поверхностной. Работа, требуемая для образования единицы такой поверхности, называется поверхностным натяжением а и измеряется в системе СИ в Дж/м2. Поверхностный слой жидкости всегда ограничен линией возможного разрыва и находится под действием указанных сил в постоянном натяжении, стремящемся сократить поверхность. Сокращение поверхности возможно при условии, если силы поверхностного натяжения будут касательны к поверхности и перпендикулярны к линии возможного разрыва. Отсюда следует второе определение: коэффициент поверхностного натяжения а равен силе, рассчитанной на единицу длины линии возможного разрыва. Единицы его измерения в системе СИ — Н/м, в СГС — дин/см. Анализ размерностей показывает равнозначность этих единиц: Дж/м2 = Н • м/м2 = Н/м.
Поверхностное натяжение является важнейшей характеристикой поверхности раздела фаз. Под действием поверхностного натяжения небольшие количества жидких сред стремятся принять шарообразную форму, соответствующую наименьшей величине поверхности. Приближение к шаровой форме достигается тем больше, чем слабее силы тяжести. У малых капель сила поверхностного натяжения значительно превосходит силу тяжести. С поверхностным натяжением связаны диспергирование (измельчение, распыление) твердых тел и жидкостей на малые частицы или капли, коалесценция (слияние капель или пузырьков в эмульсиях, туманах, пенах), коагуляция (агрегирование частиц дисперсной фазы). Все эти явления связаны с образованием новых поверхностей, требующим затраты энергии.
Капиллярные явления также объясняются поверхностным натяжением. Поверхностное натяжение определяет форму клеток и их частей. Изменение сил поверхностного натяжения влияет на фагоцитоз (захват клетками соседних частиц), пиноцитоз (захват клеточной поверхностью жидкости с содержащимися в ней ществами). Поверхностное натяжение различных веществ колеблется от 10 до 2000 эрг/см2, у клеток оно не превышает 100 эрг/см2. С ростом температуры поверхностное натяжение уменьшается и при критической температуре обращается в нуль. Растворенные в жидкости вещества способны как понижать, так и несколько повышать поверхнЪстное натяжение. Растворенные вещества, понижающие поверхностное натяжение жидкости, называют поверхностно-активными веществами (ПАВ).
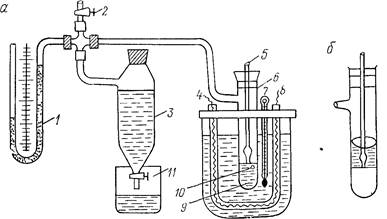
Рис. 18
Существует несколько способов определения поверхностного натяжения жидкостей. В данной работе описан метод определения максимального давления в пузырьке, который состоит в следующем.
В исследуемую жидкость 9, находящуюся в сосуде 6 (рис. 18,а), вертикально опускается капиллярная трубка 5, узкий конец которой диаметром не больше 0,5 мм касается
мениска исследуемой жидкости. Другим концом эта трубка сообщается с атмосферным воздухом. При закрытом кране 2 и открытом кране 11 вытекающая из сосуда 3 вода понижает давление над исследуемой жидкостью. При некотором давлении р над поверхностью исследуемой жидкости из конца капиллярной трубки 5 под действием разности атмосферного давления ро и давления р выдавливается в жидкость воздушный пузырек 10.

Рис. 19
Разность давлений ро-р измеряемая манометром, равна pgΔh, где ρ— плотность манометрической жидкости, Δh—разность ее уровней. Разность давлений уравновешивается давлением р1, обусловленным поверхностным натяжением жидкости и гидростатическим давлением р2. Так как глубина погружения кончика капилляра мала, то р2~0. Тогда давление, возникающее под действием сил поверхностного натяжения, равно разности давлений, измеряемой манометром 1:
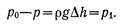 (1)
(1)
Найдем давление p1. Рассечем произвольно пузырек воздуха радиусом R горизонтальной плоскостью на две части (рис. 19). Граница раздела — окружность радиусом r: В результате действия сил поверхностного натяжения верхняя часть пузырька притягивается нижней. При этом на каждый элемент длины dl пограничной линии действует сила dF = adl, направленная по касательной к поверхности пузырька. Найдем элементарную силу давления:
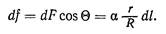
Интегрируя эту величину по всей длине пограничной линии, получим полную силу нормального давления:
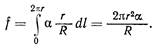
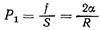 (2)
(2)
Так как сечение выбрано произвольно, то расчет давления справедлив в любой точке пузырька. Из формулы (2) видно, что давление р1 может быть большим в капиллярах малого радиуса. Из формул (1) и (2) следует, что
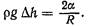 (3)
(3)
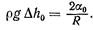 (4)
(4)
Если вместо исследуемой жидкости в сосуд б налить эталонную жидкость, например дистиллированную воду, коэффициент поверхностного натяжения а которой известен, то можно записать
Разделив уравнение (3) на (4) и решив его относительно а, получим выражение для определения поверхностного натяжения исследуемой жидкости
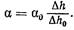
В медицинской практике часто приходится определять поверхностное натяжение на границе двух несмешивающихся жидкостей. Поверхностное натяжение в данном случае удобнее всего определять методом максимального давления в пузырьке: капиллярную трубку 5 погружают так, чтобы узкий конец ее касался поверхности раздела двух несмешивающихся жидкостей (рис. 18, б). В этом случае следует учитывать гидростатическое давление жидкости, расположенной сверху, которое не будет равным нулю.
Порядок работы
Определение поверхностного натяжения раствора хлорида натрия. Налив в сосуд дистиллированной воды при комнатной температуре, находят Δh0. Затем наливаем в сосуд 5%-ый раствор хлорида натрия, находим Δhc. По табличным значениям а 0 и найденным величинам Δh0 и Δhc определяют а c. Повторяем опыт для 10%, 15%, x% растворов. Полученные данные заносятся в таблицу 1. При комнатной температуре можно исследовать зависимость, а c от концентрации раствора и убедиться в том, что с ростом концентрации хлорида натрия коэффициент поверхностного натяжения а cувеличивается. По построенному градуировочному графику, графическим методом найдите неизвестную концентрацию x% раствора.
Таблица 1
| Определяемые величины | Примечания | |||||||||
| Δhc | a0 | Δh0t | ||||||||
| a c |
Особенности молекулярного строения жидкостей
Обычные жидкости изотропны, структурно они являются аморфными телами. Для внутреннего строения жидкостей характерен ближний порядок в расположении молекул (упорядоченное расположение ближайших частиц). Расстояния между молекулами невелики, силы взаимодействия значительны, что приводит к малой сжимаемости жидкостей: небольшое уменьшение расстояния между молекулами вызывает появление больших сил межмолекулярного отталкивания.
Подобно твердым телам, жидкости мало сжимаемы и обладают большой плотностью, подобно газам, принимают форму сосуда, в котором находятся. Такой характер свойств жидкостей связан с особенностями теплового движения их молекул. В газах молекулы движутся беспорядочно, на малых отрезках пути — поступательно, в расположении частиц отсутствует какой-либо порядок. В кристаллических телах частицы колеблются около определенных положений равновесия — узлов кристаллической решетки. По теории Я. И. Френкеля молекулы жидкости, подобно частицам твердого тела, колеблются около положений равновесия, однако эти положения равновесия не являются постоянными. По истечении некоторого времени, называемого временем «оседлой жизни», молекула скачком переходит в новое положение равновесия на расстояние, равное среднему расстоянию между соседними молекулами.
Вычислим среднее расстояние между молекулами жидкости. Можно мысленно представить весь объем жидкости разделенным на небольшие одинаковые кубики с ребром 5. Пусть в среднем в каждом кубике находится одна молекула. В этом случае 5 можно рассматривать как среднее расстояние между молекулами жидкости. Объем жидкости равен V = &3N, где N — общее количество молекул жидкости. Если п — концентрация молекул (количество молекул в 1 м3), то N = nV. Из этих уравнений получаем
(7.18)
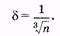
|
Порядок величины 6 составляет 10 10 м, например, для воды 5 = 3 -10-10м.
.
Среднее время «оседлой жизни» молекулы называют временем релаксации т. С повышением температуры и понижением давления время релаксации сильно уменьшается, что обусловливает большую подвижность молекул жидкости и меньшую ее вязкость.
Для того чтобы молекула жидкости перескочила из одного положения равновесия в другое, должны нарушиться связи с окружавшими ее молекулами и образоваться связи с новыми соседями. Процесс разрыва связей требует затраты энергии Еа (энергии активации), выделяемой при образовании новых связей. Такой переход молекулы из одного положения равновесия в другое является переходом через потенциальный барьер высотой £а. Энергию для преодоления потенциального барьера молекула получает за счет энергии теплового движения соседних молекул. Зависимость времени релаксации от температуры жидкости и энергии активации выражается формулой, вытекающей из распределения Больцмана (см. § 2.4).

|
(7.19)
где т0 — средний период колебаний молекулы около положения равновесия.
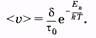
|
Зная среднее перемещение молекулы, равное расстоянию между молекулами 5, и среднее время т, можно определить среднюю скорость движения молекул в жидкости:
(7.20)
Эта скорость мала по сравнению со средней скоростью движения молекул в газе. Так, например, для молекул воды она в 20 раз меньше, чем для молекул пара при той же температуре.
Поверхностное натяжение
На поверхностях раздела жидкости и ее насыщенного пара, двух несмешиваемых жидкостей, жидкости и твердого тела возникают силы, обусловленные различным межмолекулярным взаимодействием граничащих сред.
Каждая молекула, расположенная внутри объема жидкости, равномерно окружена соседними молекулами и взаимодействует с ними, но равнодействующая этих сил равна нулю. На молекулу, находящуюся вблизи границы двух сред, вследствие неоднородности окружения действует сила, не скомпенсированная другими
|
молекулами жидкости. Поэтому для перемещения молекул из объема в поверхностный слой необходимо совершить работу.
Поверхностное натяжение (коэффициент поверхностного натяжения) определяется отношением работы, затраченной на создание некоторой поверхности жидкости при постоянной температуре, к площади этой поверхности:
(7.21)
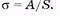
Условием устойчивого равновесия жидкостей является минимум энергии поверхностного слоя, поэтому при отсутствии внешних сил или в состоянии невесомости жидкость стремится иметь минимальную площадь поверхности при данном объеме и принимает форму шара.
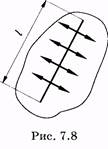
Поверхностное натяжение может быть определено не только энергетически. Стремление поверхностного слоя жидкости сократиться означает наличие в этом слое касательных сил — сил поверхностного натяжения. Если выбрать на поверхности жидкости некоторый отрезок длиной I (рис. 7.8), то можно условно изобразить эти силы стрелками, перпендикулярными отрезку.
Поверхностное натяжение равно отношению силы поверхностного натяжения к длине отрезка, на котором действует эта сила:
(7.22)
Из школьного курса физики 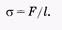 известно, что оба определения, (7.21) и (7.22), тождественны. Приведем значения поверхностного натяжения для некоторых жидкостей при температуре 20 °С (табл. 15).
известно, что оба определения, (7.21) и (7.22), тождественны. Приведем значения поверхностного натяжения для некоторых жидкостей при температуре 20 °С (табл. 15).
Таблица 15
| Жидкость | а, Н/м | Жидкость | а, Н/м |
| Вода | 0,0725 | Ртуть | 0,47 |
| Желчь | 0,048 | Спирт | 0,022 |
| Молоко | 0,05 | Сыворотка крови | 0,06 |
| Моча | 0,066 | Эфир | 0,017 |
Поверхностное натяжение зависит от температуры. Вдали от критической температуры значение его убывает линейно при увеличении температуры. Снижения поверхностного натяжения можно достигнуть введением в жидкость поверхностно-активных веществ, уменьшающих энергию поверхностного слоя.






