Цель работы:
1) изучение первого начала термодинамики в различных изопроцессах;
2) экспериментальное определение показателя адиабаты для воздуха.
Схема экспериментальной установки

1 – сосуд с воздухом;
2 – насос;
3 – манометр;
4 – пробка;
5 – линейка
Теория метода
Рассмотрим подробнее два заключительных процесса: адиабатическое расширение 3-4 и изохорическое нагревание 4-5. Для первого из них запишем уравнение адиабаты:
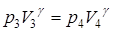 , (1)
, (1)
где  – показатель адиабаты, представляющий собой отношение теплоемкости газа при постоянном давлении Ср к его теплоемкости при постоянном объеме CV .
– показатель адиабаты, представляющий собой отношение теплоемкости газа при постоянном давлении Ср к его теплоемкости при постоянном объеме CV .
Учитывая, что в состоянии 4 давление воздуха в сосуде равно атмосферному (р 4 = р 1), а объем имеет то же значение, что и в конечном состоянии 5 (V 4 = V 5), перепишем (1) в виде
 . (2)
. (2)
Температура воздуха в состояниях 3 и 5 одинакова и равна температуре окружающей атмосферы Т 1 . Воспользовавшись уравнением изотермы
 ,
,
находим
 ,
,
и уравнение (2) принимает вид
 ,
,
откуда показатель адиабаты
 . (3)
. (3)
Преобразуем знаменатель дроби в правой части выражения (3)
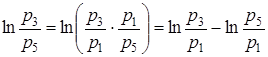 , (4)
, (4)
а также величины давлений р 3 и р 5 (см. рис. 2):
 ;
;
тогда
 . (5)
. (5)
Таким образом, величины D рI и D рII несоизмеримо малы по сравнению с р 1 , и отношения

Используем известное в математике соотношение, имеющее место при малых х (х << 1):
ln(1 + x)» x.
Тогда выражения (5) и (4) преобразуются к виду
 ;
;
 ,
,
а их подстановка в (3) дает
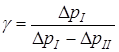 . (6)
. (6)
Перепад давлений D р прямо пропорционален разности D h уровней воды в коленах манометра. С учетом этого выражение (6) примет вид
 , (7)
, (7)
где
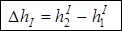 ; (8)
; (8)
 ; (9)
; (9)
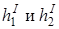 – высота уровня воды в закрытом (на схеме – левом) и открытом (правом) коленах манометра после изохорического охлаждения, т.е. в состоянии 3;
– высота уровня воды в закрытом (на схеме – левом) и открытом (правом) коленах манометра после изохорического охлаждения, т.е. в состоянии 3;  – то же, после изохорического нагревания (состояние 5).
– то же, после изохорического нагревания (состояние 5).
Ход работы
| Номер опыта |  , мм , мм
|  , мм , мм
| D hI , мм |  , мм , мм
|  ,
мм ,
мм
| D hII , мм | g | D g | (D g)2 |
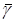 = =
| s = |
Порядок измерений и обработки результатов
1. Откройте сосуд 1 с воздухом, вынув пробку 4. Дождавшись установления постоянных одинаковых уровней воды в манометре 3, закройте сосуд.
2. Вращая рукоятку насоса 2, следите за манометром. По достижении разности уровней около 15-20 см прекратите накачивать воздух.
3. Наблюдайте показания манометра в течение двух-трех минут (разность уровней должна уменьшаться). После установления неизменной разности уровней измерьте и занесите в таблицу значения 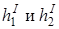 . Рассчитайте по формуле (8) и запишите в таблицу перепад D hI .
. Рассчитайте по формуле (8) и запишите в таблицу перепад D hI .
4. Вынув пробку, откройте и быстро закройте сосуд. Следите за показаниями манометра (разность уровней должна увеличиваться). Выждав две-три минуты до установки постоянного перепада давлений, измерьте и занесите в таблицу значения  ; по формуле (9) рассчитайте и запишите установившуюся разность уровней D hII .
; по формуле (9) рассчитайте и запишите установившуюся разность уровней D hII .
5. Повторите измерения, описанные в пп. 1-4, еще девять раз.
6. Для каждого из десяти проведенных опытов вычислите по формуле (7) и занесите в таблицу значения показателя адиабаты g.
7. Найдите среднее значение показателя адиабаты 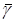 . Выполните все расчеты, необходимые для оценки случайной погрешности определения величины g. Задаваясь доверительной вероятностью a = 0,95, рассчитайте погрешность D sg.
. Выполните все расчеты, необходимые для оценки случайной погрешности определения величины g. Задаваясь доверительной вероятностью a = 0,95, рассчитайте погрешность D sg.
8*. Определите абсолютную приборную ошибку прямого измерения высоты уровней воды в манометре d h, а также относительные ошибки
 .
.
9*. Найдите абсолютную приборную погрешность косвенного измерения показателя адиабаты dg. Для этого, если потребуется, используйте формулу
 .
.
10. Оцените полные абсолютную D и относительную Е погрешности. Сделав необходимые округления, запишите окончательный результат измерения показателя адиабаты (отношения теплоемкостей) воздуха.
Контрольные вопросы
1. Каков смысл внутренней энергии идеального газа с точки зрения молекулярно-кинетической теории?
2. Дать определения удельной и молярной теплоемкостей. В каких единицах они измеряются и какова связь между ними?
Молярная теплоёмкость — отношение теплоёмкости к количеству вещества, теплоёмкость одного моль вещества (Дж/(моль·К))
Удельная теплоёмкость — отношение теплоёмкости к массе, теплоёмкость единичной массы вещества (Дж/(кг·К))
Связь с удельной теплоёмкостью:
С=M*с, где с — удельная теплоёмкость, М — молярная масса
3. Какой процесс называется адиабатическим? Чему равна работа при адиабатическом процессе?
Адиабатический процесс – термодинамический процесс в макроскопической системе, при котором система не обменивается теплотой с окружающим пространством.
δA = -dU
4. Произведите вывод уравнения Пуассона для адиабаты.
Поскольку для адиабатического процесса dQ = 0, то δA = - dU. Следовательно, p·dV = - (m/m)·Cv·dT (10). Следовательно, работа газа при адиабатическом расширении равна A1-2 = (m/m)·Cv·(T1 - T2) (11). Выразив величину P из уравнения Менделеева-Клапейрона и подставив ее в (10), после соответствующих преобразований получим уравнение адиабаты: p·Vɤ = const.
5. Чему равна величина отношения  для одно-, двух-, трехатомных газов согласно молекулярно-кинетической теории теплоемкости идеальных газов?
для одно-, двух-, трехатомных газов согласно молекулярно-кинетической теории теплоемкости идеальных газов?
Одноатомные: 3
Двухатомные жесткие: 5
Двухатомные упругие: 7
Трехатомные: 6
6. Вывести уравнение Майера. В чем заключается физический смысл универсальной газовой постоянной?
Cp = CV + R.
Универсальная газовая постоянная численно равна работе расширения одного моля идеального одноатомного газа в изобарном процессе при увеличении температуры на 1 К.
7. Что такое степень свободы? Показать, что  .
.
Число степеней свободы определяет минимальное количество независимых переменных (обобщённых координат), необходимых для полного описания движения механической системы.






