Теоретическое введение
При кипении жидкости происходит ее испарение. При этом поглощаемая теплота расходуется на преодоление сил взаимодействия между молекулами в жидкости. Связь между теплотой испарения жидкости, температурой и давлением насыщенного пара выражается уравнением Клаузиуса-Клапейрона в дифференциальной форме:

где Р – давление насыщенного пара, Т – термодинамическая температура;  − мольная теплота испарения; R – универсальная газовая постоянная.
− мольная теплота испарения; R – универсальная газовая постоянная.
Интегральная форма уравнения Клаузиуса-Клапейрона будет:
 , (21)
, (21)
где В – постоянная интегрирования.
 Уравнение (21) является уравнением прямой линии. Имея ряд экспериментальных значений зависимости давления насыщенного пара жидкости от температуры, можно построить график в координатах ln Р = f (1/Т). Соответствующий график показан на рис. 7.
Уравнение (21) является уравнением прямой линии. Имея ряд экспериментальных значений зависимости давления насыщенного пара жидкости от температуры, можно построить график в координатах ln Р = f (1/Т). Соответствующий график показан на рис. 7.
По тангенсу угла наклона прямой находят мольную теплоту испарения жидкости:
 ;
; 
Постоянная интегрирования имеет простой физический смысл. Если взять Т = Т кип и Р = 1 атм, то  = const ∙ R = =
= const ∙ R = =  . Таким образом,
. Таким образом,  и уравнение (21) приобретает вид
и уравнение (21) приобретает вид
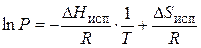 . (22)
. (22)
Зная мольную теплоту испарения жидкости, находят ее удельную теплоту испарения:
 , (23)
, (23)
где l исп – удельная теплота испарения; М – молярная масса жидкости.
Отношение теплоты к температуре в изотермическом процессе равно изменению энтропии. Следовательно, изменение энтропии при испарении жидкости
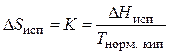 , (24)
, (24)
где  − изменение энтропии при испарении 1 моля жидкости; К – постоянная Труттона;
− изменение энтропии при испарении 1 моля жидкости; К – постоянная Труттона;  − температура кипения жидкости при нормальном давлении.
− температура кипения жидкости при нормальном давлении.
По значению удельной теплоты испарения жидкости можно найти еще одну величину – эбуллиоскопическую константу:
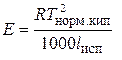 . (25)
. (25)
Работа 1
Определение давления насыщенного пара
индивидуальной жидкости
Цель работы: ознакомление с методикой определения давления насыщенного пара жидкости и расчет некоторых термодинамических величин.
Теоретические основы работы
(см. теоретическое введение)
Эксперимент выполняется на установке, схема которой показана на рис. 8.
 |
Приборы и материалы: колба с исследуемой жидкостью, вакуумметр, электронагреватель с водяной баней, водоструйный насос.
Порядок выполнения работы
1. Поместить колбу с исследуемой жидкостью на водяную баню так, чтобы уровень водяной бани был выше уровня исследуемой жидкости в колбе.
2. Открыть кран 1, при закрытом кране 2 и водоструйным насосом 3 создать в системе разряжение до отметки на вакуумметре 75 − 80, что соответствует 0,25 − 0,20 атм. Если установка герметична, то стрелка вакуумметра должна держаться на постоянном уровне. В противном случае надо найти место подсоса и добиться герметичности (смазать шлифы, проверить все соединения в установке).
3. Осторожно пустить воду в холодильник от водопроводного крана 4. Включить электронагреватель и следить за жидкостью в колбе. Когда начнется интенсивное кипение жидкости, записать ее температуру кипения и показания вакуумметра Р В.
4. Осторожно открыть кран 2, соединяющий прибор с атмосферой, чтобы давление увеличилось приблизительно на 0,1 атм, и аналогично измерить температуру кипения при новом давлении.
Таким образом, давление доводят до атмосферного, сделав 10 – 12 отсчетов.
5. Результаты опытов занести в табл. 9 и показать преподавателю.
Таблица 9
| Опыт | t, 0С | Т, К | 1/Т | Показания вакуумметра Р В | Давление в колбе Р К = (1- Р В), атм. | ln Р К |
| . . . и т.д. |
6. На миллиметровой бумаге построить график, отложив на оси ординат ln Р, а на оси абсцисс – 1/Т. По уравнениям (21 – 24) рассчитать молярную и удельную теплоту испарения жидкости, постоянную Труттона и эбуллиоскопическую константу для изученной жидкости.
Контрольные вопросы
1. Что называется насыщенным паром?
2. Что характеризует уравнение Клаузиуса-Клапейрона?
3. Как определить константы уравнения Клаузиуса-Клапейрона?
4. Какой физический смысл константы интегрирования в уравнении Клаузиуса-Клапейрона?
5. Что характеризует эбуллиоскопическая константа и в каких единицах измерения выражается?
6. Что характеризует постоянная Труттона?
Физико-химический анализ
Теоретическое введение
Физико-химическим анализом называется раздел химии, занимающийся изучением превращений в равновесных химических системах посредством физических и геометрических методов.
В физико-химическом анализе исследуются как гомогенные, так и гетерогенные системы. Различные свойства системы (давление, температура, плотность и др.) изображаются в зависимости от состава системы на диаграммах состав – свойство. Диаграммы, выражающие зависимость давления и температуры от состава системы, носят названия диаграмм состояния. Частным случаем диаграмм состояния являются диаграммы плавкости. На осях ординат диаграмм плавкости откладываются температуры начала кристаллизации расплавов различного состава.

На рис. 9 показаны диаграммы состояния некоторых двухкомпонентных систем: а − с простой эвтектикой (компоненты А и В не вступают в химическое взаимодействие); б – вещества А и В образуют конгруэнтно плавящееся химическое соединение; в – компоненты взаимодействуют с образованием инконгруэнтно плавящегося химического соединения; г – диаграмма с непрерывным рядом твердых растворов.
Основные руководящие принципы в физико-химическом анализе - непрерывности и соответствия.
Принцип непрерывности. При непрерывном изменении параметров, определяющих состояние системы, свойства ее изменяются также непрерывно, но при условии, что не возникают новые фазы и не исчезают наличные.
Принцип соответствия. Каждой фазе или комплексу фаз равновесной термодинамической системы на диаграмме соответствует определенный геометрический образ.
При анализе диаграмм состоянии широко используется правило фаз, которое записывается как
 ,
,
где С – число степеней свободы, или вариантность состояния системы; К - число компонентов; Ф – число фаз. Если давление или объем системы постоянные, то правило фаз имеет иной вид
 .
.
Число степеней свободы показывает, сколько параметров можно менять, не изменяя числа фаз в системе и не нарушая ее равновесия.
 При экспериментальном изучении солевых и других систем большое распространение получили визуально-политермический и термографический методы анализа.
При экспериментальном изучении солевых и других систем большое распространение получили визуально-политермический и термографический методы анализа.
Визуально-политермический метод
Схема установки визуально-политерми-ческого метода приведена на рис. 10. Тигель 1 с исследуемыми веществами помещается в шахтную электропечь 2. При нагревании вещества плавятся, после чего расплав равномерно охлаждают. При появлении первых кристалликов в расплаве отмечают показания милливольтметра 3, к которому подключена термопара 4. Холодные спаи термопары помещают в сосуд Дьюара 5 и термостатируют. Далее по градуировочному графику милливольты переводят в градусы.
Если исследуемые вещества имеют относительно невысокую температуру плавления, то вместо термопары можно использовать высокотемпературный термометр.
Термографический метод
Сущность метода заключается в записи на автоматических приборах кривых охлаждения или нагревания расплавов в координатах температура – время. Типичные кривые охлаждения для двойной системы с простой эвтектикой даны на рис. 11.
 |
Для расплавов 1, 2, 6 число степеней свободы при температуре кристаллизации равно нулю и процесс кристаллизации этих расплавов протекает при постоянной температуре – кривые охлаждения имеют горизонтальные отрезки. При охлаждении расплавов 3, 4, 5 начальная кристаллизация происходит с одновременным понижением температуры до эвтектической, поскольку имеется одна степень свободы. Горизонтальные участки кривых охлаждения при эвтектической температуре Те тем больше, чем ближе расплав по составу к эвтектическому.
Работа 1






