Теплоемкостью называется количество теплоты, подведенное к системе некоторой массы, увеличивающее температуру этой системы на некоторую величину. Различают истинную и среднюю теплоемкость, а также молярную и удельную. Истинная теплоемкость – это дифференциально малое количество теплоты, подведенное к системе, увеличивающее температуру этой системы на дифференциально малую величину. Средняя теплоемкость – это количество теплоты, подведенное к системе, увеличивающее температуру этой системы на 1 К. Молярная теплоемкость – это теплоемкость вещества массой 1 моль. Удельная теплоемкость – это теплоемкость вещества массой 1 кг.
Величину теплоемкости можно определить как по справочным данным, так и экспериментальными методами. Одним из таких методов является метод смешения. Метод смешения заключается в том, что два вещества (вода и исследуемое вещество) приводятся в термический контакт. В результате теплообмена система приходит в тепловое равновесие, при котором температуры обоих веществ выравниваются. Если такой процесс провести в калориметрической установке, то к системе применимо уравнение теплового баланса.
Определение теплоемкости вещества осуществляется в две стадии: определение тепловой константы пробирки К (опыт 1) и определение теплоемкости исследуемого вещества (опыт 2).
В опыте 1 в результате теплообмена между нагретой пробиркой и калориметром с водой система приходит в тепловое равновесие, при котором температуры пробирки, калориметра и воды выравниваются. К системе тогда применимо уравнение теплового баланса:
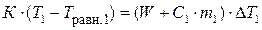 , (9)
, (9)
где К – тепловая константа пробирки для исследуемого вещества, Дж/К; Т 1 – начальная температура пробирки, равная температуре термостата, К; Т равн.1 – температура пробирки после установления равновесия, К (Т равн.1= Т 2 + Δ Т 1 (граф)) – температура в калориметре после теплообмена между нагретой пробиркой и водой, К; Т 2 – температура среды, измеренная в конце опыта, К; W - тепловая константа калориметра, Дж/К; С1 – удельная теплоемкость воды, Дж/(кг∙К); m 1 – масса воды, залитой в калориметр, кг; Δ Т 1 – изменение температуры в результате опыта, найденное графически, К.
В опыте 2 в уравнении теплового баланса учитываются теплоемкость и масса нагретого исследуемого вещества:
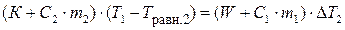 , (10)
, (10)
где С2 – теплоемкость исследуемого вещества, Дж/(кг∙К); m 2 – масса навески исследуемого вещества, кг; Т равн.2 – температура пробирки с веществом после установления равновесия, К (Т равн.2 = Т 3 + Δ Т 2 (граф)) – в калориметре после теплообмена между нагретой пробиркой и водой; Т 3 – температура среды, измеренная в конце опыта, К; Δ Т 2 – изменение температуры в результате теплообмена, найденное графически, К.
Приборы и материалы: термостат, калориметр, термометр Бекмана, мешалка, секундомер, аналитические весы, мерная колба, контейнер (стеклянный сосуд из толстого стекла), дистиллированная вода, исследуемое вещество.
Порядок выполнения работы
1. Получить от преподавателя задание по виду и количеству исследуемого вещества.
2. Включить термостат и нагреть его до Т 1 = 50 0С.
3. Поместить в термостат две одинаковых пробирки, используемых в двух опытах: одну пустую, а другую – с навеской исследуемого вещества на 15-20 мин.
4. Тем временем установить в калориметр термометр Бекмана и мешалку. Залить 60 мл дистиллированной воды комнатной температуры (объем измерить мерным цилиндром).
5. Перемешивая воду, записывать через 1 минуту показания термометра Бекмана в течение 7 – 10 мин до равновесного значения температур. Не прерывая отсчета времени, на 8 – 11 мин от начала опыта поместить в калориметре пробирку, нагретую в термостате. Продолжить отсчет времени еще 10 мин.
6. После окончания отсчетов измерить температуру воды в калориметре обычным термометром Т2. По результатам опыта построить график изменения температуры и определить графически Δ Т 1.
7. Используя уравнение теплового баланса (9), рассчитать в опыте 1 тепловую константу пробирки.
8. Провести второй опыт с навеской вещества, помещенного во вторую пробирку, в соответствии с пп. 4 и 5. В конце опыта измерить температуру среды Т 3 обычным термометром. По результатам опыта построить график изменения температуры и определить графически Δ Т 2.
9. По результатам опыта рассчитать среднюю теплоемкость исследуемого вещества по уравнению (10).
10. Использовать для расчетов следующие справочные величины:
W = 14,6 Дж/К; С 1 – 4,18∙103 Дж/(кг∙К).
Контрольные вопросы
1. Что называется теплоемкостью?
2. Что называется истинной и средней теплоемкостью? Как они связаны между собой?
3. Что называется удельной и молярной теплоемкостью?
4. В чем сущность метода смешения?
5. За счет чего устанавливается тепловое равновесие?
6. Для каких целей определяется тепловая константа пробирки?
Химическое равновесие
Теоретическое введение
Химические реакции в большинстве случаев протекают не до конца, а до определенного состояния, называемого химическим равновесием. Химическое равновесие характеризуется следующими общими признаками: неизменяемость системы во времени при неизменных внешних условиях; подвижность равновесия; динамичность равновесия; возможность подхода к состоянию равновесия с двух сторон, минимальное значение энергии Гельмгольца F, энергии Гиббса G и максимальное значение энтропии S системы при постоянстве их естественных переменных.
Применяя к химическим реакциям уравнения, вытекающие из второго закона термодинамики, можно получить очень важные для технологической практики ответы: возможна ли данная реакция; каков будет предельный выход продуктов реакции.
Одной из основных закономерностей в учении о химическом равновесии является закон действия масс.
Рассмотрим в общем виде химическую реакцию, протекающую в разбавленном растворе:
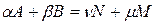 ,
,
где α, β, ν, μ – стехиометрические коэффициенты; А, В, N, М – участники реакции. Тогда закон действия масс запишется так:
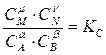 , (11)
, (11)
где К С − константа равновесия; Сi – равновесные парциальные концентрации участников реакции.
Константа равновесия К С связывает между собой парциальные концентрации продуктов реакции и исходных веществ в состоянии равновесия химической реакции. При неизменных внешних условиях константа равновесия данной реакции является величиной постоянной.
В зависимости от того, подчиняется или нет изучаемая реакция законам идеальных газов или растворов и в каком агрегатном состоянии находятся участники реакции, в уравнении (11) вместо концентраций будут подставляться равновесные парциальные давления Р A,B,N,M, активности аi или летучести fi участников реакции.
Для реакции, протекающей в газовой фазе и подчиняющейся законам идеальных газов, константа равновесия выражается через равновесные парциальные давления:
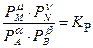 ,
,
где К Р − константа равновесия; Рi – равновесные парциальные давления участников реакции.
Константы равновесия К С и К Р связаны между собой следующим соотношением:
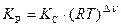 ,
,
где Δ ν – изменение числа моль газообразных участников реакции.
Изменение энергии Гиббса химической реакции при постоянных давлении и температуре описывается уравнением изотермы химической реакции:
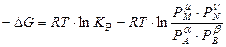 , (12)
, (12)
где Δ G – изменение энергии Гиббса; Рi –парциальные давления участников реакции для исходного состояния реакции.
Если исходные парциальные давления участников реакции соответствуют стандартным условиям, то уравнение (12) принимает вид:
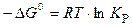 , (13)
, (13)
где 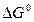 − стандартное изменение энергии Гиббса; R – универсальная газовая постоянная, R = 8,314 Дж/(моль∙К).
− стандартное изменение энергии Гиббса; R – универсальная газовая постоянная, R = 8,314 Дж/(моль∙К).
Уравнение (13) позволяет сравнивать состояние равновесия различных химических реакций при стандартных условиях, рассчитывать по изменению энергии Гиббса константы равновесия, а следовательно, и предельный выход продуктов реакции. Кроме того, уравнение (13) выражает собой стандартное химическое сродство 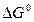 реакции.
реакции.
Константа равновесия зависит от температуры. Эта зависимость математически представляется при постоянном давлении уравнением изобары, а при постоянном объеме – уравнением изохоры реакции.
Уравнение изобары реакции в дифференциальной форме записывается:
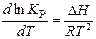 ,
,
где Δ Н – изменение энтальпии, или изобарный тепловой эффект реакции.
Интегральные формы этого уравнения:
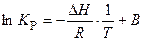 ,
,
где В – постоянная интегрирования;
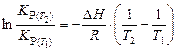 . (14)
. (14)
Здесь 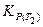 − константа равновесия при температуре Т 2;
− константа равновесия при температуре Т 2; 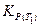 − константа равновесия при температуре Т 1.
− константа равновесия при температуре Т 1.
Зная константы равновесия при двух температурах, по уравнению (14) можно рассчитать изобарный тепловой эффект этой реакции:
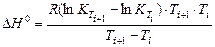 , (15)
, (15)
где R – универсальная газовая постоянная, R = 8,314 Дж/(моль∙К).
РАБОТА 1






