Особой формой загрязнения биосферы служат радиоактивные вещества и создаваемые ими ионизирующие излучения.
До середины ХХ века наиболее распространенными источниками радиации, воздействующими на человека и все живое, были естественные: космические лучи, а также радиоактивные вещества, находящиеся в земной коре. В разных регионах Земли уровень природной радиации сильно различается, увеличиваясь в десятки и сотни раз в районах месторождений урановых руд, радиоактивных сланцев и других. Сегодня основными источниками радиоактивного загрязнения биосферы являются антропогенные факторы: испытания ядерного оружия, аварии на атомных электростанциях и подводных лодках и т.д. Радиоактивные вещества используются во многих промышленных производствах, в медицине для лечебных, диагностических и научных целей.
Радиоактивные изотопы – элементы, атомы которых имеют одинаковое число протонов, но разное число нейтронов. Все изотопы химических элементов образуют группу радионуклидов.
Радиация представляет собой поток различных видов излучения, образующихся в процессе радиоактивного распада и вызывающих ионизацию окружающей среды (образование положительно и отрицательно заряженных ионов). Ионизирующее излучение существует в течение всего периода существования Земли, оно распространяется в космическом пространстве. Влияние источников ионизирующего излучения на организм человека начало исследоваться после открытия явления радиоактивности в 1896 г. французским физиком Анри Беккерелем, а затем исследовано Марией и Пьером Кюри, которые в 1898 году пришли к выводу, что излучение радия является результатом его превращения в другие элементы. Характерным примером такого преобразования является цепная реакция превращения урана-238 в стабильный нуклид свинца-206, что сопровождается высвобождением энергии, которая затем передается в виде излучений (а, β, γ). Альфа-излучение является потоком положительно заряженных ядер гелия, бета-излучение – поток отрицательно заряженных быстрых электронов и гамма-излучение – коротковолновое излучение электромагнитной природы. Превращение элементов идет до тех пор, пока не образуется стабильный изотоп свинца.
Открытию Беккереля и исследованию Кюри предшествовало открытие неизвестных лучей, которые в 1895 году немецкий физик Вильгельм Рентген назвал Х-лучами, а в дальнейшем в его честь названы рентгеновскими.
Распад каждого вида радионуклидов идет с различной скоростью. Время, за которое распадается половина массы данного нуклида, называется физическим периодом полураспада. Физические периоды полураспада значительно различаются. Для оценки последствий испытаний ядерного оружия, чернобыльской катастрофы практическое значение имеет знание периодов полураспада основных радионуклидов, загрязняющих различные территории: Cs137 – 30 лет (γ-излучение); Sr190 – 29 лет (γ-излучение); Zn95 – 64 суток; Rn220 – 3,8 суток; I131 – 8 суток; С14 – 5730 лет.
Разные виды излучения обладают различной проникающей способностью: α-частицы могут распространяться на расстояние от нескольких сантиметров в воздухе до нескольких миллиметров в тканях и задерживаются листом бумаги; β-частицы проникают в покровы человеческого тела на 2 см; γ-излучение наиболее опасно, распространяется очень быстро на сотни метров со скоростью света и задержать его может только свинцовая плита.
Для измерения степени радиационной опасности используются следующие показатели: экспозиционную дозу, поглощенную дозу и эквивалентную дозу, измеряемые определенными единицами. В радиобиологии с 1984 г. приняты единицы системы СИ.
Экспозиционная доза для оценки гамма- и рентгеновского облучения.
1 рентген – единица экспозиционной дозы и рентгеновского излучения.
Поглощенная доза – это количество энергии ионизирующего излучения, поглощенной единицей массы организма или какого-либо физического тела, зависит от вида облучения.
1 грей (Гр) – единица поглощенной дозы в системе СИ, 1 Гр = 1 Дж/кг.
1 рад – внесистемная единица поглощенной дозы, 1 рад = 0,01 Гр.
Эквивалентная доза учитывает неодинаковую радиационную опасность для организма разных видов ионизирующего излучения. Эквивалентная доза равна поглощенной дозе, умноженной на коэффициент для каждого вида облучения.
1 зиверт (Зв) – единица эквивалентной дозы в системе СИ. 1 Зв соответствует поглощенной дозе в 1 Дж/кг для рентгеновского, бета- и гамма-излучений.
1 бэр – биологический эквивалент рентгена, 1 бэр = 0,01 Зв.
Эффективная эквивалентная доза отражает суммарный эффект облучения для организма. Определяют путем умножения эквивалентных доз на соответствующие виду ионизирующего облучения коэффициенты и суммированная по всем органам и тканям. Измеряется в зивертах.
В расчетах, определяющих риск для человеческих популяций развития отдаленных последствий облучения, применяется понятие генетически значимая доза. Она представляет собой 40 % от коллективной эквивалентной дозы, так как принято считать, что 40 % популяции – это люди детородного возраста и генетические последствия облучения могут быть реализованы только через эту группу.
Ионизирующее излучение может оказывать влияние на организм как при внешнем (особенно рентгеновское и гамма-излучение), так и при внутреннем облучении. От естественных источников человек получает дозу – 2 мЗв в год. Наибольшую долю естественных источников составляют земные источники, причем 5/6 всей радиации от них приходится на внутреннее облучение. Оно осуществляется от попадающих в организм радионуклидов (с пищей, водой, при вдыхании, через поврежденную и здоровую кожу) и представляет большую опасность, так как попавшие внутрь источники ионизирующего излучения подвергают непрерывному облучению ничем не защищённые внутренние органы.
После аварии на Чернобыльской атомной электростанции (ЧАЭС) Cs-137 оказался наиболее радиоэкологически значимым в силу своей летучести распространившийся на огромные расстояния от места аварии. Территории России, подвергшиеся радиоактивному загрязнению составляют общей площадью 147 тыс. км2, население – 2,4 млн. человек, в том числе 783, 7 тысяч детей (рисунок 10).
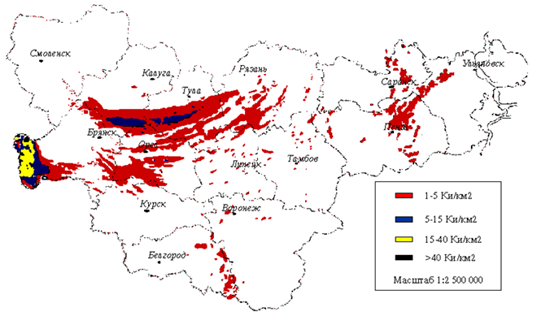
Рис. 10. Плотность загрязнения цезием -137 на территории России
На пострадавших в результате аварии на ЧАЭС территориях РФ, включающих Брянскую, Калужскую, Тульскую, Орловскую, Ленинградскую, Смоленскую, Тамбовскую, Липецкую, Белгородскую, Воронежскую, Пензенскую, Ульяновскую и Челябинскую области, Алтайский край, Красноярский край реализуется федеральная целевая программа «Преодоление последствий радиационных аварий на период 2011-2015 годы».
Мониторинг доз облучения населения, проживающего на загрязненных территориях, позволяет сделать вывод, что в настоящее время превышение норматива среднего годового облучения населения в 1 мЗв (вследствие аварии на ЧАЭС) регистрируется в 321 населенном пункте Брянской и 2 населенных пунктах Калужской областей. Накопленные дозы облучения у абсолютного большинства проживающих на загрязненных территориях в настоящее время не превышают установленного норматива 70 мЗв (за 70 лет жизни).
Однако, до настоящего времени учреждениями Роспотребнадзора периодически регистрируется превышение гигиенических нормативов в дикорастущей пищевой продукции (ягоды, грибы, рыба местных закрытых водоемов, дичь), а также в продукции из личных подсобных хозяйств (молоко) в Брянской и Калужской областях. В Брянской области за 2010 год 8% исследованных проб вышеуказанных видов продукции, превышали гигиенические нормативы, по её юго-западным районам этот показатель достигает 12%.
Концентрация радионуклидов в почве ЦЧР не создаёт угрозы для урожая: содержание цезия-137, стронция-90 в пищевых продуктах, произведённых на территориях, пострадавших после аварии на Чернобыльской АЭС в 1986 году, не превышает норм СанПина. Годовая доза облучения на каждого жителя Центрального Черноземья соответствует среднему показателю по РФ. Почти 90% радиоактивных излучений, входящих в вышеуказанную дозу, исходит от природных источников, и только 10% – от объектов и предметов медицины, последствия Чернобыльской аварии составляют всего 0,1%.
Радиоактивные изотопы попадают сначала в почву, оттуда – в растения, а затем – в домашний скот, при этом их концентрация возрастает (рисунок 11). Стронций-90 – химический аналог кальция, поступает с растительной пищей (особенно со злаками), молоком, сыром, творогом, накапливается в костной ткани человека и фиксируется в ней, это может привести к лейкозу или опухоли кости. Цезий-137 попадает в организм человека с мясом и растительной пищей. Как аналог калия равномерно распределяется в тканях, но концентрируется в мышцах, печени, половых железах, создавая тем самым очаги постоянного облучения, что может привести к возникновению лучевой болезни с различными формами ее проявления. Цезий-137 относительно легко выводится из организма (период полувыведения 65-100 суток), поэтому он менее опасен, чем стронций-90 (В.В. Маркина, 2006).
Особенности накопления радиоактивных элементов в организме человека представлены на рисунке 12.
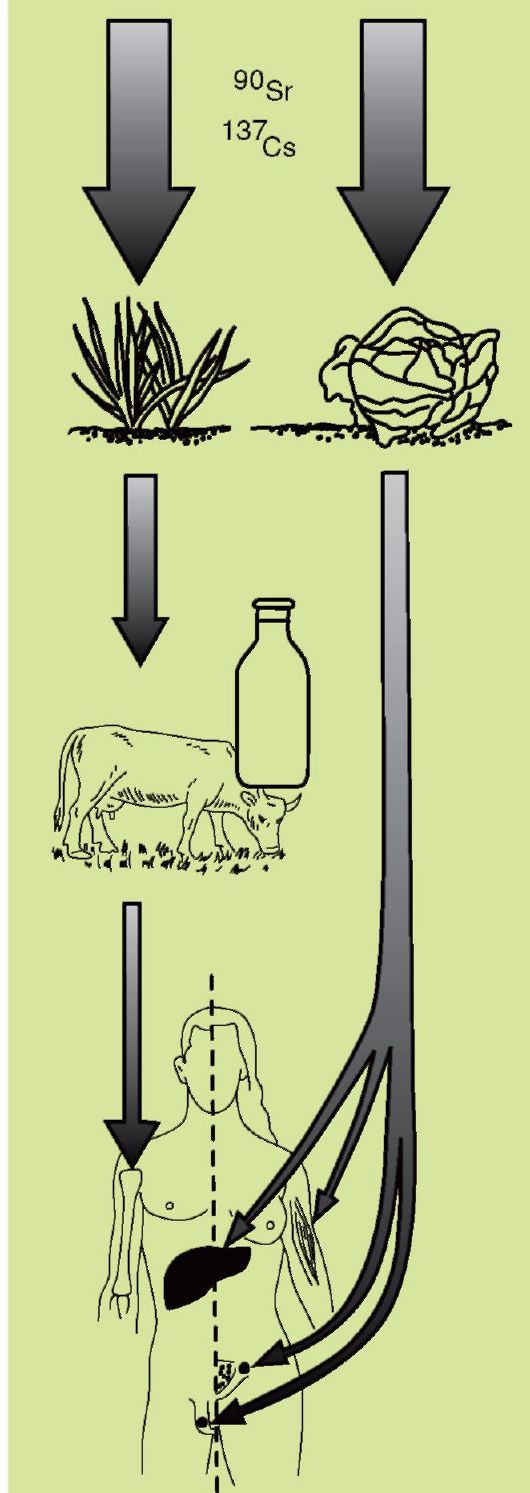

| Рис. 21. Накопление радиоактивных элементов в организме человека |
| Рис. 12. Накопление радиоактивных элементов в организме человека (по В.С. Савенко, 1997). |
| Рис. 11. Модель переноса и накопления радиоактивных изотопов стронция-90 и цезия-137 (П. Фабр, 1976, с изменениями В.В. Маркина, 2006). |
Время, за которое удаляется из организма половина попавшего нуклида, называется биологическим периодом полураспада. Эффект от сочетания физического и биологического периодов полураспада называется эффективным периодом полураспада.
Во внутреннем облучении велика значимость такого радионуклида, как радон (газ, смесь изотопов Rn220 и Rn222), который может попадать в организм из земной коры, из строительных материалов (гранит, мрамор, известняк, кальций – силикатный шлак, кирпич из красной глины и др.), из воды и газа.
Ионизирующее излучение является реальным мощным экологическим фактором, воздействующим на все живое, оно обладает общебиологическим действием: является сильным мутагенным фактором; подавляет процессы эмбриогенеза, механизмы, регулирующие процессы дифференцировки; снижает регенераторную способность, иммунную защиту организма; ускоряет процессы старения, укорачивает продолжительность жизни.
Мерой радиочувствительности является доза облучения, вызывающая гибель 50 % клеток или организмов за определенный промежуток времени – ЛД50/время. У разных биологических объектов этот показатель может отличаться в десятки, сотни, тысячи раз.
Радиочувствительность зависит от:
ü объема и структуры генома: чем больше ДНК, чем сложнее ее структура, тем радиочувствительность выше (у бактерий ЛД50 – 1800 Гр, у человека – 2,5 Гр);
ü активности ферментов репарации;
ü уровня антиоксидантов;
ü количества предшественников радиотоксинов;
ü способности организма (органа, клеток, ткани) накапливать радиоактивные вещества;
ü уровня процессов пролиферации (активно пролиферирующие ткани называются критическими, например, клетки эпителия, кроветворная ткань);
ü времени суток (ночью выше);
ü величины дозы излучения и характера его действия (прерывистое действие излучения снижает радиочувствительность по сравнению с однократным: однократное облучение обусловливает 100 %-ую гибель при 10 Гр, прерывистое – 100 %-ую при 85 Гр);
ü периода онтогенеза: особенно высока радиочувствительность в критические периоды внутриутробного развития (оплодотворение, имплантация, органогенез), постнатального развития (новорожденность, первый год жизни, пубертатный возраст, старение);
ü фазы клеточного цикла (G1-период высокорадиочувствителен, S-фаза — устойчива).
Радиационное поражение клетки проходит ряд этапов:
ü первичные радиационно-физические процессы (образование свободных радикалов, радиационное повреждение углеводов, липидов, радиационное поражение нуклеиновых кислот);
ü радиационное поражение биохимических процессов, опосредованное усиление радиационного эффекта;
ü вторичное поражение генома;
ü гибель клетки.
Помимо прямого влияния, ионизирующее излучение оказывает на ткани также косвенное воздействие, выражающееся в радиолизе воды и последующем накоплении в организме атомов или групп атомов, обладающих высокой химической активностью – свободных и перекисных радикалов. Такие радикалы изменяют в клетках баланс кальция, увеличивают проницаемость мембран, нарушают биосинтез белков, что сказывается на активности различных ферментов, нарушается обмен веществ, происходят изменения в составе крови – снижается уровень эритроцитов, лейкоцитов, тромбоцитов и нейтрофилов. Свободные и перекисные радикалы вовлекают в процесс повреждения даже те молекулы, которые не затронуты прямым действием радиации. Производимый излучением эффект создается не столько количеством поглощенной энергии, сколько формой, в которой эта энергия передается.
Радиационно-химическое превращение липидов приводит к изменению структуры и функций всех мембран, в результате чего нарушаются такие процессы в клетке, как транспорт ионов, биоэнергетические процессы, репликация ДНК, синтез белка и другие, происходят выход ферментов из лизосом и вторичное поражение клетки. При высоких дозах могут быть инактивированы системы антиоксидантов.
Как при тотальном, так и при частичном облучении организма во всех его тканях и органах возникают и развиваются во времени процессы, индуцированные излучением. Они могут принимать разные формы и разную интенсивность на уровне каждой ткани, но на уровне организма все эти процессы интегрируются, формируя конечный результат облучения (таблица 17).
Таблица 17.
Действие радиации на организм человека (В.В. Маркина, 2006)
| Форма облучения, доза | Немедленные реакции организма | Отдаленные последствия |
| I. Острое облучение Очень большие дозы 1-10 кЗв Большие дозы 4-6 Зв Средние дозы 2-4 Зв Небольшие дозы 1 Зв | Смерть от поражения ЦНС Смерть Тяжелая лучевая болезнь (50% смерть) Лучевая болезнь средней тяжести Легкое недомогание | Сокращение сроков жизни, снижение иммунитета, роста, поражение ЦНС. Радиационный канцерогенез (лейкемия, рак легких, молочной железы). Бесплодие. Наследственные пороки развития, эмбриональная гибель, наследственные болезни |
| II. Хроническое облучение Доза накапливается. Действие зависит от дозы и промежутков между облучениями | Смерть от тяжелой лучевой болезни Лучевая болезнь. |
Вместе с тем чувствительность к ионизирующему излучению (радиочувствительность) различна у разных видов живых организмов, организмов одного и того же вида, разных тканей и органов одного организма. Особенно чувствительны к действию ионизирующего излучения ткани с высокой степенью пролиферации: костный мозг, эпителий кишечника, клетки половых желез (рисунок 13).

Рис. 13. Чувствительность организма человека к ионизирующему излучению
Большую роль в развитии прямых и опосредованных эффектов облучения играют низкомолекулярные продукты различной химической природы, объединяемые под общим названием «радиотоксины». Действие радиотоксинов проявляется в следующем: в малых дозах они усиливают синтез ДНК, воздействуя на мембраны, активируя цАМФ, взаимодействуя с белками-репрессорами; в больших дозах тормозят синтез ДНК, угнетают деление клетки, вызывают хромосомные аберрации, генные мутации, пикноз (сморщивание) ядер, понижают устойчивость биологических мембран, активность мембранно-связанных ферментов.
Характер действия радиотоксинов на живые клетки имитирует действие самого ионизирующего излучения, т.е. они обладают широким действием и принимают активное участие во вторичном поражении генома и мембран клеток.
Малые дозы ионизирующего излучения вызывают радиобиологические эффекты, противоположные характеру воздействия больших доз:
ü стимулируют рост, развитие, плодовитость, неспецифический иммунитет, общую сопротивляемость организма;
ü их воздействие осуществляется через регуляторные механизмы генетических и мембранных структур;
ü играют важную роль пусковых механизмов, при этом эффект мало зависит от количества поглощенной энергии и увеличивается при облучении дробными дозами (аккумуляция).
Кроме того, следует подчеркнуть беспороговость действия малых доз ионизирующего излучения на разные системы организма, способность к накоплению дозы и как следствие проявление в виде отдаленных эффектов: вегетососудистой дистонии, увеличение щитовидной железы, изменение иммунного статуса, сочетанные поражения сердца, легких, мозга, желудочно-кишечного тракта, увеличение вероятности возникновения опухолей, мертворождений, выкидышей (В. Т. Найда и др. 1994; Т.И. Траверсе, 1994; Г. В. Римарчук, 1994). Исследование состояния здоровья людей, проживающих в местностях, получивших умеренные радиоактивные загрязнения после чернобыльского взрыва, или отселенных из зон интенсивного загрязнения, показывает, что основной причиной таких болезней является срыв адаптационных механизмов. Поэтому наибольшее распространение получают так называемые стресс-зависимые болезни. Характерными являются также иммунодефициты, в связи с чем и большая подверженность инфекциям, острым респираторным заболеваниям (Г.В. Архангельская, 1993). Вместе с тем многие исследователи отмечают рост числа опухолевых заболеваний кроветворных органов и щитовидной железы (В.Г. Найда, 1994; С.В. Петренко, 1990), изменение показателей периферической крови (Л.Н. Acтахова, 1991; Т.Н. Лазюк и др., 1990).
При сочетании ионизирующего излучения с другими экологическими факторами возможны разные реакции комбинирований действия:
ü аддитивность (суммирование эффектов от каждого из факторов независимо от последовательности действия);
ü синергизм (результат совместного действия превосходит эффект, ожидаемый от суммированного воздействия);
ü сенсибилизация (потенцирование, усиление эффектов факторами, которые сами по себе эффекта не вызывают).
Эти виды сочетанного действия должны учитываться при анализе тяжести радиобиологического эффекта. К числу факторов, усиливающих радиационное поражение, относятся:
ü повышение температуры окружающей среды;
ü высокое содержание кислорода в тканях, усиливающее первичное поражение, но облегчающее пострадиационное восстановление;
ü воздействие ультразвука, мутагенов, ядов, канцерогенных факторов.
Описанное явление находит применение в медицине при лечебном совместном использовании ионизирующего излучения и цитостатиков (препаратов, вызывающих апоптоз злокачественных клеток), излучения и гипертермии для лечения опухолей, при использовании любых средств, снижающих содержание в тканях кислорода (адреналина, нитрита натрия, морфина, цианидов), для ослабления поражающего действия ионизирующего излучения.
Отдаленные последствия воздействия ионизирующей радиации на организм проявляются прежде всего:
ü в изменении продолжительности жизни;
ü в увеличении частоты возникновения злокачественных опухолей;
ü в росте числа генетических болезней.
Для животных достоверно доказано сокращение продолжительности жизни в результате воздействия ионизирующей радиации. Для человека доказать такую закономерность трудно из-за недостатка количества наблюдений. Однако и нет оснований отрицать факт сокращения сроков жизни, так как в организме после облученияпроисходит ряд необратимых явлений, которые неизбежно должны привести к более раннему старению:
ü нерепарируемые повреждения ДНК;
ü ослабление систем иммунитета;
ü дегенеративные изменения в эндокринной системе;
ü усиление склеротических процессов и др.
Доказано, что воздействие ионизирующего излучения на организм людей ведет к повышению риска опухолевых болезней. Установлено, что ионизирующее излучение может выступать в роли стимулирующего фактора на всех этапах канцерогенеза (возникновения и развития злокачественной опухоли):
ü в фазе инициации опухолевого роста (мутации в соматических клетках, трансформация клетки в потенциально опухолевую) вследствие поглощения лучевой энергии генетическими структурами клетки; в первую очередь это касается регуляторных генов, в том числе и латентного онкогена (проонкогена), и происходит как за счет непосредственного поражения его радиоактивным излучением, так и за счет нарушений стабильности генома, перемещения мобильных диспергированных генов (прыгающих генов);
ü в фазе промоции (усиление роста опухоли) в качестве пускового механизма деления;
ü на всех этапах канцерогенеза в качестве фактора, снижающего иммунный контроль.
Несмотря на то, что изучать генетические последствия облучения у людей сложно, уже накоплен материал, показывающий что:
ü доза в 1 Зв является удваивающей дозой (т.е. число мутаций возрастает в 2 раза по сравнению с воздействием естественного радиоактивного фона);
ü мутирование начинается при дозе 0,1 Р/сут (0,001 Зв);
ü летальные мутации начинают обнаруживаться уже при дозах 0,2 – 1 мР/ч (0,002 – 0,01 мЗв).
Знание основных патогенетических механизмов развития лучевого поражения на последовательных этапах позволяет разработать в каждом конкретном случае стратегию пострадиационного восстановления организма:
а) в период острого радиационного поражения, нарастания радиационно-физических и радиационно-химических процессов:
ü перехват и инактивация радикалов;
ü создание условий, благоприятных для работы ферментов репарации ДНК (введение коферментов);
ü создание условий, благоприятных для восстановления молекул ДНК (введение субстратов для синтеза);
ü выведение радиотоксинов;
ü создание гипотермии;
ü создание гипоксии;
б) в период вторичных нарушений биохимических процессов и опосредованного усиления радиационного эффекта, вторичного поражения генома и мембран:
ü перехват и создание условий для выведения радиотоксинов или условий, препятствующих их образованию;
ü ослабление активности протеаз и нуклеаз;
ü введение антиоксидантов или создание условий для их активации;
ü создание условий для ускорения синтеза и переноса липидов;
в) в период гибели радиочувствительных популяций клеток:
ü активация деления резервного пула (например, стимуляция кроветворения);
ü активация процессов регенерации;
ü введение сингенных (генетически сходных) клеток заменителей;
г) в случае усиления радиационного поражения генома при сочетанном воздействии других физических и химических факторов:
ü удаление физических и химических факторов, усиливающих радиобиологический эффект;
ü использование физических и химических факторов, ослабляющих радиобиологический эффект.




