Для очистки сточных вод от растворимых примесей прим-т пр-сы анодного окисления и катодного восстановления и эликтролиза. Анодное окисление и катодное восстановление. Рис
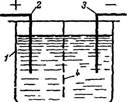 Рис.1. Схема электролизера:1 - корпус; 2 - анод; 3 - катод; 4 - диафрагма
Рис.1. Схема электролизера:1 - корпус; 2 - анод; 3 - катод; 4 - диафрагма
В электролизере на аноде ионы отдают электроны, т.е. протекает р-ция электрохимич окисления, на катоде происх присоединение электронов, т.к. р-ция восстановления. Эти процессы разработаны для очистки сточных вод от цианидов, нитросоединений, спиртов, альдегидов и др в-в. В качестве анодов исп-ют различные электролитические нерастворимые материалы(графит, магнетит, диоксиды свинца, марганца), кот наносят на титановую основу. Катоды изготовляют из молибдена, сплавы железа или никеля, вольфрама, нержав сталь покрытых молибденом, вольфрама. Анодное окисление цианидов. Реакции | CN-+2ОН- -2e-→CNO-+H2O. | CN-+H2O→NH4+ CО32-
- Окисление цианид-иона до цианат -иона
Вредные цианиды CN-' переходят в безвредную форму - цианат-ион CNO-. Окисление может быть проведено до образования чистого азота и углекислого газа(СО2) 2CNO- +4OH- -6e→2CO2+N2+6H2O
Для повышения эл.проводности сточных вод и снижения расхола эл. энергии к сточным водам добавляют натрий хлор, разрушение цианидов происходит не только в рез-те ЭХ окисления, но и в рез-те окисления хлором, кот образ-ся на аноде из ионов хлора. NaCl→Na++Cl- 2 Cl- -2е→С12+Н2О; CN-+Cl2+2OH-→CNO-+2Cl-+H2O;
2CNO- +3Cl2+4OH-→2CO2+N2+6Cl- +2Н2O.
. Пример катодного восстановления. Катодное восстановление применяют для удаления из сточных вод ионов металлов Pb2+, Sn2+, Hg2+, Сu2+, As 3+, Сг6+ Катодное восстановление металлов протекает по схеме Меn++ ne-+Ме°.
Металлы осаждаются на катоде и могут быть рекуперированы
Электродиализ
Процесс очистки сточных вод электродиализом основан на разделении ионов под действием электродвижущей силы, создаваемой в растворе по обе стороны мембран. Этот процесс используют для опреснения соленых вод и его начали применять для очистки промышленных сточных вод. Процесс проводят в электродиализаторах, которые состоят из трех камер, отделенных одна от другой мембранами (рис.6.2, а). В среднюю камеру заливают раствор, а в боковые камеры с электродами - чистую воду. На аноде выделяется кислород и образуется кислота. Одновременно катионы переносятся в катодное пространство. По мере прохождения эл.тока. конц-я солей в ср. камере уменьшается до тех пор пока не станет близкой к нулю. За счет диффузии в ср камеру поступают ионы Н+ и ОН- С боковых камер образуя воду этот пр-с замедляет перенос ионов солей к соотве-им электродам.
В электродиализаторе с ионитовыми мембранами (рис. 6.2, б) имеются две мембраны. Анионообменная мембрана пропускает в анодное пространство анионы. Катионообменная мембрана расположена со стороны катода и пропускает в катодное пространство только катионы.
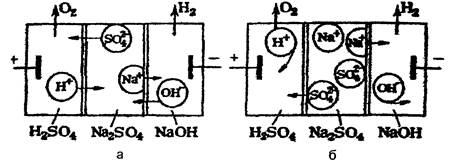
Рис. 6.2. Схемы электродиализаторов с пористыми диафрагмами (а) и ионитовыми мембранами (б)
При исп ионообменных мемран повыш-ся эффективность процесса очистки и сниж-ся расход эл.энерпги.
Термические методы. Подраздел на 2 группы: 1.коонцентрирование сточных вод; 2. термоокислительные методы: 2.1.окисление органических в-в в присутствия катализатора при атмосферном и повышенном давлении; 2.2, жидкофазное окисление органических в-в;2.3.огенвое обезвреживание. Концентрирование сточной воды исп-ют в основном для обезвреживания минеральных сточных вод. Метод позволяет отделить от сточных вод соли с получением условно чистой воды, пригодной для оборотного водоснабжения. Процесс разделения минеральных в-в и воды м.б. проведен в 2 стадии: стадия концентрирования, стадия получения сухих в-в. Коннотрированис сточ. вод м.б. проведено в испарит-х, выморажив-их и кристаллогидратных устан-х непрерв\ывного и переодич дей-я.
Испарительные установки. В промышленных условиях наиболее распространены выпарные установки концентрирования растворов. Для этой цели используют одноступенчатые и многоступенчатые выпарные установки с выпарными аппаратами различной конструкции.
Выпарные установки состоят из основных элементов - выпарных аппаратов (испарителей) и вспомогательного оборудования - конденсаторов, самоиспарителей, теплообменников, насосов и др.
Установки вымораживания. Процесс вымораживания заключается в том, что при температуре ниже температуры замерзания чистая вода образует кристаллы пресного льда, а рассол с растворенными в нем солями размещается в ячейках м/у этими кристаллами.
Температура замерзания рассола всегда ниже температуры замерзания чистой воды и зависит от концентрации растворенных элей.
Процесс вымораживания проводят при режимах медленного переохлаждения (образуются сравнительно крупные игольчатые кристаллы со значительно меньшим включением рассола, при оттаивании получается менее минерализованная вода).
Вымораживание можно производить либо под вакуумом, либо при помощи специального холодильного агента (хладоны). Хладагенты: аммиак, диоксид углерода, бутан, пропан, изобутан, хладоны (CCI2F2, CCI3F,CCIF3 и их оксиды).
Кристаллогидратные установки. Процесс состоит в концентрировании сточной воды с применением гидратообразующего агента М (пропан, хлор, хладоны, диоксид углерода и др.) и образовании кристаллогидратов М nН2О. При переходе молекул воды в кристаллогидраты концентрация растворенных веществ в воде повышается. При плавлении кристаллов образуется вода, из которой выделяются пары гидратообразующего агента. Процесс гидратобразования может проходить при температуре ниже и выше температуры окружающей среды. В первом случае необходимо применение холодильных установок, во втором - нет.
Для выделения веществ из концентрированных растворов используют методы кристаллизации и сушки.
Термоокислительные методы обезвреживания (деструктивные методы очистки)
При использовании термоокислительных методов все органические вещества, загрязняющие сточные воды, полностью окио пяются кислородом воздуха при высоких температурах до нетоксичных соединений. К этим методам относят метод жидкофазного зкисления, метод парофазного каталитического окисления и пла-иенный или "огневой" метод.
Термоокислительные методы: парофазные, жидкофазные и парофазные каталитические.
Парофазное каталитическое окисление. Применяют парофазное окисление обычно при очистке сточных вод с высоким содержанием органических веществ. В ряде случаев количества органики достаточно, чтобы процесс сжигания проходил без использования дополнительного топлива. Сжигание таких стоков осуществляют обычно в печах камерного типа при 900-1100 °С. Если концентрация органических веществ недостаточна для горения, то сточные воды сжигают в газовой печи (циклонного типа). В пламя, образуемое при сжигании природного газа в кислороде воздуха, впрыскивают через - форсунки сточную воду. Температурам пламени поддерживается в диапазоне 900-1100°С. Процесс протекает весьма интенсивно в паровой фазе в присутствии медно-хромового, цинк-хромового, медно-марганцевого или другого катализатора.
Жидкофазное окисление. Метод жидкофазного окисления основан на окислении органических веществ, растворенных в воде, кислородом при температурах 100-350 °С и давлениях 2-28 МПа. При высоких давлениях растворимость в воде кислорода значительно возрастает, что способствует ускорению процесса окисления органических веществ
Летучие вещества окисляются в основном в парогазовой фазе, а нелетучие в жидкой фазе.
Метод начинают использовать для очистки сточных вод в азотной, нефтеперерабатывающей, целлюлозно-бумажной и других отраслях промышленности.
Огневой метод. Является наиболее эффективным и универсальным из термических методов. Сущность его заключается в распылении сточных вод непосредственно в топочные газы, нагретые до 900-1000 °С. При этом вода полностью испаряется, а органические" примеси сгорают. Содержащиеся в воде минеральные вещества образуют твердые или оплавленные частицы, которые улавливают в циклонах или фильтрах.
Метод может быть использован для обезвреживания небольшого объема сточных вод, содержащих высокотоксичные органические вещества, очистка от которых другими методами невозможна или не эффективна.
12. Нормативы качества воды водных объектов(смотреть 1 вопрос!!!без ПДС,только ПДВ и ОДУ рассказать)
13. Нормативы для источников сброса сточных вод. ПДКВ, ЛПВ.(смотреть ещё 1 вопрос!!!Про ПДС!!!)
Вкус воды обусловлен присутствием химических соединений (NaCL, солей Fe, Mn, Мg и др), продуктами жизнедеятельности водных организмов и веществами сточных вод, ядохимикатами.
Выделяют четыре вида вкуса: соленый, горький, сладкий, кислый. Остальные вкусовые ощущения - привкусы.
Предельно допустимая концентрация (ПДК, мг/л) - это максимальная концентрация вещества в воде, в которой вещество при ежедневном поступлении в организм в течение всей жизни не оказывает прямого или опосредованного влияния на здоровье населения в настоящем и последующих поколениях, а также не ухудшает гигиенические условия водопользования.
Ориентировочный допустимый уровень (ОДУ, мг/л) - временный гигиенический норматив, разрабатываемый на основе расчетных и экспресс-экспериментальных методов прогноза токсичности и применяемый только на стадии предупредительного санитарного надзора за проектируемыми или строящимися предприятиями, реконструируемыми очистными сооружениями.
При превышении ПДК вода становится непригодной для одного или нескольких видов водопользования.
Установлены ПДКВ более 1343 вредных веществ и ОДУ для 402 веществ.
Нормативы ПДК вредных веществ устанавливают по лимитирующему показателю вредности ЛПВ, который характеризует наиболее неблагоприятное действие каждого вещества в воде водоема.
Вещества в воде водоемов могут оказывать различное воздействие: 1) на здоровье человека; 2) ухудшать органолептические свойства воды (запах, привкус, окраска); 3) на процессы самоочищения водных объектов или микробоценоз. Одно и то же вещество может воздействовать или в одном направлении, или в нескольких. Соответственно перечисленным воздействиям применяются следующие виды ЛПВ (критерии вредности): S санитарно-токсикологический (отражает влияние вещества на здоровье человека); S общесанитарный (нарушение самоочищения воды, в основном от органических веществ); ^ органолептический (если вредное вещество придает воде запах, привкус, окраску).
Таким образом, ЛПВ отражает приоритетность требований к качеству воды.
Пороговые значения концентраций веществ устанавливаются по всем критериям вредности, но в качестве ПДК применяется наименьшая концентрация, с указанием соответствующего ЛПВ.






