Гетерогенные равновесия, связанные с переходом вещества из одной фазы в другую без изменения химического состава, называются фазовыми.
К ним относятся равновесия в процессах испарения, плавления, конденсации и т.п. Фазовые равновесия, как и химические, характеризуются минимальным значением энергии Гиббса системы (DG0Т = 0) и равенством скоростей прямого и обратного процессов. Так, равновесие в системе «вода – лед» Н2О(ж.) Н2О (кр.) характеризуется равенством скоростей процессов плавления льда и кристаллизации воды.
Равновесие в гетерогенных системах зависит от давления, температуры и концентрации компонентов в системе. Для фазового равновесия, так же как и для химического равновесия, справедлив принцип Ле Шателье.
Прежде чем сформулировать правило фаз Гиббса, определим некоторые понятия.
Фаза (Ф) – часть термодинамической системы, однородная во всех точках по составу и свойствам и отделенная от других частей системы поверхностью раздела.
Компонент (К) или составная часть системы – вещество, которое может быть выделено из системы и существовать вне ее.
Наименьшее число компонентов, через которое выражается состав любой фазы, называется числом независимых компонентов данной системы. При рассмотрении фазовых равновесий, когда в системе не происходит химических превращений, понятия «компонент» и «независимый компонент» совпадают.
Число степеней свободы (С) или вариантность системы – число условий (температура, давление, концентрация), которые можно менять произвольно, не изменяя числа и вида фаз системы.
Соотношение между числом фаз (Ф), компонентов (К) и степеней свободы (С) в гетерогенной равновесной системе определяется правилом фаз Гиббса:
С = К – Ф + n, (7)
где n – число внешних факторов, влияющих на равновесие в системе.
Таковыми, как правило, являются температура и давление. Тогда n = 2 и уравнение (7) принимает вид:
С = К – Ф + 2. (8)
По числу степеней свободы системы делятся на:
- инвариантные (С = 0),
- моновариантные (С = 1),
- ивариантные (С = 2),
- поливариантные (С > 2).
При изучении фазовых равновесий широко используется графический метод – метод построения диаграмм состояния. Диаграмма состояния для любого вещества строится на основании опытных данных. Она позволяет судить: 1) об устойчивости какой-либо одной фазы системы; 2) об устойчивости равновесия между двумя или тремя фазами при заданных условиях. Для примера рассмотрим диаграмму состояния однокомпонентной системы (К = 1) – воды (рис. 7.2).
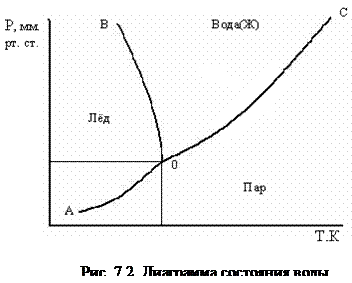 Три кривые АО, ОВ, и ОС, пересекающиеся в одной точке О, делят диаграмму на три части (по́ля, области), каждая из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду. Кривые отвечают равновесию между соответствующими фазами.
Три кривые АО, ОВ, и ОС, пересекающиеся в одной точке О, делят диаграмму на три части (по́ля, области), каждая из которых отвечает одному из агрегатных состояний воды – пару, жидкости или льду. Кривые отвечают равновесию между соответствующими фазами.
Кривая АО выражает зависимость давления насыщенного пара надо льдом от температуры и называется кривой возгонки (сублимации). Для кривой АО: К= 1, Ф= 2, n = 2, тогда число степеней свободы, С = 1 – 2 + 2 = 1. Это значит, что произвольно можно менять только температуру (или только давление) – система моновариантна.
Кривая ОС выражает зависимость давления насыщенного пара над жидкой водой от температуры и называется кривой испарения или конденсации. Для кривой ОС: К= 1, Ф= 2, n = 2, тогда число степеней свободы С = 1–2 + 2 = 1, т.е. система моновариантна.
Кривая ОВ выражает зависимость температуры плавления льда (или замерзания жидкой воды) от давления и называется кривой плавления или кристаллизации. Для кривой ОВ: К= 1, Ф= 2, n= 2, тогда число степеней свободы С = 1 – 2 + 2 = 1, т.е. система моновариантна.
Все рассмотренные кривые (АО, ОВ, ОС) соответствуют переходу воды из одного фазового состояния в другое, т.е. определяют равновесие двух фаз. Области, ограниченные этими кривыми, отвечают условиям существования одной фазы. Для каждой из этих областей: К = 1, Ф = 1, n = 2, тогда число степеней свободы С = 1 – 2 + 2 = 2 – система бивариантна, т.е. в известных пределах можно менять значения р и Т независимо друг от друга, не изменяя числа фаз.
Все кривые пересекаются в точке О – тройная точка – она соответствует равновесию всех трех фаз:
Лед Жидкая вода Пар.
Для тройной точки: К = 1, Ф = 3, n = 2, тогда число степеней свободы С = 1 – 3 + 2 = 0 – система инвариантна, т.е. условия равновесия (температура и давление) строго определены и ни одно из них не может изменяться: Т = 273,1 К, Р = 610 Па (4,58 мм рт.ст.).






