Растворимость малорастворимого вещества s может быть выражена в молях на литр. В зависимости от величины s вещества могут быть разделены на малорастворимые – s < 10-4 моль/л, среднерастворимые – 10-4 моль/л ≤ s ≤ 10-2 моль/л и хорошо растворимые s >10-2 моль/л.
Растворимость соединений связана с их произведением растворимости.
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
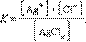
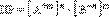
При введении в насыщ. р-р малорастворимого электролита с общим ионом растворимость понижается.
Амфоте́рные гидрокси́ды — химические вещества, которые в кислой среде ведут себя как основания, а в щелочной — как кислоты.
Амфотерные гидроксиды практически нерастворимы в воде, наиболее удобный способ их получения - осаждение из водного раствора с помощью слабого основания - гидрата аммиака:
Al(NO3)3 + 3(NH3 · H2O) = Al(OH)3↓ + 3NH4NO3 (20 °C)
Al(NO3)3 + 3(NH3 · H2O) = AlO(OH)↓ + 3NH4NO3 + H2O (80 °C)
Амфотерные оксиды — солеобразующие оксиды, проявляющие в зависимости от условий либо осно́вные, либо кислотные свойства (то есть
проявляющие амфотерность). Образуются переходными металлами. Металлы в амфотерных оксидах обычно проявляют валентность II,III,IV.
Гидролиз солей по катиону, аниону, катиону и аниону. Ступенчатый гидролиз. Необратимый совместный гидролиз солей. Уравнения реакций.
Гидролиз солей – взаимодействие ионов соли с водой с образованием слабого электролита.
Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
§ 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
CO32− + H2O = HCO3− + OH−
Na2CO3 + Н2О = NaHCO3 + NaOH
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
§ 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
Cu2+ + Н2О = CuOH+ + Н+
CuCl2 + Н2О = CuOHCl + HCl
(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
Причина гидролиза солей по катиону и по аниону.
Так как соль образована слабым основанием и слабой, кислотой, то и катионы, и анионы соли разлагают воду.
взаимодействие двух солей, усиливающих гидролиз друг друга, называется совместным гидролизом
Степень и константа гидролиза солей. Подавление и усиление гидролиза. Изменение водородного показателя при гидролизе. Применение гидролизующих солей при химической переработке древесины.
Степень гидролиза h – отношение концентрации гидролизованных молекул к общей концентрации растворенных молекул.
Для солей, образованных сильным основанием и слабой кислотой:

Для усиления или подавления гидролиза можно использовать химические и физические способы.
Химические способы основаны на изменении концентраций веществ, находящихся в равновесии. Если в раствор гидролизующейся соли ввести реагент, связывающий образующиеся при гидролизе ионы H+ и ОН-, то, в соответствии с принципом Ле Шателье, равновесие смещается в сторону усиления гидролиза; в результате гидролиз может протекать полностью до образования его конечных продуктов. Аналогичное действие оказывает добавление в раствор воды -разбавление наиболее простой способ усиления гидролиза.
Физическим способом равновесие при гидролизе может быть смещено путём изменения температуры. Обратный гидролизу процесс - реакция нейтрализации - протекает с выделением теплоты, а гидролиз представляет собой эндотермический процесс. Поэтому повышение температуры ведет к усилению гидролиза, а понижение - к ослаблению.
1.Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
NH4Cl+HOH<—>NH4OH+HCl
NH4+ +Cl-+HOH<—>NH4OH+H++ Cl-
NH4+ +HOH<—>NH4OH+H+
В растворе накапливаются ионы H+, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше7.
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
CH3COONa+HOH<—>CH3COOH+NaOH
CH3COO-+Na++HOH<—>CH3COOH+Na++OH-
CH3COO-+HOH<—>CH3COOH+OH-
В данном случае гидролиз ведет к увеличению концентраций ионов в растворе, среда щелочная, рН>7.
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
CH3COONH4 +HOH<—>CH3COOH+NH4OH
CH3COO- + NH4+ +HOH<—>CH3COOH+NH4OH
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH-воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
Гидролизом древесины получают этанол






