Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией - активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно, химические реакции при высоких температурах протекают быстрее, чем при низких температурах. Зависимость скорости реакции от температуры определяется правилом Вант - Гоффа: 
активные частиц ы – молекулы которые обладают энергией, что бы разорвать или ослабить связи в исходных частицах, и тем самым создать новые молекулы.
энергия активации – некоторая избыточная энергия, которой должны обладать молекулы для того что бы их столкновение привело к образованию нового вещества. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости химической реакции  от температуры
от температуры 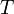 .
.
k=ZPe ^ (-Ea/RT)
Z-чисто столкновений молекул. e=2,718…, P-стерический множитель
Обратимые и необратимые реакции. Химическое равновесие. Константа равновесия. Особенность гетерогенных равновесий. Смешение истинного химического равновесия. Принцип Ле Шателье и примеры его применения.
Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например:3H2 + N2 ⇌ 2NH3.
Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложениевзрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ.Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑
Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
В состоянии равновесия скорости прямой и обратной реакции становятся равными.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. k=ZPe ^ (-Ea/RT)
Выражение const гетерогенного равновесия отсутствуют активные массы, конденсированные (жидких, твёрдых) физ. постоянного состава.
Процесс перехода от одного равновесного состояния к новому равновесия назыв. смещение хим. равновесия.
Принцип Ле Шателье: Если на систему находящуюся в состояния хим. равновесия. оказать какое-либо воздействие, то равновесия сместится в таком направлении, что оказанное воздействие будет ослаблено.
Приведем пример реакции в газовой фазе:
2 NO2 (г)  N2O4 (г)
N2O4 (г)
бурый бесцв газ + 57 кДж
FeCl3+KSCNàß Fe(SKN)Cl2+HCl (Интенсивный цвет)






