Реактивы: 1%-ный раствор глицина(аминоуксусной кислоты), 1%-ный раствор сульфата меди(II),1%-ный раствор щелочи.
Ход работы. В пробирку помещают 2 каплираствора соли меди, 10-15 капель глицина (аминоуксусной кислоты), добавляют 4-5 капель щелочи.
Отмечают цвет образовавшегося соединения.
| Уравнение реакции: |
| |
| Вывод: | ____________________ |
Опыт 2. Реакция глицина с формалином:
В пробирку помещают 5 капель раствора глицина (ω = 1%) и добавляют одну каплю индикатора метил-рот. Наблюдают появление желтого окрашивания. Судят о реакции среды в растворе. К содержимому пробирки добавляют 5 капель формалина. Наблюдают изменение окраски индикатора. Делают вывод (наличие какой функциональной группы подтверждает данная реакция). Приводят уравнение реакции.
| Уравнение реакции: |
| |
| Вывод: | ____________________ |
Опыт 3. Ксантопротеиновая реакция:
В чистые пробирки помещают по 0,5 мл растворов яичного белка, альбумина, желатины и казеина. В каждую пробирку добавляют по 0,5 мл раствора концентрированной азотной кислоты. Нагревают. После охлаждения пробирок добавляют по 0,5 мл раствора гидроксида натрия, проводят наблюдения.
| Уравнение реакции: |
| |
| Вывод: | _________________________________ |
Опыт 4. Реакция Фоля на серосодержащие аминокислоты:
| ? |
| Уравнение реакции: | |
| Вывод: | ___________________________ |
Домашнее задание.
1. Приведите формулы четырех протеиногенных аминокислот.
2.Приведите формулы двух непротеиногенных аминокислот.
3. Приведите формулы трех заменимых аминокислот:
4. Приведите формулы трех незаменимых аминокислот:
5. Приведите примеры уравнений реакций, подтверждающихсвойства аминокислот как амфолитов:
___________
6.Приведите формы существования аминокислот в зависимости от рН водного раствора.
| молекулярная | катионная |
| анионная | биполярная (цвиттер-ион) |
7.Приведите примеры аминокислот с гидрофобными боковыми цепями.
8.Напишите уравнения реакций:
| а) на тирозин (реакция Миллона), |
| б) на аргинин (реакция Сакагучи). |
Дата: _________
Тема: Строение и свойствабелков.
Занятие № 4.
Целевые задачи: в результате изучения данной темы иметь представление:
- о биологических функциях белков и их роли в жизнедеятельности;
- об особенностях строения и их физико-химических свойств;
Знать:
1. Особенности строения и общую характеристику белков.
2. Классификацию и общие свойства белков.
3.Аминокислотный состав пептидов и белков.Особенности строения белков.
Сущность работы: дать определение белкам,разобрать их классификацию, остановиться на синтезе пептидов,их номенклатуре и специфических особенностях структурно-пространственной организации, типы связей стабилизирующих структуры белка (электростатическое взаимодействие,водородная связь, гидрофобные взаимодействия неполярных групп, диполь-дипольные взаимодействия, дисульфидные связи).
Блок информации(по указанию преподавателя):
Белки –
Денатурация-
Ренатурация –
Лабораторная работа.
Качественная реакция на пептидную связь.
Количественное определение белка.
Цель работы: изучить свойства белков, обусловленные их строением.
Сущность работы: провести опыты, подтверждающие наличие пептидной связи, определить содержание белка в исследуемом растворе.
Реактивы: растворы яичного белка разной концентрации, 1%-ный раствор сульфата меди(II),10%-ный раствор щелочи.
1. Биуретовая реакция на пептидную связь:
| ? |
| Уравнение реакции: | |
| Вывод: | ________________________________ |
2. Количественное определение белка в растворе:
В основе метода лежит биуретовая реакция! Для построения калибровочного графика из раствора белка с точно известной массовой долей (ω = 1,00%) готовят четыре раствора методом последовательного разведения. В пять пробирок помещают по1,00 мл растворов белка: в четыре пробирки – растворы для построения калибровочного графика, в пятую пробирку – исследуемый раствор.Содержимое пробирок перемешивают стеклянными палочками и оставляют на 20 минут при комнатной температуре. Измеряют оптическую плотность раствора на спектрофотометре ПЭ – 5300 В. Стандартный раствор готовят смешиванием 1,00 мл дистиллированной воды, 1,00 мл раствора гидроксида натрия и 0,10 мл раствора сульфата меди(II). Длина волны 24
светофильтра – 540 нм. Записывают результаты измерений.
!!! (эту часть работы делать не надо, в таблице представлены данные для построения калибровочного графика).
В чистую пробирку помещают 2 мл исследуемого раствора, добавляют по 2,00 мл раствора гидроксида натрия и 0,20 мл раствора сульфата меди(II). Содержимое пробирок перемешивают стеклянной палочкой и оставляют на 15 минут при комнатной температуре. Измеряют оптическую плотность раствора на спектрофотометре
ПЭ – 5300 В. Длина волны светофильтра – 540 нм. Строят калибровочный график D = f(ω, %) (на миллиметровой бумаге) по готовым данным из таблицы и определяют массовую долю белка в исследуемом растворе. Делают вывод о содержание белка в исследуемом растворе.
| Массовая доля белка ω, % | 1,000 | 0,75 | 0,5 | 0,25 | Испытуемый раствор |
| Оптическая плотность, D | 1.1 | 0,8 | 0.5 | 0,2 |
Калибровочный графикD = f(ω, %):
| ? |
Вывод: ___________________________________
Домашнее задание.
1. Приведите фрагменты простых и сложных белков:
| простой | сложный |
2. Приведите примеры глобулярных и фибриллярных белков:
| глобулярные | |
| фибриллярные |
3. Какие факторы влияют на денатурацию белка? Какие явления называют необратимой денатурацией?
_____________________________________________________________________________
4. Приведите две резонансные формы пептидной связи в белках:
| Кето-форма | Енольная форма |
5. За счет чего стабилизируются вторичная и третичная структуры белка?
_____________________________________________________________________________
6. Напишите цепь гептапептида, состоящего из последовательности аминокислот: серин, валин, тирозин, глутаминовая кислота, валин, аланин, гистидин. Укажите N- и С- концевые остатки. Назовите данныйгептапептид.
_____________________________________________________________________________
_________________________________________27____________________________________
Дата: _________
Тема:«Полинуклеотиды»(семинар).
Занятие №5.
Целевые задачи семинара: иметь представление:
- о биологических функциях полинуклеотидов и их роли в организме;
- о физико-химических свойствах полинуклеотидов, обусловленных особенностями их строения.
Знать:
1. Химический состав и строение ДНК и РНК.Уровни их структурной организации
(первичная и вторичная структуры).
2. Строение нуклеотидов и нуклеозидов.
3. Свойства полинуклеотидов: кислотно-основные, хелатирующую способность, способность к денатурации, жидкокристаллическое состояние нуклеиновых кислот.
Блок информации (по указанию преподавателя):
___________________________________________________________________
Полинуклеотиды(нуклеиновые кислоты) –
РНК –
ДНК –
____________________ _________________
Рибоза 2-дезоксирибоза
пуриновые основания:
пиримидиновые основания:
минорные азотистые основания:
Нуклеозиды-
Нуклеотиды –
_______________ ____________________
Аденозин (нуклеозид) аденозин-51-монофосфат
(нуклеотид)
Правила Чаргаффа:
Положения модели Уотсона и Крика:
________________________________________________________________________________________________________________________________________________________________________________________
Домашнее задание.
1. Приведите фрагменты полинуклеотидной цепи:
| РНК | ДНК |
2. Приведите примеры:
| Рибонуклеозида (дайте название) | Дезоксирибонуклеозида (дайте название) |
3. Напишите формулу аденозинтрифосфата, укажите сложноэфирные и гликозидные связи:
Дата: _________
З анятие № 7
Тема:Свойства растворов биополимеров.Вязкость растворов биополимеров.
Цель работы:
иметь представление:
- о типах вязкости;
- об основных причинах высокой вязкости биополимеров;
- о методах измерения вязкости растворов ВМС.
Надо знать:
1. Что такое аномальная вязкость, почему она возникает в растворах ВМС.
2. Факторы от которых зависит вязкость растворов биополимеров.
3. Понятия удельной, характеристической, приведенной вязкости полимеров.
4. Законы Ньютона, Пуазейля, уравнение Штаудингера.
Блок информации (по указанию преподавателя):
Вязкость-
Лабораторная работа.
«Определение молекулярной массы биополимера
вискозиметрическим методом».
Цель работы: освоить вискозиметрический метод для определения молекулярной массы ВМС.
Выполнение эксперимента:
Оборудование: вискозиметр ВПЖ-2м, секундомер, цилиндры вместимостью 25 мл,воронки, резиновые груши.
Реактивы: водные растворы крахмала четырех концентраций:0,5 г/л; 1г/л; 2 г/л; 4 г/л, дистиллированная вода.
Выполнение эксперимента:
1. В тщательно вымытый сухой вискозиметр c помощью воронки наливают строго определенный объем растворителя – дистиллированную воду (10мл), отмеренную цилиндром через колено 2. С помощью груши, надетой на патрубок 3, зажав указательным пальцем колено 2, нагнетают в прибор воздух так, чтобы уровень жидкости дошел приблизительно до середины резервуара 4, затем, открыв колено 2, определяют с помощью секундомера время опускания уровня жидкости междуметками М 1 и М2 с точностью до десятой доли секунды.(t0).
2. Затем повторить те же операции и в той же последовательности с растворами крахмала различной концентрации, начиная с минимальной концентрации (по 10 мл каждого раствора) и измеряя время истечения жидкости для каждой концентрации: (t 0,5, t 1.0, t2.0. t 4.0).
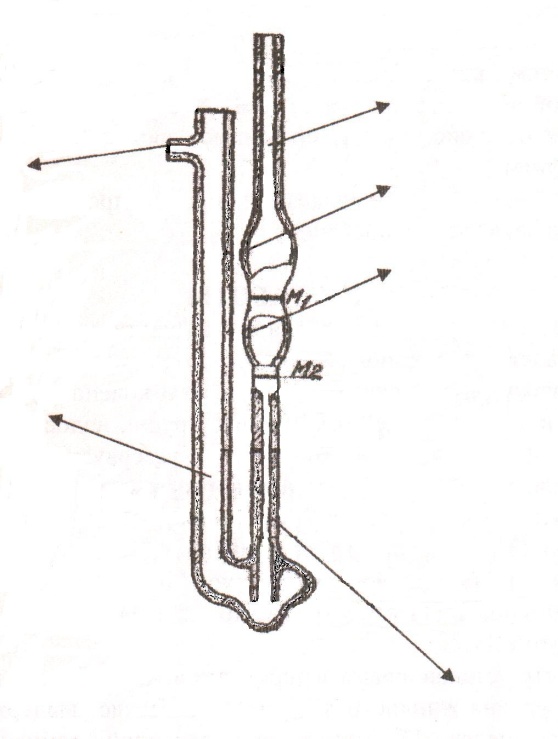
Рис. Вискозиметр ВПЖ-2м.
Результаты эксперимента заносят в таблицу:
| Концентрация растворов крахмала (С, г/л) | Время истечения Жидкости (t,сек) | 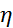 удельная
удельная
| 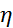 приведенная
приведенная
|
| 0 (вода дистил.) | - | - | |
| 0,5 | |||
| 1,0 | |||
| 2,0 | |||
| 4,0 |
Расчеты:
Расчет удельной вязкости проводится по уравнению:
 (уд.) =(tраствора - t0) / t0
(уд.) =(tраствора - t0) / t0
 (уд.) 1 = --------------- =
(уд.) 1 = --------------- =
 (уд.)2 = --------------- =
(уд.)2 = --------------- =
 (уд.) 3 = --------------- =
(уд.) 3 = --------------- =
 (уд.) 4 = --------------- =
(уд.) 4 = --------------- =
Приведенную вязкость рассчитывают по уравнению:
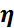 (привед.) =
(привед.) = 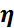 (уд.) / С(концентрация исследуемого раствора);
(уд.) / С(концентрация исследуемого раствора);
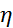 (привед.)1 = --------------- =
(привед.)1 = --------------- =
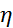 (привед.)2 = --------------- =
(привед.)2 = --------------- =
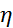 (привед.)3 = --------------- =
(привед.)3 = --------------- =
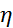 (привед.)4 = --------------- =
(привед.)4 = --------------- =
По рассчитанным значениям удельной вязкости для четырех различных концентраций (данные занести в таблицу), строим график зависимости приведенной вязкости от концентрации:
График: 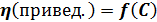
По графику определяем характеристическую вязкость (точка пересечения графика с осью ординат) [ 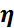 ] =
] =
Молярную массу биополимера рассчитывают по уравнению Штаудингера:
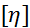 = K * Mα, отсюда M =
= K * Mα, отсюда M = 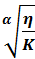 =
=
K – константа, характерная для полимеров одного гомологического ряда
(для гомологического ряда полисахаридов К = 6.1х 10-4)
α – константа, характеризующая гибкость макромолекул и их взаимодействие с молекулами растворителя (α= 0,63)
| ? |
Вывод:
_____________________________________________________________________________________
Домашнее задание.
1. Определите молярную массу рибонуклеазы, если результаты вискозиметрического метода для водных растворов рибонуклеазы следующие: характеристическая вязкость водного раствора полимера = 0,033 м3/ кг; К= 5,1х10-5; α = 0,68
2. Рассчитайте удельную и приведенную (относительную) вязкость раствора белка, если время истечения этого раствора равно 600 сек., а время истечения воды – 240 сек. Плотность раствора белка равна 1,008 г/ см3.
3. Молярная масса биополимера 230000 г/моль. Вычислить характеристическую вязкость раствора биополимера, используя следующие эмпирические константы: К=1.15 х 10-4; α = 0,72.
4. Приведенные (относительные) вязкости ряда водных растворов биополимера определены вискозиметрическим методом при температуре 298К:
Результаты определения представлены в таблице:
| Концентрация раствора в г/л | 0,247 | 0,499 | 0,999 | 1,998 |
| Относит.вязкость | 1,355 | 1,782 | 2,879 | 6,090 |
Определите характеристическую вязкость раствора биополимера.
СХЕМА 2
| Природа полимера |
| Температура |
| Концентрация |
| Электролиты |
| Вязкость |
| Нормальная |
| Аномальная |
| Растворы НМС |
| Коллоидные растворы |
| Концентрированные коллоидные растворы |
| Растворы ВМС |
| Способы выражения вязкости |
| Причины аномальности |
| ηотнОтносительная |
| ηпривПриведенная |
| ηудУдельная |
| [η] Характеристичесская |
| Структурообразовательная |
| Форма макромолекул |
| Размер макромолекул |
| рН среды |
| Давление |
| Факторы, влияющие на вязкость растворов биополимеров |
Дата____
Тема: Свойства растворов биополимеров.Устойчивость растворов биополимеров.
Занятие № 8
Целевые задачи:
иметь представление:
- об устойчивости растворов биополимеров;
- о факторах, влияющих на устойчивость растворов биополимеров;
-о коацервации и миткрокапсулирловании
Знать:
1. Основные причины нарушения устойчивости растворов биополимеров.
2. Сущность высаливания, высаливающее действие ионов, способность ионов к гидратации.
Блок информации (по указанию преподавателя):
ВЫСАЛИВАНИЕ –
КОАЦЕРВАЦИЯ
Схема 3.
| Факторы ускоряющие процессы высаливания |
| ТЕМПЕРАТУРА |
| рН среды = рI |
| ВОДООТНИМАЮЩИЕ СРЕДСТВА |
| Явления, происходящие при нарушении устойчивости |
| ВЫСАЛИВАНИЕ |
| КОАЦЕРВАЦИЯ |
| ДЕНАТУРАЦИЯ |
| Понижение растворимости биополимеров в растворе солей с большей концентрацией |
| Нарушение нативной пространственной структуры биополимера |
| Нарушение структуры гидратных оболочек макромолекул |
| введение насыщенныхрастворов электролитов,содержащих сульфат,оксалат-ионы |
| Наличие водоотнимающих средств |
| Рост Т |
| Изменение рН |
| Физическая |
| Химическая |
| рост Т |
| Давление |
| УФ |
| Ультразвук |
| Кислота и щелочь |
| Соли тяжелых металлов |
| Органические растворители |
| ЗАСТУДНЕВАНИЯ |
| Факторы устойчивости растворов биополимеров |
| Гидратная оболочка за счет полярных и ионогенных групп |
| Заряд намакро-молекуле за счет ионогенных групп |
Лабораторная работа.






