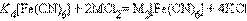’имические свойства комплексного иона с известной электронной конфигурацией и геометрическим строением определ€ютс€ двум€ факторами: а) способностью равновесной системы при определенных услови€х к превращени€м; б) скоростью, с которой могут происходить превращени€, ведущие к достижению равновесного состо€ни€ системы.
ѕервый определ€ет термодинамическую, а второй Ц кинетическую устойчивость комплексного соединени€. инетическа€ устойчивость зависит от многих факторов, поэтому обычно поддаетс€ лишь качественной оценке.
¬ противоположность ей термодинамическа€ устойчивость может быть легко охарактеризована количественно с помощью констант равновеси€.
¬ растворе ион металла M и монодентатный лиганд L взаимодействуют ступенчато с образованием комплексного иона [ML n ] по схеме:
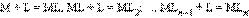
|
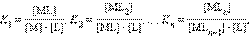
|
где K i Ц ступенчатые константы образовани€ (устойчивости) отдельных комплексов [ML i ].
ѕоскольку в этой системе существует лишь n независимых равновесий, полна€ константа процесса M + n L = ML n Ц обща€ константа образовани€:
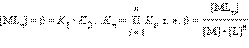
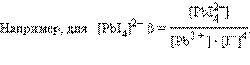
„ем больше константа устойчивости, тем более прочным €вл€етс€ данный комплекс, поскольку Δ G ∞ = Ц RT lnβ.
ќбразование прочных комплексных ионов может быть использовано дл€ растворени€ труднорастворимых электролитов. онцентраци€ ионов в растворе определ€етс€ величиной произведени€ растворимости такого электролита. ƒобавл€€ в раствор вещества, образующие с одним из его ионов комплексное соединение, можно во многих случа€х достичь растворени€ осадка за счет комплексообразовани€. ƒобитьс€ этого тем легче, чем больше величина произведени€ растворимости и чем больше константа устойчивости комплексного иона. Ќапример, хлорид серебра AgCl раствор€етс€ в избытке аммиака, образу€ [Ag(NH 3) 2]Cl. ћенее растворимый AgI в аммиаке практически не растворим, но раствор€етс€ в тиосульфате натри€ Na 2S 2O 3 по реакции
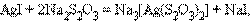
|
поскольку β[Ag(S 2O 3) 2] 3Ц на несколько пор€дков больше β[Ag(NH 3) 2] +.
омплексные ионы участвуют в реакци€х обмена с образованием более прочного или менее растворимого соединени€:
|
«десь M = Ni 2+, Cu 2+, Fe 2+.
ћ≈“ќƒ»„Ќј –ќ«–ќЅ ј ƒЋя ќ–√јЌ≤«ј÷≤ѓ
ѕќ«јј”ƒ»“ќ–Ќќѓ —јћќ—“≤…Ќќѓ –ќЅќ“» —“”ƒ≈Ќ“ј
ѕредмет: Ѕ≥онеорган≥чна х≥м≥€ група:___________ курс__________
—пец≥альн≥сть: —естринська справа
“ема: ¬ченн€ про розчини. —пособи вираженн€ к≥льк≥сного складу розчин≥в.
≥льк≥сть навчальних годин: 3
1. јктуальн≥сть теми.
¬одн≥ розчини Ц це найпоширен≥ш≥ системи у жив≥й ≥ нежив≥й природ≥, оск≥льки вода Ї ун≥версальним розчинником. ” водному середовищ≥ в≥дбуваЇтьс€ б≥льш≥сть х≥м≥чних реакц≥й, складн≥ ф≥з≥олог≥чн≥ та б≥олог≥чн≥ процеси. ќсновн≥ б≥олог≥чн≥ р≥дини - плазма кров≥, л≥мфа, сеча, спинномозкова р≥дина Ц м≥ст€ть р≥зн≥ неорган≥чн≥ та орган≥чн≥ речовини у розчиненому стан≥.
2. Ќавчальна мета.
а) знати:
1. «наченн€ водних розчин≥в у б≥олог≥њ та медицин≥.
2. —пособи вираженн€ к≥льк≥сного складу розчин≥в.
|
|
|
б)вм≥ти: 1. –озвТ€зувати задач≥ на знаходженн€ масовоњ частки розчиненоњ речовини.
2. –озвТ€зувати задач≥ на визначенн€ мол€рноњ концентрац≥њ.
3. ћатер≥али до аудиторноњ самост≥йноњ роботи.
3.1. Ѕазов≥ знанн€, вм≥нн€, навички, необх≥дн≥ дл€ вивченн€ теми:
| ƒисципл≥ни | «нати | ¬м≥ти |
| Ќеорган≥чна х≥м≥€ | ћасову частку розчиненоњ речовини | «аписати формули |
| ћол€рну концентрац≥ю розчину | ¬изначенн€ масовоњ частки ≥ мол€рноњ концентрац≥њ | |
| ќћ— | “ипи ф≥з≥олог≥чних розчин≥в | ѕриготувати розчин заданоњ концентрац≥њ |
3.2. «м≥ст теми.
–озчини - це гомогенн≥ термодинам≥чн≥ ст≥йк≥ системи зм≥нного складу, що м≥ст€ть один або к≥лька компонент≥в ≥ продукт≥в њх взаЇмод≥њ. –озчини класиф≥кують:
а) за агрегатним станом;
б) за природою розчинника;
в) за природою розчиненоњ речовини;
г) за вм≥стом розчиненоњ речовини;
д) за насичен≥стю розчину розчиненоњ речовини.
¬ажливою характеристикою розчину Ї його к≥льк≥сний склад, €кий можна виразити €к часткою розчиненоњ речовини, так ≥ концентрац≥Їю розчиненоњ речовини.
ћасова частка розчиненоњ речовини (ᵂ) - це в≥дношенн€ маси розчиненоњ речовини до загальноњ маси розчину:
W = 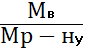
ћаса розчину складаЇтьс€ з розчиненоњ речовини (¬) ≥ розчинника (ј), дор≥внюЇ сум≥ мас цих компонент≥в:
ћр-ну = ћа+ћв
ћасову частку можна виразити у в≥дсотках:
W = 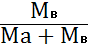 *100%
*100%
ћол€рна концентрац≥€ (—м) Ц це в≥дношенн€ к≥лькост≥ розчиненоњ речовини Vв до обТЇму розчину (V), вираженого у куб≥чних дециметрах:
ћ = 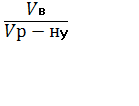 =
= 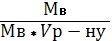 ; Vр - ну =
; Vр - ну = 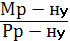 ; —м =
; —м = 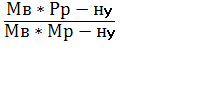
¬иражають у мол€х на м дм (моль м, моль дм)
3.3.–екомендована л≥тература:
ќсновна: ¬. ѕ. ћузиченко Ђћедична х≥м≥€ї
ƒопом≥жна: Ќ.ѕ. √ирина ЂЌеорган≥чна х≥м≥€ї; ¬.ј. ол≥бабчук Ђћедицинска€ хими€ї
3.4. ќр≥Їнтовна карта дл€ самост≥йноњ роботи з л≥тератури з теми:
Ђ–озчини. —пособи вираженн€ к≥льк≥сного складу розчин≥вї
| ќсновн≥ завданн€ | ¬каз≥вки | ¬≥дпов≥д≥ |
| 1. «наченн€ розчин≥в у б≥олог≥њ та медицин≥ | ќзнайомитис€ з даним завданн€м у п≥дручнику | «аписати приклади застосуванн€ розчин≥в у медицин≥ |
| 2. —клад ≥ типи розчин≥в | ¬изначити класиф≥кац≥ю розчин≥в | —класти схему класиф≥кац≥й |
| 3. “еор≥њ розчин≥в | ќзнайомитис€ з основними теор≥€ми розчин≥в | «аписати основну суть теор≥й розчин≥в |
| 4. —пособи вираженн€ к≥льк≥сного складу розчин≥в | ||
| ј) масова частка розчиненоњ речовини | «найти формулу по €к≥й визначають масову частку | «аписати приклади ≥ розвТ€зати њх |
| Ѕ) мол€рна концентрац≥€ | «аписати формулу по €к≥й визначають мол€рну концентрац≥ю | «аписати приклади задач ≥ розвТ€зати њх |
3.5. ћатер≥али дл€ самоконтролю: питанн€, тести, задач≥.
| ¬иконати вправи: |
| 1. —к≥льки грам≥в йоду ≥ спирту потр≥бно вз€ти дл€ приготуванн€ 500г. йодноњ настойки, що Ї 10% розчином? |
| 2. «м≥шали 100г. 10% ≥ 50г. 30% розчин≥в. яка w% одержаного розчину? |
| 3. якоњ концентрац≥њ утворитьс€ розчин сол≥, €кщо до 500г. 12% розчину додати 300см води? |
| 4. ѕри випарюванн≥ 700г. розчину з масовою часткою сульфатноњ кислоти 60%, втратили 200г. води. ќбчислити масову частку отриманого розчину. |
| 5. як≥ обТЇми 35% ≥ 15% розчин≥в потр≥бн≥ дл€ приготуванн€ 800г. 25% розчину? |
| 6. ” вод≥ розчинили 20г. NaOH. ќбТЇм розчину = 400см. ¬изначити його пол€рн≥сть. |
| 7. —к≥льки грам≥в NaOH потр≥бно дл€ приготуванн€ 500см 0,1м розчину? |
| 8. ” вод≥ розчинили 20г. NaOH. ќбТЇм розчину = 400см.¬изначити його пол€рн≥сть. |
| 9. –озрахувати масу речовини, необх≥дноњ дл€ приготуванн€ 200см 0,3м розчину NaCl. |
| 10. ќбчислити мол€рну концентрац≥ю розчину з масовою часткою H2SO4 64% (р= 1,547 г/см). |
|
|
|
¬икладач:_________________________________________(пр≥звище)
«агальн≥ в≥домост≥ про розчини, њх склад ≥ типи.
–озчинами називають однор≥дн≥ (гомогенн≥) системи, €к≥ склада -
ютьс€ з двох або б≥льше компонент≥в, в≥дносна к≥льк≥сть €ких може
зм≥нюватис€ у широких межах без порушенн€ однор≥дност≥.
омпонентами розчину називають розчинник та розчинен≥ в ньо-
му речовини. –озчинник Ч це середовище, в €кому розчинен≥ речо-
вини р≥вном≥рно розпод≥лен≥ у вигл€д≥ молекул або ≥он≥в. –озчин-
ником прийн€то вважати компонент, агрегатний стан €кого не
зм≥нюЇтьс€ при утворенн≥ розчину або вм≥ст €кого переважаЇ вм≥ст
≥нших компонент≥в. ѕон€тт€ розчинник ≥ розчинена речовина умов-
не. Ќаприклад, при зм≥шуванн≥ чистоњ води та твердоњ речовини
сол≥ одержують р≥дкий розчин. ” даному випадку розчинником Ї
вода. якщо обидва компоненти до розчиненн€ знаходились в од-
ному агрегатному стан≥, то розчинником вважаЇтьс€ компонент,
вз€тий у б≥льш≥й к≥лькост≥, а €кщо њх обТЇми однаков≥, то байду-
же, €кий ≥з компонент≥в називати розчинником, а €кий розчине-
ною речовиною.
–озчини класиф≥кують за р€дом ознак:
Ц залежно в≥д природи розчинника розчини под≥л€ють на водн≥
та неводн≥ (спиртов≥, бензольн≥ тощо);
Ц залежно в≥д концентрац≥њ ≥он≥в водню розчини можуть бути
кислими, нейтральними та лужними;
Ц залежно в≥д агрегатного стану розчинника та розчиненоњ
речовини розчини под≥л€ють на газопод≥бн≥, р≥дк≥ та тверд≥.
ѕрикладом газопод≥бних розчин≥в Ї пов≥тр€. ¬оно складаЇтьс€
з азоту, кисню, оксиду вуглецю(IV), вод€ноњ пари та благородних
газ≥в. ћолекули цих речовин, незалежно в≥д њх походженн€, пово-
д€ть себе €к молекули газу, тобто пов≥тр€ Ї гомогенною системою.
ƒо твердих розчин≥в належить б≥льш≥сть метал≥чних сплав≥в.
—таль, наприклад, €вл€Ї собою кристал≥чний розчин вуглецю в
зал≥з≥.
Ќайб≥льш поширеними ≥ вивченими Ї р≥дк≥ водн≥ розчини. ÷е
по€снюЇтьс€ тим, що б≥льш≥сть х≥м≥чних реакц≥й переб≥гають у
водних розчинах, оск≥льки лише в них Ї спри€тлив≥ умови дл€
пересуванн€ та т≥сного зближенн€ частинок, €ке необх≥дне дл€
ви€вленн€ х≥м≥чних сил. ¬елику роль в≥д≥грають розчини у життЇ-
д≥€льност≥ живих орган≥зм≥в. ѕроцеси засвоЇнн€ њж≥ людиною, тва-
риною та рослиною повТ€зан≥ з переходом харчових речовин у роз-
чин. –озчинами Ї важлив≥ ф≥з≥олог≥чн≥ р≥дини Ч кров, л≥мфа тощо.
¬ажливе значенн€ мають розчини у фармацевтичн≥й практиц≥. ¬они
Ї найб≥льшою групою серед л≥карських форм. як л≥карська форма
розчини мають р€д переваг: вони пор≥вн€но з ≥ншими л≥карськи-
ми формами швидше всмоктуютьс€ орган≥змом людини, в≥дпов≥д-
но швидше дос€гаЇтьс€ л≥кувальний ефект; у форм≥ розчину вик-
лючаЇтьс€ подразненн€ слизовоњ оболонки; розчини зручн≥ дл€
вживанн€; технолог≥€ њх приготуванн€ та дозуванн€ в≥др≥зн€Їтьс€
простотою.
–≥дк≥ розчини можна одержати розчиненн€м газу в р≥дин≥ (на-
приклад, газована вода Ї розчином оксиду вуглецю(IV) у вод≥),
р≥дини в р≥дин≥ (розчин спирту у вод≥), твердоњ речовини в р≥дин≥
(розчин сол≥ у вод≥) тощо.
ќсновн≥ параметри стану розчину Ч це температура, тиск та
концентрац≥€.
«алежно в≥д концентрац≥њ розчиненоњ речовини розчини по-
д≥л€ють на розведен≥ та концентрован≥.
–озведений розчин м≥стить досить малу масу розчиненоњ речо-
вини пор≥вн€но з масою розчинника. (Ќаприклад, в 100 г води
розчинено 5 г хлороводню). –озчин, €кий м≥стить 36,5 г хлоровод-
ню в 100 г води, вважають концентрованим. ќднак меж≥ м≥ж розве-
деними та концентрованими розчинами умовн≥. Ќаприклад, дл€
с≥рчаноњ кислоти концентрованим вважаЇтьс€ розчин, €кий м≥стить
96 г H2SO4, дл€ азотноњ Ч 63 г HNO3, дл€ сол€ноњ Ч 37 г H—l в
100 г води.
Ќайважлив≥шою к≥льк≥сною характеристикою будь-€кого роз-
|
|
|
чину Ї концентрац≥€, €ка вказуЇ на масу або к≥льк≥сть розчиненоњ ре-
човини, що м≥ститьс€ в одиниц≥ маси або обТЇму розчину або розчинни-
ка. ≤снують р≥зноман≥тн≥ способи вираженн€ концентрац≥њ розчин≥в.
ћасова частка Ч це маса розчиненоњ речовини в 100 г розчину.
Ќаприклад, розчин з масовою часткою хлориду кальц≥ю 5 % м≥стить
5 г хлориду кальц≥ю в 100 г розчину. ќск≥льки маса розчину дор≥в-
нюЇ сум≥ мас розчинника та розчиненоњ речовини, то в наведено-
му приклад≥ кожн≥ 100 г розчину м≥ст€ть 5 г хлориду кальц≥ю та
95 г води. ћасову частку розчину позначають л≥терою ω Ч та вира-
жають у частках одиниц≥ або у в≥дсотках. Ќа практиц≥ останн€ зас-
тосовуЇтьс€ найчаст≥ше.
¬ираз концентрац≥њ розчину за допомогою масовоњ частки широко
застосовуЇтьс€ у фармацевтичн≥й практиц≥. ћасова частка нале-
жить до техн≥чних концентрац≥й. “ак, на виробництв≥ с≥рчану, азотну
та сол€ну кислоти одержують у вигл€д≥ концентрованих розчин≥в з
масовими частками 96,63; 65,37 та 37 % в≥дпов≥дно. ÷≥ розчини
також характеризуютьс€ густиною (ρ, г/мл).
ћольну частку визначають в≥дношенн€м к≥лькост≥ розчиненоњ
речовини або розчинника до суми к≥лькостей вс≥х компонент≥в роз-
чину. ћольну частку позначають N1 дл€ розчинника; N2, N3, N4...
дл€ розчинених речовин. ƒл€ розчину, €кий складаЇтьс€ з компо-
нент≥в ј, Ѕ, ¬:
Nј =
n
nnn
A
A+a+b; NЅ =
n
nnn
a
A+a+b; N¬ =
n
nnn
B
A+a+b,
де nA, nЅ, n¬ Ч к≥льк≥сть кожного компоненту у даному розчин≥.
—ума мольних часток компонент≥в розчину дор≥внюЇ одиниц≥:
NA + NЅ + N¬ = 1.
ћол€рну концентрац≥ю розчину (—ћ) визначають к≥льк≥стю роз-
чиненоњ речовини, €ка м≥ститьс€ в одному л≥тр≥ розчину. ќдиниц≥
вим≥ру Ч моль/л.
—ћ =
m
MV
, оск≥льки
m
M
= n, тод≥ —ћ =
n
V
,
де m i M Ч маса та мол€рна маса розчиненоњ речовини, V Ч обТЇм
розчину, л, n Ч к≥льк≥сть розчиненоњ речовини.
—п≥вв≥дношенн€ —ћ =
n
V
показуЇ, що мол€рна концентрац≥€ Ї
в≥дношенн€м к≥лькост≥ розчиненоњ речовини до обТЇму розчину.
ћол€рну концентрац≥ю позначають таким чином:
1 ћ Ч одномол€рний розчин (—ћ = 1 моль/л),
0,1 ћ Ч децимол€рний розчин (—ћ = 0,1 моль/л),
0,01 ћ Ч сантимол€рний розчин (—ћ = 0,01 моль/л),
0,001 ћ Ч м≥л≥мол€рний розчин (—ћ = 0,001 моль/л).
ћол€рну концентрац≥ю розчину використовують при вивченн≥
швидкост≥ та механ≥зму переб≥гу х≥м≥чних реакц≥й, при визначенн≥
теплових ефект≥в реакц≥й, обчисленн≥ констант дисоц≥ац≥њ та г≥дро-
л≥зу. ¬они зручн≥ тим, що у значн≥й м≥р≥ спрощують обчисленн€.
“ак, при однаков≥й мол€рн≥й концентрац≥њ р≥вн≥ обТЇми розчин≥в
м≥ст€ть однаков≥ к≥лькост≥ розчинених речовин. ¬≥дпов≥дно, дл€
реакц≥њ:
ј + ¬ = ј¬,
де 1 моль речовини ј реагуЇ з 1 молем речовини ¬, необх≥дно
вз€ти р≥вн≥ обТЇми розчин≥в цих речовин з однаковою мол€рною
концентрац≥Їю. якщо взаЇмод≥Ї 1 моль речовини ј з 2 мол€ми
речовини ¬, то обТЇм розчину ¬ необх≥дно вз€ти вдв≥ч≥ б≥льший,
н≥ж обТЇм розчину ј, тощо.
ћол€льна концентрац≥€ (—m або m) показуЇ, €ка к≥льк≥сть роз-
чиненоњ речовини припадаЇ на 1 кг розчинника в даному розчин≥.
ќдиниц≥ вим≥ру Ч моль/кг. “ак, 1m розчину NaOH означаЇ, що у
к≥лограм≥ води даного розчину знаходитьс€ 1 моль г≥дроксиду на-
тр≥ю, тобто 40 г.
ћол€рна концентрац≥€ екв≥валента (екв≥валентна або нормальна
концентрац≥€) —Ќ показуЇ к≥льк≥сть моль-екв≥валент≥в розчиненоњ ре-
човини, €ка м≥ститьс€ в 1 л розчину:
—Ќ =
m
EmV, оск≥льки
m
Em = n, тод≥ —Ќ =
n
V
,
де Em Ч екв≥валентна маса розчиненоњ речовини.
≤з сп≥вв≥дношенн€ —Ќ =
n
V
випливаЇ, що мол€рна концентра-
ц≥€ екв≥валента визначаЇтьс€ в≥дношенн€м числа моль-екв≥валент≥в
|
|
|
розчиненоњ речовини до обТЇму розчину. Ќаприклад, 1н розчин
с≥рчаноњ кислоти м≥стить 1 моль-екв≥валент H2SO4 або 49 г в 1 л
розчину; 0,01н Ч 0,01 моль-екв≥валент або 0,49 г H2SO4 в 1 л роз-
чину. ќсоблив≥стю розчин≥в з мол€рною концентрац≥Їю екв≥валент≥в
Ї те, що розчини з однаковою концентрац≥Їю реагують м≥ж собою у
р≥вних обТЇмах, оск≥льки м≥ст€ть р≥вн≥ к≥лькост≥ моль-екв≥валент≥в. якщо
розчини мають р≥зн≥ концентрац≥њ, то в≥дпов≥дно до закону екв≥ва-
лент≥в њх обТЇми обчислюють ≥з сп≥вв≥дношенн€:
—Ќ1V1 = CH2V2 або
C
C
H
H
=
V
V
,
де V1 i V2 Ч обТЇми розчин≥в реагуючих речовин, —Ќ1 ≥ CH2 Ч мо-
л€рн≥ концентрац≥њ екв≥валент≥в цих розчин≥в.
“аким чином, обТЇми розчин≥в реагуючих речовин обернено про-
порц≥йн≥ до њх мол€рних концентрац≥й екв≥валент≥в. ÷≥ властивост≥
розчин≥в використовують не лише дл€ обчисленн€ обТЇм≥в, але й
навпаки, за обТЇмами розчин≥в, €к≥ витрачен≥ на реакц≥ю, визна-
чають њх концентрац≥њ.
“итр розчину (“) показуЇ, ск≥льки грам≥в або м≥л≥грам≥в роз-
чиненоњ речовини м≥ститьс€ в одному м≥л≥л≥тр≥ розчину. ќдиниц≥
вим≥ру Ч г/мл або мг/мл.
T =
m
V
.
“ак, €кщо в 1 л розчину м≥ститьс€ 40 г г≥дроксиду натр≥ю, то титр
цього розчину дор≥внюЇ:
“ =
= 0,0400 г/мл.
ћ≥ж титром та мол€рною концентрац≥Їю екв≥валента ≥снуЇ
залежн≥сть:
T =
CHEm
.
–озчинн≥сть
«датн≥сть речовин розчин€тис€ в тому чи ≥ншому розчиннику за
даних умов називають розчинн≥стю. якщо достатню к≥льк≥сть крис-
тал≥чноњ речовини, €ка розчин€Їтьс€, внести у певну к≥льк≥сть
розчинника, то в так≥й систем≥ водночас в≥дбуваютьс€ два взаЇм-
но протилежних процеси: в≥д поверхн≥ кристал≥в речовини, що
розчин€Їтьс€, в≥дриваютьс€ окрем≥ молекули або ≥они. «авд€ки ди-
фуз≥њ останн≥ р≥вном≥рно розпод≥л€ютьс€ в усьому обТЇм≥ розчин-
ника. ќдночасно з розчиненн€м в≥дбуваЇтьс€ зворотний процес Ч
кристал≥зац≥€. „астинки розчиненоњ речовини, €к≥ перейшли в роз-
чин, прит€гуютьс€ поверхнею речовини, €ка ще не розчинилас€,
≥ кристал≥зуютьс€. Ўвидкост≥ розчиненн€ та кристал≥зац≥њ залежать
в≥д концентрац≥њ розчину. ќчевидно, у перший момент швидк≥сть
розчиненн€ перевищуЇ швидк≥сть кристал≥зац≥њ. јле в м≥ру зб≥льшен-
н€ концентрац≥њ розчиненоњ речовини в розчин≥ зростаЇ швидк≥сть
кристал≥зац≥њ та наступаЇ момент, коли швидкост≥ розчиненн€ та
кристал≥зац≥њ стають однаковими:
Vрозчиненн€ = Vкристал≥зац≥њ
” систем≥ встановлюЇтьс€ динам≥чна р≥вновага, при €к≥й за одиницю
часу розчин€Їтьс€ ст≥льки молекул, ск≥льки њх вид≥л€Їтьс€ з розчину.
–озчин, €кий знаходитьс€ в р≥вноважному стан≥ з речовиною, що
розчин€Їтьс€, називають насиченим розчином.
онцентрац≥ю розчиненоњ речовини у насиченому розчин≥ при дан≥й
температур≥ називають розчинн≥стю. –озчинн≥сть чисельно вира-
жають такими ж способами, €к ≥ мол€рну концентрац≥ю (моль/л,
г/л). „асто розчинн≥сть виражають у грамах безводноњ речовини,
€ка насичуЇ 100 г розчинника при задан≥й температур≥. ¬иражену
таким чином розчинн≥сть називають коеф≥ц≥Їнтом розчинност≥. Ќа-
приклад, при 20 ∞— в 100 г води розчин€Їтьс€ 35,9 г хлориду на-
тр≥ю, 31,6 г н≥трату кал≥ю, 0,16 г г≥дроксиду кальц≥ю. ¬≥дпов≥дно,
коеф≥ц≥Їнти розчинност≥ цих сполук дор≥внюють 35,9; 36,1 та 0,16.
Ќаведен≥ значенн€ коеф≥ц≥Їнт≥в розчинност≥ показують, що за даних
умов найменш розчинною речовиною Ї г≥дроксид кальц≥ю, а най-
б≥льш розчинною Ч хлорид натр≥ю.
“аким чином, концентрац≥€ насиченого розчину Ї к≥льк≥сною
характеристикою здатност≥ речовин розчин€тис€ у даному розчин-
нику при задан≥й температур≥.
якщо в 100 г води розчин€Їтьс€ б≥льше 10 г речовини, то таку
речовину називають добре розчинною; €кщо розчин€Їтьс€ менш 1 г
речовини Ч малорозчинною; €кщо розчин€Їтьс€ менш 0,01 г речо-
вини Ч практично нерозчинною.
–озчинн≥сть речовин залежить в≥д природи розчинника ≥ речо-
вини, €ка розчин€Їтьс€, а також в≥д умов розчиненн€ (темпера-
тури, тиску, концентрац≥њ, на€вност≥ ≥нших розчинених речовин).
ƒо цього часу не ≥снуЇ науковоњ теор≥њ, €ка дозвол€ла б вивести
загальн≥ закони розчиненн€. «вичайно користуютьс€ практично
встановленим правилом Ђпод≥бне розчин€Їтьс€ в под≥бномуї. ÷е оз-
начаЇ, що речовини, дл€ €ких характерн≥ ≥онний та пол€рний типи
звТ€зку, краще розчин€ютьс€ у пол€рних розчинниках (вода, спир-
ти, р≥дкий ам≥ак, оцтова кислота тощо). Ќавпаки, речовини з не-
пол€рним або малопол€рним типом звТ€зку добре розчин€ютьс€ в
непол€рних розчинниках (ацетон, с≥рковуглець, бензол тощо).
ѕри розчиненн≥ твердих речовин значна к≥льк≥сть енерг≥њ вит-
рачаЇтьс€ на руйнуванн€ кристал≥чноњ реш≥тки, тому розчинн≥сть
|
|
|
б≥льшост≥ твердих речовин зростаЇ з п≥двищенн€м температури.
ќднак ≥снують тверд≥ речовини, розчинн≥сть €ких практично не
зм≥нюЇтьс€ або нав≥ть зменшуЇтьс€ з п≥двищенн€м температури.
ѕрикладом перших Ї хлорид натр≥ю, а других Ч сульфат та г≥дро-
ксид кальц≥ю.
–озчинн≥сть твердих речовин залежно в≥д температури прий-
н€то зображати граф≥чно у вигл€д≥ кривих розчинност≥ (рис. 32).
÷≥ крив≥ будують за експериментальними даними; в≥дкладають на
ос≥ абсцис температуру, а на ос≥ ординат Ч розчинн≥сть, г/100 г
Ќ2ќ. «а кривими розчинност≥ можна зробити висновок про роз-
чинн≥сть речовин. “ак, х≥д кривих розчинност≥ н≥трат≥в ср≥бла,
кал≥ю та свинцю показуЇ, що з п≥двищенн€м температури роз-
чинн≥сть цих речовин суттЇво зростаЇ. ћайже горизонтальний х≥д
кривоњ розчинност≥ хлориду натр≥ю св≥дчить про незначну зм≥ну
його розчинност≥ з п≥двищенн€м тем-
ператури.
–озчинн≥сть б≥льшост≥ твердих ре-
човин зменшуЇтьс€ ≥з зниженн€м тем-
ператури, тому при охолодженн≥ га-
р€чих насичених розчин≥в надлишок
розчиненоњ речовини вид≥л€Їтьс€ у
вигл€д≥ кристал≥в.
¬ид≥ленн€ речовини при охолод-
женн≥ насиченого розчину називають
кристал≥зац≥Їю (перекристал≥зац≥Їю).
ристал≥зац≥ю з розчин≥в або пере-
кристал≥зац≥ю широко застосовують
дл€ очистки речовин, €к≥ розчин€ють-
с€ у вод≥ або ≥нших розчинниках.
ѕри обережному та пов≥льному
охолодженн≥ насиченого розчину
кристал≥зац≥€ може не в≥дбутис€. ”
цьому випадку одержують розчин, €кий
м≥стить значно б≥льшу масу розчине-
ноњ речовини, н≥ж њњ може розчинитис€
до утворенн€ насиченого при дан≥й
температур≥ розчину. “акий розчин на-
–ис. 32. рив≥ розчинност≥
твердих речовин
г/100 г H2O
зивають пересиченим. ѕересичен≥ розчини Ч термодинам≥чно
нест≥йк≥ системи. ѕри струшуванн≥ розчину, попаданн≥ в нього
пилу або при додаванн≥ кристалу розчиненоњ речовини в≥дбуваЇть-
с€ миттЇва кристал≥зац≥€. ѕересичен≥ розчини легко утворюють
хлорид, сульфат ≥ карбонат натр≥ю, тетраборат натр≥ю (бура) тощо.
–озчинн≥сть р≥дин у р≥динах може бути повною чи обмеженою.
Ѕ≥льш поширена обмежена розчинн≥сть. ѕри повн≥й взаЇмн≥й роз-
чинност≥ р≥дини зм≥шуютьс€ у будь-€ких сп≥вв≥дношенн€х (спирт-
вода). –≥дини з обмеженою взаЇмною розчинн≥стю завжди утворюють
два шари. ѕрикладом системи з обмеженою розчинн≥стю Ї система
ан≥л≥н-вода. ѕри зм≥шуванн≥ цих р≥дин завжди ≥снуЇ два шари: верхн≥й
шар складаЇтьс€ в основному з води ≥ м≥стить ан≥л≥н у невеликих
к≥лькост€х (приблизно 13 %), нижн≥й шар, навпаки, складаЇтьс€ в
основному з ан≥л≥ну ≥ м≥стить близько 5 % води. ѕ≥двищенн€ темпера-
тури призводить до зб≥льшенн€ взаЇмного розчиненн€ р≥дин.
“емпературу, при €к≥й обмежена взаЇмна розчинн≥сть р≥дин
переходить в необмежену, називають критичною температурою
розчиненн€. ƒл€ системи ан≥л≥н-вода вона дор≥внюЇ 168 ∞—.
ѕравило, що под≥бне розчин€Ї под≥бне, часто використову-
ють дл€ взаЇмного розчиненн€ р≥дин. ” пол€рних розчинниках добре
розчин€ютьс€ р≥дини з пол€рним типом звТ€зку (спирти добре
розчин€ютьс€ у вод≥, спиртах тощо), а в непол€рних Ч з непол€р-
ним (вуглеводи Ч в вуглеводн€х, йод Ч в бензол≥).
“иск, €к правило, не впливаЇ на взаЇмне розчиненн€ р≥дин,
оск≥льки розчинн≥сть р≥дин не супроводжуЇтьс€ значною зм≥ною
обТЇму.
–озчинн≥сть газ≥в у р≥динах досить р≥зноман≥тна. Ќа нењ в значн≥й
м≥р≥ впливають температура та тиск. –озчинн≥сть газ≥в у вод≥ €вл€Ї
собою екзотерм≥чний процес (∆Ќ < 0), тому з п≥двищенн€м тем-
ператури розчинн≥сть газ≥в зменшуЇтьс€ (табл. 12). “ак, кипТ€т≥н-
н€м води можна видалити з нењ гази, €к≥ були розчинен≥.
–озчиненн€ газ≥в в орган≥чних розчинниках часто супровод-
жуЇтьс€ поглинанн€м теплоти (∆Ќ > 0), у под≥бних випадках роз-
чинн≥сть газ≥в зростаЇ з п≥двищенн€м температури.
«алежн≥сть розчинност≥ газ≥в в≥д тиску виражають законом √енр≥
(1803): маса газу, €кий розчин€Їтьс€ при стал≥й температур≥ в дано-
му обТЇм≥ р≥дини, пр€мо пропорц≥йна парц≥альному тиску газу. «акон
√енр≥ виражають р≥вн€нн€м:
— = kр,
де — Ч масова концентрац≥€ газу в насиченому розчин≥; р Ч пар-
ц≥альний тиск газу; k Ч коеф≥ц≥Їнт пропорц≥йност≥, €кий нази-
ваЇтьс€ константою (коеф≥ц≥Їнтом) √енр≥.
«а законом √енр≥, обТЇм газу, €кий розчин€Їтьс€ при стал≥й
температур≥ у даному обТЇм≥ р≥дини, залежить в≥д його парц≥аль-
ного тиску. ÷ей висновок випливаЇ з закону Ѕойл€ Ч ћар≥от-
та (1662) про залежн≥сть обТЇму газу в≥д тиску. –озчинн≥сть газ≥в
у р≥динах виражаЇтьс€ обТЇмом газу в м≥л≥л≥трах, €кий розчин€Їтьс€
в 100 мл розчинника при 0 ∞— (273 ) ≥ тиску 101,325 кѕа.
«акон √енр≥ стосуЇтьс€ лише дуже розведених розчин≥в при
пор≥вн€но невисокому тиску ≥ в≥дсутност≥ х≥м≥чноњ взаЇмод≥њ моле-
кул газ≥в, що розчин€ютьс€, з розчинником або один з одним.
ћехан≥зм утворенн€ розчин≥в
—амоплинний розпод≥л речовини, €ку розчин€ють, м≥ж мо-
лекулами розчинника називають розчиненн€м. ќднак розчиненн€
не можна розгл€дати €к механ≥чний процес, оск≥льки властивост≥
розчиненоњ речовини та розчинника зм≥нюютьс€ при утворенн≥
розчину. ѕро це св≥дчить р€д фактор≥в: обТЇм розчину н≥коли не
дор≥внюЇ сум≥ обТЇм≥в розчинника та розчиненоњ речовини. –озчи-
ненн€ звичайно супроводжуЇтьс€ вид≥ленн€м або поглинанн€м
теплоти, а ≥нколи й зм≥ною забарвленн€ розчину. ¬ окремих випад-
ках ц≥ ефекти мал≥, але у р€д≥ випадк≥в вони стають дуже пом≥тни-
ми. Ќаприклад, розчиненн€ н≥трат≥в супроводжуЇтьс€ сильним
охолодженн€м розчину, а розчиненн€ г≥дроксид≥в натр≥ю, кал≥ю
та с≥рчаноњ кислоти Ч сильним нагр≥ванн€м. ѕри зм≥шуванн≥ 500 мл
води з 500 мл етилового спирту обТЇм утвореного розчину стаЇ
р≥вним не 1 л, а 940 мл, тобто при розчиненн≥ спирту у вод≥ в≥дбу-
ваЇтьс€ стиск cистеми (обТЇм зменшуЇтьс€ на 6 %). ÷е €вище маЇ
назву контракц≥њ та обумовлено утворенн€м водневих звТ€зк≥в м≥ж
г≥дроксогрупами молекул спирту та молекулами води, а також
руйнуванн€м льодопод≥бних структур води. –озчиненн€ б≥лих кри-
стал≥в CuSO4 супроводжуЇтьс€ утворенн€м блакитного розчину, а
син≥х кристал≥в CoCl2 Ч рожевого. ”с≥ ц≥ €вища обумовлен≥ €к ф≥зич-
ними, так ≥ х≥м≥чними зм≥нами в загальн≥й систем≥ розчину.
¬ивченн€ розчин≥в спри€ло по€в≥ двох теор≥й њх утворенн€:
ф≥зичноњ та х≥м≥чноњ (друга половина XIX ст.). ѕредставники ф≥зич-
ноњ теор≥њ розчин≥в, основоположником €коњ був ¬ант-√офф, роз-
гл€дали розчиненн€ €к ф≥зичний процес. –озчинник €вл€Ї собою
де€ке ≥ндиферентне середовище, в €кому молекули розчиненоњ
речовини р≥вном≥рно розпод≥л€ютьс€ в усьому обТЇм≥ розчину за
рахунок сил дифуз≥њ. ѕри цьому виключаЇтьс€ м≥жмолекул€рна
взаЇмод≥€ €к м≥ж частинками розчиненоњ речовини, так ≥ м≥ж мо-
лекулами розчинника. ≥льк≥сне описанн€ властивостей розведе-
них розчин≥в було головною задачею ф≥зик≥в. ‘≥зики започаткува-
ли к≥льк≥сну теор≥ю, €ка дала можлив≥сть визначати де€к≥
властивост≥ розведених розчин≥в за њх в≥домою концентрац≥Їю (за-
кони –аул€, ¬ант-√оффа, √енр≥, закон розведенн€ ќствальда,
теор≥€ електрол≥тичноњ дисоц≥ац≥њ —. јррен≥уса).
ѕрихильники х≥м≥чноњ теор≥њ розчин≥в прагнули вивчити при-
роду €вищ, що виникають внасл≥док розчиненн€. ¬они вважали,
що м≥ж молекулами компонент≥в розчину маЇ м≥сце х≥м≥чна взаЇ-
мод≥€, €ка призводить до утворенн€ сум≥ш≥ б≥льш або менш ст≥йких
сполук частинок розчиненоњ речовини з молекулами розчинника.
“аке у€вленн€ про розчини вперше було сформульовано ƒ. ≤. ћен-
делЇЇвим на основ≥ численних експериментальних досл≥джень.
ƒл€
розвитку х≥м≥чноњ теор≥њ розчин≥в важливе значенн€ мали роботи
≤. ќ. аблукова, ћ. —. урнакова, ¬. ќ. ≥ст€ковського. ‘≥зична та
х≥м≥чна теор≥њ склали основу сучасноњ теор≥њ розчин≥в.
ѕроцес розчиненн€ Ч складний ф≥зико-х≥м≥чний процес. «а-
лежно в≥д природи компонент≥в та умов утворенн€ розчину (кон-
центрац≥њ, температури, тиску) можуть переважати або ф≥зичн≥,
або х≥м≥чн≥ €вища.
ƒо ф≥зичних €вищ належать €к простий розпод≥л молекул роз-
чиненоњ речовини серед молекул розчинника, так ≥ взаЇмод≥€ за
рахунок сил електричноњ природи: ≥он-дипольна, диполь-диполь-
на, взаЇмод≥€ м≥ж ≥онами протилежного знаку. ‘≥зичн≥ сили д≥ють
на далеких в≥дстан€х та упереджують х≥м≥чн≥, €к≥ д≥ють на в≥дстан€х
пор€дку д≥аметра молекул. ѓх ви€вленн€ повТ€зано з перебудовою
електронних оболонок атом≥в, молекул, ≥он≥в.
—укупн≥сть ус≥х процес≥в, €к≥ виникають внасл≥док по€ви в роз-
чиннику розчиненоњ речовини, називають сольватац≥Їю, дл€ вод-
них розчин≥в Ч г≥дратац≥Їю (≤. ќ. аблуков, 1891).
—полуки зм≥нного складу, €к≥ утворюютьс€ внасл≥док взаЇ-
мод≥њ молекул розчинника з частинками розчиненоњ речовини,
називають сольватами. якщо розчинник Ч вода, то сольвати на-
зивають г≥дратами. ≤снуванн€ г≥драт≥в зм≥нного складу в розчи-
нах с≥рчаноњ кислоти встановив ƒ. ≤. ћенделЇЇв (H2SO4⋅ H2O,
H2SO4⋅ 2H2O, H2SO4⋅ 6H2O тощо). ≤з розчину спирту в≥н вид≥лив
г≥драт складу —2Ќ5ќЌ⋅ 3H2O.
јналог≥чн≥ сполуки (сольвати) можуть утворюватис€ в невод-
них розчинах, наприклад, —2Ќ5ќЌ⋅ HF у р≥дкому HF; SO2⋅ BCl3
у р≥дкому SO2 тощо.
–озчинн≥сть Ч це взаЇмод≥€ м≥ж частинками р≥зноњ природи.
ѕродуктами такоњ взаЇмод≥њ можуть бути ≥они, молекули, або т≥
≥ друг≥ одночасно. Ќе можна зрозум≥ти складних €вищ у розчин≥
≥ надати йому в≥рну характеристику, не враховуючи впливу вс≥х
фактор≥в на механ≥зм утворенн€ розчину.
ѕри розчиненн≥ ≥онних сполук процес сольватац≥њ починаЇть-
с€ з ор≥Їнтац≥њ диполей води в≥дносно ≥он≥в у кристал≥чн≥й реш≥тц≥.
Ќаприклад, при розчиненн≥ хлориду кал≥ю м≥ж молекулами води
д≥ють водневий звТ€зок та сили ван-дер-ваальса (ор≥Їнтац≥йн≥ сили).
ћ≥ж ≥онами кал≥ю та хлору, €к≥ розташован≥ на поверхн≥ кристалу
хлориду кал≥ю, та молекулами води виникаЇ ≥он-дипольна взаЇ-
мод≥€. ћолекули води повод€тьс€ таким чином, що до ≥она +
повертаютьс€ негативним, а до ≥она ClЦ Ч позитивним полюсом
дипол€. ¬иникаЇ ≥он-дипольна взаЇмод≥€, внасл≥док чого ≥они ка-
л≥ю та хлору в≥дриваютьс€ в≥д кристала, г≥дратуютьс€ та дифунду-
ють до розчинника. “ож кристал хлориду кал≥ю розпадаЇтьс€ на
г≥дратован≥ ≥они, €к≥ утворюють з водою гомогенну систему Ч ≥он-
ний розчин (рис. 33).
–ис. 33. —хема електрол≥тичноњ дисоц≥ац≥њ хлориду кал≥ю у водному розчин≥
ѕри цьому молекули води утримуютьс€ б≥л€ утворених ≥он≥в
€к за рахунок електростатичних сил, так ≥ за рахунок донорно-
акцепторноњ взаЇмод≥њ. ¬ останньому випадку позитивно зар€джен≥
≥они (кат≥они) розчиненоњ речовини Ї акцепторами, а молекули
води (розчинника) Ч донорами електронних пар. ¬ результат≥ у
водних розчинах в≥дбуваЇтьс€ утворенн€ г≥дратованих аквакомп-
лекс≥в. ” кат≥онних аквакомплексах ≥они звТ€зан≥ з молекулами води
за рахунок донорно-акцепторноњ взаЇмод≥њ, а в ан≥онних акваком-
плексах Ч за рахунок водневого звТ€зку:
јквакомплекси в свою чергу оточен≥ молекулами води за ра-
хунок водневих звТ€зк≥в.
ѕри розчиненн≥ речовин з ковалентним пол€рним типом звТ€з-
ку г≥драти (сольвати) утворюютьс€ внасл≥док диполь-дипольноњ
взаЇмод≥њ.
” результат≥ диполь-дипольноњ взаЇмод≥њ молекули води пол€ризу-
ють молекули H—l, викликаючи розТЇднанн€ полюс≥в молекули.
¬≥дбуваЇтьс€ дисоц≥ац≥€ пол€рноњ молекули на ≥они (рис. 34).
–ис. 34. —хема електрол≥тичноњ дисоц≥ац≥њ HCl п≥д д≥Їю розчинника
як ≥ у випадку розчиненн€ ≥онного кристала, ≥они H+ та ClЦ г≥дра-
туютьс€ та переход€ть у розчин.
ќдним ≥з насл≥дк≥в г≥дратац≥њ (сольватац≥њ) Ї здатн≥сть речо-
вин при вид≥ленн≥ з розчину звТ€зувати де€ку к≥льк≥сть води:
BaCl2⋅ 2H2O, CuSO4⋅ 5H2O, Na2CO3 ⋅ 10H2O, Na2SO4⋅ 10H2O. –ечо-
вини, кристали €ких м≥ст€ть молекули води, називають кристало-
г≥дратами, а воду Ч кристал≥зац≥йною. ристалог≥драти у багатьох
випадках нест≥йк≥ сполуки, при нагр≥ванн≥ вони втрачають воду.
ристал≥зац≥йна вода, наприклад, з Na2CO3⋅ 10H2O видал€Їтьс€
вже при к≥мнатн≥й температур≥, Na2SO4⋅ 10H2O втрачаЇ воду при
32 ∞—, дл€ зневодненн€ CuSO4⋅ 5H2O потр≥бне досить сильне на-
гр≥ванн€.
≈нергетичн≥ ефекти при розчиненн≥. ѕри розчиненн≥ руйнують-
с€ звТ€зки м≥ж молекулами, атомами та ≥онами в речовин≥, €ка
розчин€Їтьс€, ≥ у розчиннику, що повТ€зано з витратою енерг≥њ
(≈). ѕроцес сольватац≥њ Ч процес взаЇмод≥њ молекул розчинника з
частинками розчиненоњ речовини супроводжуЇтьс€ вид≥ленн€м
енерг≥њ (∆Ќсольв). —умарний енергетичний ефект процесу розчинен-
н€ €вл€Ї собою алгебрањчну суму теплоти, €ка поглинаЇтьс€ та
вид≥л€Їтьс€:
∆Ќрозч = Ц≈ + ∆Ќсольв
якщо енерг≥€ розриву звТ€зк≥в у речовин≥, що розчин€Їтьс€, ≈
б≥льша за енерг≥ю, €ка вид≥л€Їтьс€ внасл≥док сольватац≥њ ∆Ќсольв,
то спостер≥гаЇтьс€ охолодженн€ розчину (∆Ќрозч > 0). якщо
∆Ќсольв> ≈, то розчин нагр≥ваЇтьс€ (∆Ќрозч < 0). ≥льк≥сть теплоти,
€ка вид≥л€Їтьс€ або поглинаЇтьс€ при розчиненн≥ одного мол€ речови-
ни за даних умов, називають теплотою розчиненн€.
—ольвати не можна розгл€дати €к х≥м≥чн≥ сполуки, оск≥льки њх
склад зм≥нюЇтьс€ залежно в≥д концентрац≥њ розчину та температу-
ри. “ак, число молекул розчинника, €к≥ звТ€зан≥ з частинками роз-
чиненоњ речовини, з п≥двищенн€м температури зменшуЇтьс€, а ≥з
зменшенн€м концентрац≥њ Ч зростаЇ. ƒо процесу розчиненн€ не
можна застосовувати стех≥ометричн≥ закони. ќднор≥дн≥сть розчин≥в
спор≥днюЇ њх з х≥м≥чними сполуками, а зм≥нний склад Ч набли-
жаЇ њх до механ≥чних сум≥шей.
ћ≈“ќƒ»„Ќј –ќ«–ќЅ ј ƒЋя ќ–√јЌ≤«ј÷≤ѓ
ѕќ«јј”ƒ»“ќ–Ќќѓ —јћќ—“≤…Ќќѓ –ќЅќ“» —“”ƒ≈Ќ“≤¬
ѕредмет: Ѕ≥онеорган≥чна х≥м≥€
упс: 1
—пец≥альн≥сть: —естринська справа
“ема: р≥вновага в розчинах електрол≥т≥в. —ильн≥, слабк≥ електрол≥ти. √≥дрол≥з солей.
≥льк≥сть навчальних годин: 3
1. јктуальн≥сть теми
≈лектрол≥ти в≥д≥грають важливу роль у життЇд≥€льност≥ орган≥зму, тому, що вс≥ ф≥з≥олог≥чн≥ р≥дини Ї розчинами електрол≥т≥в. « на€вн≥стю цих сполук повТ€зане певне значенн€ осмотичного тиску на Ph середовище б≥олог≥чних р≥дин. ≈лектрол≥ти утримують воду у вигл€д≥ г≥драт≥в, протид≥ючи зневодненню орган≥зму.
Ќавчальна мета
«нати: 1 ўо називаЇтьс€ електрол≥тами.
2 «наченн€ розчин≥в електрол≥т≥в дл€ орган≥зму.
¬м≥ти: 1 «аписувати р≥вн€нн€ реакц≥й електрол≥тичноњ дисоц≥ац≥њ.
2 ¬ираховувати ступ≥нь дисоц≥ац≥њ.
3 ¬изначати належн≥сть електрол≥т≥в до слабких, сильних по ступеню дисоц≥ац≥њ.
3. ћатер≥али до аудиторноњ самост≥йноњ роботи
3.1 Ѕазов≥ знанн€, вм≥нн€, навички, необх≥дн≥ дл€ вивченн€ теми:
| ƒисципл≥ни | «нати | ¬м≥ти |
| Ѕ≥оорган≥чна х≥м≥€ | ќсновн≥ класи неорган≥чних сполук. | «аписати формули електрол≥т≥в, кислот, розчинних солей. |
| ћедична б≥олог≥€ | Ѕ≥олог≥чн≥ р≥дини | Ќазвати б≥олог≥чн≥ р≥дини. |
3.2 «м≥ст теми:
Ўведський х≥м≥к —.јррен≥ус у 1887 роц≥ обірунтував теор≥ю електрол≥тичноњ дисоц≥ац≥њ. ≈лектричною дисоц≥ац≥Їю називають процесс розщепленн€ сполуки на йони внасл≥док њњ взаЇмод≥њ з розчинником.
«а теор≥Їю —.јррен≥уса, кислоти Ц це електрол≥ти, €к≥ дисоц≥юють з утворенн€м кат≥он≥в Ќ⁺ та ан≥он≥в кислотного залишку: HAn←→ H⁺+An¯.
ќснови Ц це електрол≥ти, €к≥ в насл≥док дисоц≥ац≥њ утворюють г≥дроксид йону ќЌ¯ та кат≥они металу або амон≥ю: K+OH←→Kt⁺+OH¯.
—ильн≥ електрол≥ти Ц а > 0,3 (30%)
—ередн≥ електрол≥ти Ц 0,3 >а > 0,03; а < 3%
—лабк≥ електрол≥ти а < 0,03 (3%)
¬одневий показник Ph Ц показник йон≥в г≥дрогену в розчин≥: Ph = -[g[H³O⁺] = -Lg[H⁺]
PK=Ph+pOH=14
Ph середовище розчин≥в сильних ≥ слабких кислот та основ зм≥нюютьс€ в ≥нтервал≥ в≥д 0 до 14.
«наченн€ Ph Ї важливою характеристикою вс≥х ф≥з≥олог≥чних р≥дин. Ќаприклад: шлунковий с≥к Ц 1,65; кров Ц 7,36; сеча Ц 5,8; слина Ц 6,75.
√≥дрол≥зом називають обм≥нну реакц≥ю йон≥в сол≥ з водою, що призводить до утворенн€ слабких електрол≥т≥в.
—ол≥ за њх походженн€ под≥л€ють на чотири типи:
1) —ол≥, утворен≥ сильною основою ≥ сильною кислотою;
2) —ол≥, утворен≥ слабкою кислотою ≥ сильною основою;
3) —ол≥, утворен≥ сильною кислотою ≥ слабкою основою;
4) —ол≥ утворен≥ слабкою кислотою ≥ слабкою основою.
5)
3.3 –екомендована л≥тература
ќсновна: ¬. ѕ. ћузиченко Ђћедична х≥м≥€ї
ƒопом≥жна: Ќ. ѕ. √ирина ЂЌеорган≥чна х≥м≥€ї (практикум)
3.4 ќр≥Їнтовна карта дл€ самост≥йноњ роботи з л≥тературою з теми:
Ђ—ильн≥ та слабк≥ електрол≥ти. √≥дрол≥з солейї
| ќсновн≥ завданн€ | ¬каз≥вки | ¬≥дпов≥д≥ |
| 1 ≈лектрична дисоц≥ац≥€ | ќзнайомитис€ з правилом. | «аписати вираз електрол≥тичного процесу в пон€тт€х |
| 2 ≈лектрол≥ти та неелектрол≥ти | –озгл€нути класи кислот, основ. | —класти таблицю сильних та слабких кислот та основ |
| 3 ≈лектрол≥ти сильн≥ кислоти, сильн≥ основи. | ќзнайомитис€ з прикладами сильних кислот та основ. | «аписати реакц≥њ електрол≥тичноњ дисоц≥ац≥њ сильних кислот та сильних основ. |
| 4 —лабк≥ електрол≥ти Ц слабк≥ кислоти, слабк≥ основи. | ѕриклади кислот та основ. | —класти р≥вн€нн€ реакц≥й слабких кислот. |
| 5 “ипи солей, њх характеристика. | –озгл€нути реакц≥њ утворенн€ солей в результат≥ взаЇмод≥њ кислот ≥ основ. | —класти р≥вн€нн€ реакц≥й г≥дрол≥зу кожного типу солей. Ќазвати Ph середовища ≥ зм≥ну кольору ≥ндикатору. |
3.5 ћатер≥али дл€ самоконтролю: питанн€, тести, задач≥.
1. як≥ речовини належать до електрол≥т≥в, а €к≥ Ц до неелектрол≥т≥в: CaC₂, HCOOH, KOH, C₁₂H₂₂O₁₁, AyNO₃, C₂H₅OH? «аписати реакц≥њ електрол≥тичноњ дисоц≥ац≥њ електрол≥т≥в.
Ќаписати формулу йон≥в що вход€ть? до складу внутр≥шньокл≥тинних ≥ позакл≥тинних р≥дин.
1. як≥ величини використовуютьс€ дл€ оц≥нюванн€ кислотност≥ середовища? ўо таке Ph ≥ POh?
2. яка з ф≥з≥олог≥чних р≥дин маЇ найб≥льшу, а €ка найменшу кислотн≥сть?
” €ких межах можливе коливанн€ Ph кров≥? Ќазв≥ть значенн€ Ph артер≥альноњ та венозноњ кров≥.
3. як≥ з солей зазнають г≥дрол≥зу: C₂SO₄, NA₂SO₄, Ca (NO₃)₂, KCN, FeCl₃, Na₃PO₄, Cr₂S₃, Zm(NO₃)₂ —клад≥ть р≥вн€нн€ г≥дрол≥зу, вкаж≥ть Ph середовища.
–≥вновага в розчинвх електрол≥т≥в
–озчини електрол≥т≥в та њх значенн€
”с≥ х≥м≥чн≥ сполуки за њх здатн≥сть проводити електричний струм под≥л€ють на електрол≥ти та неелектрол≥ти.
≈лектрол≥ти - це речовини, €к≥ провод€ть електричний струм €к у розплавленому стн≥, так ≥ в розчинах. ƒо них належать де€ка≥ основи та сол≥, €к≥ у твердому ста≥ складаютьс€ з йон≥в, наприклад, ќЌ, NаќЌ, —L, —а—12, LiF та ≥н.; речовини, що утворюють йони при розчиненн≥ њх у вод≥ (амон≥ак, фтороводень, орган≥чн≥ кислоти тощо). ѕри розчиненн≥ у вод≥ електрол≥ги дисоц≥юють на кат≥они й ан≥они, що взаЇмод≥ють €к з водою, так ≥ м≥ж собою. Ќеелектрол≥ти не провод€ть струм, оск≥льки складаютьс€ з молекул, що не розпадаютьс€ на йони, наприклад гл≥церин, етанол, глюкоза, сахароза тощо.
≈лектрол≥ти в≥д≥грають важливу роль у життЇд≥€льност≥ орган≥зму, тому що вс≥ ф≥з≥олог≥чн≥ р≥дини (шлунковий с≥к, плазма кров≥, м≥жкл≥тинна, внутр≥шньокл≥тинна, спинномозкова р≥дини, секрети залоз) Ї розчинами електрол≥т≥в. 3 на€вн≥стю цих сполук пов'€зане певне значени€ осмотичного тиску та рЌ середовища б≥олог≥чних р≥дин. ≈лектрол≥ти здатн≥ утримувати воду у вигл€д1 г≥драт≥в, протид≥ючи зневодненню орган≥зму. онцентрац≥€ електрол≥тв у ф≥з≥олог≥чних розчинах впливаЇ на розчиннсть б≥лк≥в, ам≥нокислот ≥ низькомолекул€рних сполук.
” плазм≥ кров≥ вм≥ст кат≥он≥в, в основному м≥кроелемент≥в - Nа⁺, ⁺, —а2⁺, ћg²+, становить 154 ммоль/дм3. Ќа неорган≥чн≥ ан≥они - —Lˉ, Ќ—ќ₃ˉ, Ќ2–0₄ˉ, Ќ–04²ˉта Sќ²₄- - припадаЇ близько 133 ммоль/дм3, а решту 21 ммоль/дм3 ста-новл€ть ан≥они орга≥чних кислот та макро≥они б≥лк≥в (див. табл. 6.3).
«начну роль у функц≥нуванн≥ орган≥зму в≥д≥грають також пол≥електрол≥ти (див. ч. II, розд. 8).
ќтже, дл€ розум≥нн€ багатьох б≥олог≥чних €вищ потр≥бно знати законом≥р-ност≥, €ким п≥дпор€дковуютьс€ розчини електрол≥т≥в, вм≥ти к≥льк≥сно схарак-теризувати р≥вноважн≥ процеси, що в≥дбуваютьс€ в умовах ф≥з≥олог≥чного се-редовища орган≥зму, а саме: електрол≥тичну дисоц≥ац≥ю, реакц≥њ протол≥зу та г≥дрол≥зу, утворенн€ ≥ розчиненн€ осад≥в, утворенн€ та руйнуванн€ комплек-сних сполук, окисненн€ та в≥дновленн€ речовин.
ƒл€ будь-€коњ оборотноњ ’≥ћ≥„Ќ0њ реакц≥њ можна записати математичний вираз константи р≥вноваги в загальному вигл€д≥:
ај + b¬←→с— + d¬; = 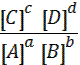 .
.
ѕроте кожний тип р≥вноважного процесу, €кий розгл€датимемо в цьому розд≥Ћ≥, характеризуЇтьс€ своею константою р≥вноваги. ÷≥ константи позначимо так: д, а, ь - константи, що характеризують реакц≥њ дисоц≥ац≥њ ≥ протол≥зу електрол≥т≥в, . - константа процесу г≥дрол≥зу, , - константа розчинност≥ важкорозчинних електрол≥т≥в, або добуток розчинност≥ (ƒ–), и. - йонний добуток води.
≈лектрол≥тична дисоц≥ац≥€ електрол≥т≥в
ѕри вивченн≥ розчин≥в увагу вчених привернув той факт, що експеримен≠тально знайден≥ значенн€ осмотичного тиску, в≥дносного зниженн€ тиску на≠сиченоњ пари, п≥двищенн€ температури кип≥нн€ та зниженн€ температури за≠мерзанн€ в≥др≥зн€лис€ в≥д цих величин, обчислених теоретично. “ак, експери≠ментальн≥ значенн€ величин л, ƒр, ƒ“кип, ƒ“зам таких речовин, €к глюкоза, цу≠кроза, гл≥церин, узгоджувалис€ з теоретичними значенн€ми, визначеними за р≥вн€нн€ми ¬ант-√оффа ≥ –аул€ (див. п. 2.6, 2.7). ƒл€ розчин≥в неорган≥чних речовин (кислот, основ ≥ солей) спостер≥галис€ значн≥ в≥дхиленн€; теоретичн≥ значенн€ ви€вились меншими в≥д експериментальних. ÷е дало п≥дставу дл€ припущенн€, що молекули неорган≥чних речовин розпадаютьс€ пщ д≥Їю роз≠чинника на менш≥ частинки. “аке передбаченн€ вперше висловив шведський ф≥зико-х≥м≥к —. јррен≥ус, €кий у 1887 р. обірунтував теор≥ю електрол≥тич≠ноњ дисоц≥ац≥њ.
≈лектрол≥тичною дисоц≥ац≥Їю називають процес розщепленн€ сполуки на йони внасл≥док њњ взаЇмод≥њ з розчинником.
” процес≥ дисоц≥ац≥њ утворюютьс€ не в≥льн≥ йони, а њх аквакомплекси, тобто г≥дратован≥ йони типу [ће(¬20)х)ⁿ⁺де п - зар€д кат≥она металу, х - в≥дпов≥дне координац≥йне число. ѕроте у р≥вн€нн€х електрол≥тичноњ дисоц≥ац≥њ дл€ спро≠щенн€ записують символи простих, а не г≥дратованих йон≥в.
«а теор≥Їю електрол≥тичноњ дисоц≥ац≥њ —. јррен≥уса,
кислоти - це електрол≥ти, €к≥ дисоц≥юють з утворенн€м кат≥он≥в √≥дро≠гену Ќ⁺ та ан≥он≥в кислотного залишку: Ќјn←→Ќ⁺ +јпˉ;
основи - це електрол≥ти, €к≥ внасл≥док дисоц≥ац≥њ утворюють г≥дроксид-≥они ќЌˉ та кат≥они металу або алюн≥ю: KtOЌ←→ t⁺+ ќЌˉ;
…они √≥дрогену H⁺ у водному середовищ≥ не ≥снують, оск≥льки вони миттЇво приЇднуютьс€ до молекул води (г≥дратуютьс€) з утворенн€м йон≥в г≥дроксон≥ю Ќ3O⁺ зар≥вн€нн€м Ќ⁺+ Ќ20←→Ќзќ⁺.
ќднак дл€ спрощенн€ користуватимемось пон€тт€м Ђ√≥дроген-≥онї, хоча насправд≥ у водних розчинах таких йон≥в практично немаЇ.
—ередн≥ сол≥ дисоц≥юють на кат≥они (Ktп⁺) ≥ ан≥они (јп ͫˉ) за р≥вн€нн€м
t јп = т tⁿ⁺ +пјптˉ
≥льк≥сною характеристикою процесу електрол≥тичноњ дисоц≥ац≥њ Ї ступ≥нь дисоц≥ац≥њ а та константа дисоц≥ац≥њ .
—тупенем дисоц≥ац≥њ електрол≥ту називають в≥дношенн€ числа молекул, що продисоц≥ювали, до загального числа молекул електрол≥ту:
α= 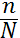 , або α=,
, або α=,
де п - число дисоц≥йованих молекул; N - загальне число молекул електрол≥ту; —днс ≥ —0 - в≥дпов≥дно концентрац≥€ молекул, що розпались на йони, ≥ початкова концентрац≥€ електрол≥ту, моль/дм3.
—туп≥нь дисоц≥ац≥њ зм≥нюЇтьс€ в≥д нул€ до одиниц≥ й залежить в≥д природи електрол≥ту та розчинника, концентрац≥њ речовини в розчин≥ й температури. “ому пор≥внювати електрол≥ти за значенн€м ступен€ дисоц≥ац≥њ можна т≥льки за однаковоњ концентрац≥њ й температури. ” розчинах з концентрац≥Їю 0,01-0,1 моль-екв/дм3 за температури 25 ∞— залежно в≥д ступен€ дисоц≥ац≥њ розр≥зн€≠ють:
-сильн≥ електрол≥ти - а>0,3 («ќ %);
-електрол≥ти середньоњ сили - 0,3>а>0,03;
-слабк≥ електрол≥ти - а < 0,03 (3 %).
≈лектрол≥ти середньоњ сили здеб≥льшого належать до слабких, наприклад, ЌN02, Ќ2S03, Ќ3–04, ћg(ќЌ)2 та ≥н. ћаючи значенн€ ступен€ дисоц≥ац≥њ, можна обчислити концентрац≥ю йон≥в у розчин≥:
—=—ел
ƒе — ≥ —ел - в≥дпов≥дно концентрац≥€ йон≥в ≥ електрол≥ту, моль/дм3; п - число йон≥в, утворених за сумарним р≥вн€нн€м електрол≥тичноњ дисоц≥ац≥њ.
—ильн≥ електрол≥ти. ƒо них належать сильн≥ кислоти - Ќ—104, ЌN03, Ќ—1, Ќ¬г, Ќ≤, Ќ—LO3, Ќ¬г03, Ќ2S04 (за першим ступенем дисоц≥ац≥њ), основи лужних ≥ лужноземельних метал≥в ≥ переважна б≥льш≥сть розчинних у вод≥ со≠лей.
–озчини сильних електрол≥т≥в за ф≥зико-х≥м≥чними властивост€ми в≥др≥з≠н€ютьс€ в≥д розчин≥в слабких електрол≥т≥в. —творюючи теор≥ю електрол≥тичноњ дисоц≥ац≥њ, —. јррен≥ус вважав, що в≥дм≥нн≥сть м≥ж ними пол€гаЇ лише у р≥зно≠му значенн≥ ступен€ дисоц≥ац≥њ. ѕроте подальш≥ експерименти доводили, що в розчинах сильних електрол≥т≥в ус≥ молекули розпадаютьс€ на йони. ¬одночас результати вим≥рюванн€ електропров≥дност≥ не в≥дпов≥дали у€вленн€м про њх повну дисоц≥ац≥ю, оск≥льки насправд≥ отримували дещо менш≥ значенн€ ступе≠н€ дисоц≥ац≥њ. “ому дл€ по€сненн€ ц≥Їњ нев≥дпов≥дност≥ дл€ розчин≥в сильних електрол≥т≥в ввели пон€тт€ про у€вний ступ≥нь дисоц≥ац≥њ та ≥зотон≥чний коеф≥≠ц≥Їнт ≥ (див. п. 2.6).
≤зотон≥чний коеф≥ц≥Їнт завжди б≥льший за одиницю. ¬≥н показуЇ, у ск≥ль≠ки раз≥в - число частинок (недисоц≥йованих молекул та утворених йон≥в) у роз≠чин≥ електрол≥ту б≥льше, н≥ж у розчин≥ неелектрол≥ту, за умови њх однаковоњ мол€рноњ концентрац≥њ (див. 2.6).
ѕо€сненн€ суперечливих даних стосовно повед≥нки сильних електрол≥т≥в даЇ теор≥€ ѕ. ƒеба€ ≥ √. √юккел€ (1923 р.), зг≥дно з €кою особливост≥ сильних електрол≥т≥в зумовлен≥ м≥ж≥онною взаЇмод≥Їю завд€ки електростатичним си≠лам. ” результат≥ кожний йон у розчин≥ утворюЇ навколо себе оболонку з йон≥в протилежного зар€ду, так звану ≥≥онну атмосферу.
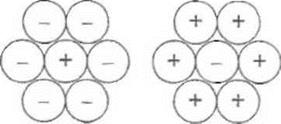
«ниженн€ рухливост≥ йон≥в по€снюють тим, що Ђйонна атмосфераї п≥д д≥Їю електричного пол€ рухаЇтьс€ у зворотному напр€мку, отже, йон п≥д впливом руху протилежно зар€джених частинок в≥дт€гуЇтьс€ назад. ÷€ електростатич≠на взаЇмод≥€ впливаЇ на термодинам≥чн≥ й к≥нетичн≥ властивост≥ електрол≥ту, њњ ефект залежить в≥д рад≥уса ц≥Їњ йонноњ оболонки та йонноњ сили розчину, €ку по≠значають ≤ ≥ визначають за формулою
≤ =  (—1Z12+C2Z22+Е+CnZn2)
(—1Z12+C2Z22+Е+CnZn2)
де —р —2, —л - концентрац≥њ в≥дпов≥дних йон≥в; Z - њхн≥ зар€ди.
…онна сила - це п≥всужа добутку концентрат≥ йон≥в на квадрат. њх зар€ду. ¬она Ї важливою характеристикою розчин≥в електрол≥т≥в, насамперед тих, що використовуютьс€ €к кровозам≥нники; њх йонна сила маЇ дор≥внювати 0,15 моль/дм3, тобто в≥дпов≥дати йонн≥й сил≥ плазми кров≥.
ƒл€ характеристики розчин≥в сильних електрол≥т≥в зам≥сть мол€рноњ кон≠центрац≥њ йон≥в користуютьс€ њхньою активн≥стю. ÷е пон€тт€ було введене в х≥м≥ю √. Ћьюњсом у 1907 р.
јктивн≥сть йон≥в - це њх ефективна, або умовна, концентрац≥€, що ви€в≠л€Їтьс€ у конкретних ф≥зико-х≥м≥чних умовах. ¬она дещо в≥др≥зн€Їтьс€ в≥д анал≥тичноњ концентрац≥њ йон≥в, обчисленоњ за р≥вн€нн€м (3.2). якщо в р≥вн€н≠н€ закону д≥њ мас зам≥сть концентрац≥њ п≥дставити активн≥сть, то воно справ≠джуЇтьс€ за будь-€ких концентрац≥й електрол≥ту. јктивн≥сть йон≥в пропор≠ц≥йна њх концентрац≥њ в розчин≥:
де а≥≥он - активн≥сть йона; f - коеф≥ц≥Їнт актр≥вност≥.
оеф≥ц≥Їнт активност≥ враховуЇ сили м≥ж≥онноњ взаЇмод≥њ в розчин≥; зде≠б≥льшого в≥н менший за одиницю ≥ т≥льки в дуже розбавлених розчинах f = 1, отже, в такому раз≥ а = —.
ƒл€ б≥нарних електрол≥т≥в за температури 298 коеф≥ц≥Їнт активност≥ об≠числюють за р≥вн€нн€м ƒеба€-√юккел€:
lg f = -0,5 Z2
—лабк≥ електрол≥ти. ” розчинах слабких електрол≥т≥в д≥ю силового пол€ ча≠стинок не враховують. ќск≥льки дисоц≥ац≥€ слабких електрол≥т≥в Ї оборотним процесом, то вона п≥дпор€дковуЇтьс€ закону д≥њ мас ≥ характеризуЇтьс€ кон≠стантою р≥вноваги.
розгл€немо дисоц≥ац≥ю одноосновних кислот типу Ќ—N, Ќќ—≤, ЌF, €к≥ у за≠гальному вигл€д≥ запишемо Ќјn: Ќјn. ←→Ќ⁺ + јnˉ.
ћатематичний вираз константи р≥вноваги пронесу дисоц≥ац≥њ маЇ такий вигл€д: Kд =  .
.
якщо початкова концентрац≥€ електрол≥ту дор≥внюЇ — (моль/дм3), а ступ≥нь його дисоц≥ац≥њ а, то концентрац≥€ недисоц≥йоваиих молекул становитиме — - —а, або — (1- а), а концентрац≥€ йон≥в, що утворились п≥д час дисоц≥ац≥њ, -а—. ѕ≥дставивши наведен≥ величини у р≥вн€нн€ константи дисоц≥ац≥њ, маЇмо:
Kд = 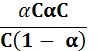 =
= 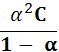 .
.
÷е р≥вн€нн€ називають математичним виразом закону розбавленн€ ќствальда дл€ б≥нарних електрол≥т≥в. ƒл€ слабких електрол≥т≥в, у розчинах €ких а < 1%, його спрощують, записуючи так:
Kд= α2C,
«в≥дки
α=
« р≥вн€нн€ випливаЇ, що ступ≥нь електрол≥тичноњ дисоц≥ац≥њ зростаЇ при розбавл€нн≥ розчину, оск≥льки це спри€Ї дисоц≥ац≥њ електрол≥т≥в.
онстанту р≥вноваги процесу дисоц≥ац≥њ електрол≥ту називають констан≠тою дисоц≥ац≥њ. ¬она Ї к≥льк≥сною м≥рою сили електрол≥ту ≥ характеризуЇ його здатн≥сть до йон≥зац≥њ. ўо б≥льше значенн€ константи дисоц≥ац≥њ яд, то
¬икористовуючи значенн€ констант дисоц≥ац≥њ, можна класиф≥кувати кис≠лоти й основи за њх силою (табл. 3.1).
онстанта електрол≥тичноњ дисоц≥ац≥њ Ї сталою величиною дл€ певного елек≠трол≥ту, вона залежить в≥д температури ≥, на в≥дм≥ну в≥д ступен€ дисоц≥ац≥њ, не залежить в≥д концентрац≥њ електрол≥ту. «наченн€ констант дисоц≥ац≥њ дл€ де≠€ких слабких електрол≥т≥в наведено у табл. 3.4.
Ѕагатоосновн≥ кислоти, багатокислотн≥ основи, кисл≥ й основн≥ сол≥ дисоц≥≠юють ступ≥нчасто, ≥ кожний ступ≥нь дисоц≥ац≥њ характеризуЇтьс€ певним зна≠ченн€м константи дисоц≥ац≥њ, €к≥ позначають в≥дпов≥дно , 2, 3. —умарна константа дисоц≥ац≥њ дор≥внюЇ добутку ступ≥нчастих констант дисоц≥ац≥њ:
«деб≥льшого перш≥ константи дисоц≥ац≥њ у 105 раз≥в б≥льш≥ за друг≥, а друг≥ в≥дпов≥дно б≥льш≥ за трет≥, тобто 1 > 2 > 3.
«азначимо, що в розчинах електрол≥т≥в х≥м≥чн≥ реакц≥њ переважно звод€тьс€ до взаЇмод≥њ м≥ж певними йонами. “ому р≥вн€нн€ реакц≥й сл≥д записувати в йонно-молекул€рн≥й форм≥, наприклад:
—аќт)+2Ќ+ =—а2⁺+Ќ₂0; Ќ3O⁺ + OHˉ =2Ќ20;
H₂S (г)+—u2⁺ =—uS↓+2Ќ+; ¬а2++S0²₄ˉ =¬аS04 ↓.
‘ормули малорозчинних електрол≥т≥в, твердих речовин, газ≥в та слабких електрол≥т≥в завжди записують у молекул€рн≥й форм≥.