виробництва сульфатної кислоти
| Сировина | Пірит FeS2, самородна сірка, сульфуровмісні гази, повітря |
| Каталізатор | Ванадій (V) оксид |
| Основний хімічний процес | Пірит піддають випалюванню киснем повітря: 4FeS2 + 11O2 → Fe2O3 + SO2 + 3310 кДж Випальний газ після ретельного очищення надходить до контактного апарату, де в присутності каталізатора за температури 450 оС окислюється до SO3. Сульфур (VІ) оксид поглинають концентрованою сульфатною кислотою. Утворюється олеум, з якого виробляють сульфатну кислоту будь-якої концентрації |
| Особливості процесу | 1. Виробництво безперервне. 2. Випал колчедану здійснюють у киплячому шарі, продуваючи в печі повітря, нагріте випальним газом. 3. Ретельно очищений випальний газ перед надходженням до контактного апарату нагрівають за рахунок теплоти, що виходить із контактного апарату. 4. У поглинальних баштах сульфур (VІ) оксид поглинають сульфатною кислотою протитоком. |
Застосування сульфатної кислоти
1. Виробництво кислот, лугів, солей, мінеральних добрив.
2. Виробництво органічних речовин (бензин, толуол, глюкоза), синтетичних миючих засобів
3. Виробництво вибухових речовин.
4. Виробництво штучного шовку, фарб.
5. Як електроліти в акумуляторах.
6. Для очистки нафтопродуктів.
7. Для травлення металів.
Застосування сульфатів у народному господарстві
| Назва солі | Хімічна формула | Застосування |
| Натрій сульфат (глауберова сіль) | Na2SO4 ∙ 10H2O | Для виробництва соди та у скляній промисловості |
| Кристалогідрат ферум (ІІ) сульфат (купорос залізний) | FeSO4 ∙ 7H2O | Як протрава для тканин у фарбувальній справі, у сільському господарстві, для очищення деревини |
| Кристалогідрат купрум (ІІ) сульфат (мідний купорос) | CuSO4 ∙ 5H2O | Для виробництва мідних покриттів та одержання різноманітних сполук Купруму, у сільському господарстві, для очищення деревини |
| Кристалогідрат цинк сульфат (купорос цинковий) | ZnSO4 ∙ 7H2O | У текстильній промисловості, для виробництва білої фарби |
| Магній сульфат | MgSO4 | У текстильній та паперовій промисловості, у медицині як проносне, а також для внутрішньовенних та внутрішньом’язевих вливань, у виробництві будівельних матеріалів |
НЕМЕТАЛИ П’ЯТОЇ ГРУПИ
ЕЛЕМЕНТИ V ГРУПИ ГОЛОВНОЇ ПІДГРУПИ
НІТРОГЕН ТА ФОСФОР
Порівняльна характеристика будови атомів
Нітрогену та Фосфору
| Атом Нітрогену N | Атом Фосфору P | |
| Розміщення електронів на енергетичних рівнях | +⑦)) 2 5 | +⑮))) 2 8 5 |
| Електронна формула | 1S22S22P3 | 1S22S22P63S23P3 |
| Розміщення електронів на орбіталях |
 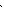   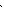 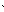                1S2 2S2 2P3 1S2 2S2 2P3
| 3S2 3P3
               3d0
3d0


|
Алотропні форми фосфору
| Білий (Р4) | Червоний (Р) | Чорний (Р) | |
| Кристалічні решітки | молекулярна | атомна | атомна |
| Фізичні властивості | Кристалічна речовина жовтого кольору, із запахом, світиться в темряві, нерозчинна у воді,отруйна, спалахує на повітрі, внаслідок нагрівання переходить у червоний фосфор | Порошок темно-червоного кольору, без запаху, не отруйний, не спалахує | Тверда речовина, має шарувату будову, жирна на дотик, добре проводить електричний струм, хімічно менш активна, ніж червоний фосфор; у разі тривалого нагрівання та під великим тиском утворюється з білого фосфору |
Порівняльна характеристика Нітрогену та Фосфору
| Ознаки для порівняння | Нітроген | Фосфор |
| Поширення в природі | Зустрічається у вільному стані (становить 78,16% об’єму повітря). У зв’яза-ному стані зустрічається в натрій нітраті, а також вхо-дить до складу білкових речовин і багатьох приро-дних органічних сполук | Зустрічається виключно у вигляді сполук (вміст у зе-мній корі становить 0,093%). Основні мінерали Фосфору – фосфорит і апа-тит, а також входить до складу білкових речовин |
| Фізичні властивості | Безбарвний газ, без запа-ху, переходить у рідкий стан за температури –195,8 оС, за −210 оС твердне | Утворює кілька алотропних видозмін, що значною мі-рою відрізняються фізич-ними властивостями |
| Хімічні властивості а) взаємодія з металами; б) взаємодія з неметалами (киснем, воднем) | 3Mg + N2 → Mg3N2 магній нітрид N2 + O2 ↔ 2NO нітроген (ІІ) оксид N2 + 3H2 ↔ 2NH3 амоніак | 3Mg + 2Р → Mg3Р2 магній фосфід 4Р + 3O2 → 2Р2О3 фосфор (ІІІ) оксид 4Р + 5O2 → 2Р2О5 фосфор (V) оксид 2Р + 3H2 ↔ 2РH3 фосфін |
| Застосування | Наповнюють електро-лампи (створення інерт-ного середовища) | Червоний фосфор засто-совують для виробництва сірників, також фосфор ви-користовують для одер-жання фосфорної кислоти, у виробництві отрутохімі-катів |
Характеристика амоніаку NН3
| Будова молекули | Молекула амоніаку має форму піраміди, в основі якої лежить трикутник з атомів Гідрогену, а у вершині – атом Нітрогену: N ̸ / \ Н Н Н Молекула амоніаку полярна: загальні електронні пари зміщені до атома Нітрогену. Крім того, в атома Нітрогену залишається неподілена пара електронів : NН3 Це збільшує полярність та зумовлює багато властивостей амоніаку |
| Фізичні властивості | Безбарвний газ із різким характерним запахом, легший за повітря, добре розчинний у воді |
| Хімічні властивості: а) розчинення у воді з утворенням розчину амоній гідроксиду; б) горить у кисні; в) взаємодія з кислотами. | NН3 + Н2О ↔ NН4ОН 4NН3 + 3О2 →2N2 + 6Н2О кат. 4NН3 + 5О2 → 4NО + 6Н2О NН3 + НCl → NН4Cl амоній хлорид NН3 + НNO3 → NН4NO3 амоній нітрат |
| Способи одержання | У лабораторних умовах одержують із суміші амоній хлориду та кальцій гідроксиду: 2NН4Cl + Са(ОН)2 → СаCl2 + NН3↑ + Н2О У промисловості одержують шляхом прямого синтезу з азоту та водню: N2 + 3H2 ↔ 2NH3 + 92 кДж |
| Застосування | Виробництво нітратних добрив, нітратної кислоти; у медицині; виробництво вибухових речовин; як холодильний агент у холодильних установках |
| Виявлення амоніаку | У результаті взаємодії концентрованого розчину амоніаку з концентрованою хлоридною кислотою з’являється білий дим амоній хлориду: NН3 + НCl → NН4Cl |
Хімічні властивості солей амонію
| Властивості солей амонію | Хімічне рівняння реакції |
| У водних розчинах дисоціюють на йони | NН4NO3 → NН4+ + NO3− |
| Взаємодія з іншими солями | (NH4)2SO4 + ВаСl2 → ВаSO4 + 2NH4Сl |
| Реагують з кислотами | (NH4)2CO3 + 2HCl → NН4Cl + Н2О + CO2 |
| Унаслідок нагрівання розкладаються | NH4Сl → NH3↑ + HСl↑ |
| Реагують з лугами (якісна реакція на йони амонію) | NН4Cl + KОН → KCl + NН3↑ + Н2О |
Характеристика солей амонію
| Назва солі | Хімічна формула | Застосування |
| Амоній хлорид (нашатир) | NН4Cl | Для пайки металів та нанесення на них покриттів, у текстильній промисловості |
| Амоній сульфат | (NH4)2SO4 | Як нітратне добриво |
| Амоній нітрат (амоніакова селітра) | NН4NO3 | Для виробництва вибухових речовин, а також як добриво |
| Амоній карбонат | (NH4)2CO3 | У хлібопеченні, виробництві вітамінів і харчових концентратів, у медицині |
Порівняльна характеристика оксидів Нітрогену
| Ознаки для порівняння | Нітроген (І) оксид N2O | Нітроген (ІІ) оксид NO | Нітроген (ІV) оксид NO2 | Нітроген (ІІІ) оксид N2O3 | Нітроген (V) оксид N2O5 |
| Ступінь окиснення | +1 | +2 | +4 | +3 | +5 |
| Фізичні властивості | Газ без запаху та кольору, розчинний у воді | Безбарвний газ, добре розчинний у воді | Бурий газ із різким запахом | Темно-синя рідина | Тверда кристалічна речовина |
| Хімічні властивості | Несолетво- рний оксид. Нестійкий, легко роз-кладається на кисень і азот: 2N2O → 2N2+ + O2 | Несолетво- рний оксид. Легко приєднує кисень: 2NO + O2→ →2NO2 | Солетво- рний оксид. Добре розчиняється у воді: 2NO2 + +H2O → →HNO3 + +HNO2 У присут- ності на- длишку кисню: 4NO2+О2+ +2H2O→ →4НNO3 | Солетво- рний оксид. Взаємодія з водою: N2O3+H2O→ 2 НNO2 нітритна кислота Взаємодія з лугами: N2O3+2КOН→ 2КNO2+ + H2O Солі - нітрити | Солетво- рний оксид. Взаємодія з водою: N2O5+H2O→ →2 НNO3 нітратна кислота Взаємодія з лугами: N2O5+2КOН→ 2КNO3+ + H2O Солі - нітрати |
| Фізіологічна дія | У медицині як нарко-тична речо-вина (весе-лильний газ) | Небезпечні для дихання отрути | Багато нітритів отруйні | Багато нітратів отруйні |
Порівняльна характеристика властивостей нітратної та ортофостатної кислот
| Ознаки для порівняння | Нітратна кислота | Ортофосфатна кислота |
| Фізичні властивості | Безбарвна рідина (внас-лідок зберігання жовтіє). Змішується з водою в будь-яких співвідношеннях. Безводна кислота “димить” на повітрі | Тверда, прозора криста-лічна речовина. Змішується з водою в будь-яких пропо-рціях |
| Хімічні властивості: а) дисоціація на йони; б) взаємодія з металами; в) взаємодія з основними оксидами; г) взаємодія з основами; д) взаємодія із солями; е) термічний розклад | Сильний електроліт: НNO3 → Н+ + NO3− Порівняно з іншими кисло-тами з металами реагує інак-ше (див. схему) CaO + 2НNO3 → Ca(NO3)2 + H2O Fe(OH)2 + 2НNO3 → Fe(NO3)2 + +2Н2O К2СО3 + 2НNO3 → 2КNO3+H2O+ + CO2↑ t, cвітло 4НNO3 ―――→2Н2O+4NO2↑+ + O2↑ | Електроліт середньої сили, дисоціює ступінчасто: Н3РО4 → Н+ + Н2РО4− Н2РО4− → Н+ + НРО42− НРО42− → Н+ + РО43− Реагує тільки з активними металами: 6Na +2Н3РО4→Na3PO4+ 3H2↑ 3CaO + 2 Н3РО4 → Ca3(РО4)2 + + 3H2O Н3РО4 + 3NaOH → Na3PO4 + +3Н2O Н3РО4(надл.) + NaOH → → NaН2PO4 + Н2O 3 К2СО3 + 2Н3РО4 → 2К3PO4 + + 3H2O + 3 CO2↑ t 2Н3РО4 → H4P2O7 + Н2O |
Взаємодія нітратної кислоти з металами
НNO3(розб.) N−3Н4NO3 N20 N+2O не взаємодіє
 |  |  |
Li … Mg Al Zn Cr Fe … Sn Pb H2 Cu … Ag Au Pt
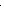 | |||||||
 |  |  | |||||
N2+1O N+4O2 не взаємодіє
НNO3(конц.)
на холоді не реагує – пасивується, внаслідок нагрівання:
Al + 6НNO3 → Al(NO3)3 + 3NO2↑ +3 Н2O
n
Me + НNO3 → Me(NO3)n + Н2O +?
Застосування нітратної кислоти
| Для виготов-лення барв-ників | Для одержан-ня пороху та інших вибу-хових речовин | Для розчинен-ня міді, свин-цю, срібла, які не реагують з іншими кисло-тами | Для виготовлення лікарських препаратів (стрептоцид) | Для одержання добрив |
Застосування ортофосфатної кислоти
| Для виробництва добрив | Для виготовлення кормових добавок | У харчовій промисловості (наприклад, для надання кислуватого присмаку безалкогольним напоям) |
Розклад нітратів
| 2KNO3 → 2KNO2 + O2↑ (нітрати лужних металів) Cu(NO3)2 → 2CuO + 4NO2 + O2↑ 2AgNO3 → 2Ag +2NO2 + O2↑ (нітрати благородних металів) |
Солі ортофосфатної кислоти (фосфати)
| первинні | вторинні | третинні |
| NaH2PO4 натрій дигідрогенфосфат | Na2HPO4 натрій гідрогенфосфат | Na3PO4 натрій фосфат |
Застосування нітратів та фосфатів
| Назва та формула солі | Застосування |
| натрій нітрат НNO3 | Як добриво (натрієва селітра); для виробництва вибухових речовин; у харчовій промисловості |
| натрій фосфат Na3PO4 | Для пом’якшення води; для видалення масла й жиру з одягу |
| натрій гідроген фосфат Na2HPO4 | У харчовій промисловості; у фармацевтичній промисловості |
Добрива
| мінеральні | органічні | ||
| Селітри, рідкий амоніак, солі амонію та ін. | Гній, послід, зелені добрива | ||
| Класифікація елементів, що входять до складу добрив | |||
| Мaкроелементи (Нітроген, Фосфор, Калій) | Проміжні елементи (Кальцій, Магній, Сульфур) | Мікроелементи (Бор, Купрум, Ферум, Манган, Молібден, Цинк) | |
| Характеристика добрив | |||
| Назва | Хімічна формула | Вміст основної поживної речовини | |
| Фосфатні добрива | |||
| Фосфоритне борошно | Ca5F(PO4)3 | P2O5 ― 19-25 % | |
| Суперфосфат простий | Ca(H2PO4)2 ∙ H2O + Н3РО4 +
+ CaSO4 | P2O5 ― 16-20 % | |
| Суперфосфат подвійний | Ca(H2PO4)2 ∙ H2O + Н3РО4 | P2O5 ― 38-50 % | |
| Нітратні добрива | |||
| Амоніакова селітра (амоній нітрат) | NН4NO3 | N ― 32-35 % | |
| Амоній сульфат | (NH4)2SO4 | N ― 20-21 % | |
| Натрієва селітра (натрій нітрат) | NaNO3 | N ― 16 % | |
| Хлористий амоній (амоній хлорид) | NН4Cl | N ― 24-25 % | |
| Сечовина | CO(NH2)2 | N ― 42-46 % | |
| Калійні добрива | |||
| Хлористий калій (калій хлорид) | KCl | K2O ― 50-62 % | |
| Калій сульфат | K2SO4 | K2O ― 48-52 % | |
| Каїніт | KCl ∙ MgSO4 ∙ 3H2O + NaCl | K2O | |
| Змішані та складні добрива | |||
| Нітрофоска | NН4NO3 + CaHPO4 + + СаСО3 + KCl або NН4NO3 + CaHPO4 + + (NH4)2HPO4 + CaSO4 ∙ ∙ 2H2O + KCl або NН4NO3 + (NH4)2HPO4 + + KCl | N ― 12-20 % P2O5 ― 10-14 % K2O ― 10-21 % | |
| Амофоска | (NH4)2HPO4 ∙ (NH4)2SO4 + + KCl | N ― 11-12 % P2O5 ― 11-16 % K2O ― 15-20 % | |
Характеристика мікроелементів
| Мікроелемент | Значення для рослин | Вміст у добривах |
| Бор | Нестача в ґрунті спричиняє за-хворювання в рослин (відми-рання верхівки у льону, гниль серцевини кормового буряка та ін.); знижує врожайність | 1. У борній кислоті (Н3ВО3) та бурі (Na2B4O7). 2. Зола, торф, гній (1кг золи містить 200 – 700 мг Бору, 1 кг гною і торфу – близько 20 мг Бору |
| Цинк | Нестача призводить до захво-рювання рослин (зменшення розмірів листків та їх знебар-влення), вповільнення їх росту | 1. Промислові відходи. 2. Сірчанокислий та хлористий цинк |
| Манган | Нестача в ґрунті спричиняє жовтизну листків картоплі, капусти, томатів. На відсутність Мангану особливо реагують пшениця, овес, кукурудза, пло-дові рослини | 1. Марганцеве добриво одержують зі шламу (MnO2, MnO та органічні речовини). 2. Манган сульфат, манган хлорид, манган нітрат |
| Купрум | Відсутність у ґрунті спричиняє захворювання у злаків – “білу чуму”; чутливі до нестачі Куп-руму злаки, плодові дерева | 1. Купрумовмісні руди. 2. Мідний купорос |
НЕМЕТАЛИ ЧЕТВЕРТОЇ ГРУПИ
ЕЛЕМЕНТИ VІ ГРУПИ ГОЛОВНОЇ ПІДГРУПИ
КАРБОН ТА СИЛІЦІЙ
Порівняльна характеристика будови атомів
Карбону та Силіцію
| Атом Карбону С | Атом Силіцію Si | |
| Розміщення електронів на енергетичних рівнях | +⑥)) 2 4 | +⑮))) 2 8 4 |
| Електронна формула | 1S22S22P2 | 1S22S22P63S23P2 |
| Розміщення електронів на орбіталях |
2S2 2P2
             
|
3S2 3P2
              3d0
3d0


|
| Розміщення електронів на орбіталях в атомах Карбону | Ступінь окиснення | |
| Можливі ступені окиснення Карбону |
1S2 2S2 2P2
                      +6С
1S2 2S1 2P3 +6С
1S2 2S1 2P3
                      +6С +6С
| +2 ―4; +4 |
Особливості алотропних форм вуглецю
| Алмаз | Графіт | Карбін |
| У кристалічній гратці ко-жен атом Карбону оточе-ний чотирма іншими. Атоми розміщені на од-накових відстанях один від одного і дуже міцно зв’язані між собою кова-лентними зв’язками. Цим пояснюється значна твердість алмаза | Атоми Карбону розмі-щені паралельними ша-рами. Відстань між сусід-німи шарами набагато більша, ніж між сусід-німи атомами в шарі. Це зумовлює незначну міц-ність зв’язку між шарами, тому графіт легко розще-плюється на тонкі лусоч-ки, які самі по собі до-сить міцні | Це чорний порошок із включеннями більших за розмірами кристалів зі скляним блиском. Крис-тали карбіну складають-ся з ланцюжків атомів Карбону, сполучених одинарними та потрій-ними зв’язками, що чер-гуються. За твердістю пе-реважає графіт, але по-ступається алмазу |
Порівняльна характеристика Карбону та Силіцію
| Ознаки для порівняння | Карбон | Силіцій |
| Поширення в природі | Зустрічається в природі як у вільному стані (вміст у земній корі – 0,02 %), так і у сполуках (переважно в карбонатах). У вільному кристалічному стані зуст-річається у вигляді алмазу (окремі кристали) та гра-фіту (утворює потужні пок-лади) | У вільному стані не зустрі-чається. Головні природні сполуки: силіцію діоксин та солі силіцієвих кислот. Другий за поширеністю в природі елемент (29,5% маси земної кори) |
| Фізичні властивості | Утворює кілька алотропних форм, які відрізняються фізичними властивостями | Тверда речовина з харак-терним блиском. Існує в аморфному та кристаліч-ному станах. Гарний напів-провідник |
| Хімічні властивості а) взаємодія з металами; б) взаємодія з неметалами (киснем, воднем) в) відновні влас-тивості (легко відновлює мета-ли з їх оксидів у процесі нагріва-ння) | 4Al + 3C → AL4C3 алюміній карбід 2С + O2 → 2СO карбон (ІІ) оксид С + O2 → СO2 карбон (ІV) оксид C + 2H2 → CH4 метан ZnO + C → Zn + CO | 3Ca + Si → Ca2Si кальцій силіцій Si + O2 → SiO2 Si + 2H2 → SiH4 силан ― |
| Застосування | Алмаз застосовують: для різання скла; для свердління твердих порід: у ювелірній справі (добре відшліфовані прозорі кристали – діаманти – є коштовним камінням). Графіт застосовують: в електротехніці для виготовлення електродів; як мастильний матеріал; для виробництва грифелів для олівців | Силіцій застосовують: як напівпровідник; у металур-гії (як відновник, а також для одержання кислото-тривких сталей); для ви-робництва сонячних бата-рей, які перетворюються сонячну енергію на елект-ричну |
Вуглецеві матеріали
| Кокс | Деревне вугілля | Сажа | Природне вугілля |
| Твердий пористий матеріал, який одержують шля-хом прожарюван-ня вугілля без дос-тупу повітря. Скла-дається переваж-но з чистого вугле-цю. Використову-ється як паливо, відновник – у ме-талургії | Форма вуглецю, яку одержують у результаті прожа-рювання дереви-ни або інших ма-теріалів рослин-ного або тварин-ного походження без доступу повіт-ря. Використову-ється як вбирач газів | Карбоновмісний продукт непов-ного згоряння, що складається з час-тинок чорного ко-льору. Застосову-ється в лакофар-бовій, поліграфіч-ній промислово-сті, як наповнювач у процесі вулкані-зації каучуку | Природний про-дукт з високим умістом Карбону. Найдавніше дже-рело енергії. Яв-ляє собою міне-рал, що утворився з речовин рослин-ного походження. Існує кілька видів вугілля: буре вугі-лля, кам’яне вугі-лля, антрацит (найбагатший на Карбон) |
Основні види палива
| Газоподібне | Рідке | Тверде |
| Природний, водяний, коксовий гази | Нафта та нафтопродукти | Деревина, кам’яне вугілля, буре вугілля, торф, горючі сланці |
Характеристика адсорбції
| Адсорбція – поглинання поверхнею адсорбента розчинених речовин. |
| Процес адсорбції протікає тим інтенсивніше, чим більшою є поверхня адсорбенту. Для збільшення поверхні адсорбент подрібнюють або роблять пористим | Адсорбенти: деревне вугілля, активоване вугілля |
| Активоване вугілля використовують: для очищення повітря від отруйних речовин (це було використано М.Д. Зелінським у фільтрувальному протигазі в період Першої світової війни); для вловлювання бензину з природних газів; у вигляді таблеток застосовують у разі отруєнь та шлункових захворювань для виведення шкідливих речовин з організму; як каталізатор |
Порівняльна характеристика
карбон (ІІ) оксиду та карбон (ІV) оксиду
| Ознаки для порівняння | Карбон (ІІ) оксид СO (чадний газ) | Карбон (ІV) оксид СO2 (вуглекислий газ) |
| Фізичні властивості | Безбарвний газ, без запаху, трохи легший за повітря, ма-лорозчинний у воді, на пові-трі горить блакитнуватим полум’ям | Безбарвний газ, без запаху, у 1,5 раза важчий за повітря, добре розчинний у воді |
| Фізіологічна дія | Отруйний. Його отруйна дія полягає в тому, що він нео-боротно взаємодіє з гемо-глобіном крові, яка після цього втрачає здатність пе-реносити кисень від легень до тканин | Не отруйний, але люди та тва-рини в разі великої його кон-центрації задихаються: в разі 3%-ї концентрації у повітрі в людини спостерігається часте дихання, а в разі 10%-ї – втрата свідомості та смерть |
| Промисловий спосіб одержання | Одержують шляхом газифі-кації твердого палива:
СО2 | Одержують з допомогою термічного розкладу вапняку або крейди: СаСО3 → СаО + СО2 Також одержують, спалюючи вугілля, торф, нафтопродукти та ін.. |
| Застосування | Входить до складу штучного газоподібного палива, а та-кож використовується в ор-ганічному синтезі | У промисловості для одержан-ня соди, виготовлення безал-когольних напоїв |
Солі карбонатної кислоти
| Карбонати | Гідрогенкарбонати |
| Na2CO3 – натрій карбонат | NaHCO3 – натрій гідрогенкарбонат |
| CaCO3 – кальцій карбонат | Ca(HCO3)2 – кальцій гідрогенкарбонат |
Хімічні властивості карбонатів
| Розклад у наслідок нагрівання | CaCO3→ СаО + СО2 Ca(HCO3)2 → CaCO3 + СО2 + H2O |
| Взаємодія із солями | К2СО3 +CaСl2 → CaCO3↓ + 2KCl |
| Якісна реакція: взаємодія карбонатів і гідрогенкарбона-тів із хлоридною кислотою з бурхливим виділенням вугле-кислого газу | К2СО3 +2НСl → 2NaCl + СО2↑ + H2O КHСО3 +НСl → KCl + СО2↑ + H2O |
| Взаємоперетворення карбонатів і гідрогенкарбонатів | |
н.у.
  CaCO3 + СО2 + H2O Ca(HCO3)2
Нагрівання CaCO3 + СО2 + H2O Ca(HCO3)2
Нагрівання
|
Види твердості води
| Твердість води зумовлюється наявністю, головним чином, солей Кальцію та Магнію | |
| Карбонатна (тимчасова) твердість пов’язана з наявністю гідрогенкарбо-натів Кальцію та Магнію | Некарбонатна (постійна) твердість пов’язана з наявністю сульфатів і хлоридів Кальцію і Магнію |
| Способи усунення: | |
| 1) дією натрій карбонату: Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaНСО3 2) дією кальцій гідроксиду: Ca(HCO3)2 + Са(ОН)2 → 2CaCO3↓ + 2H2O 3) кип’ятінням: Ca(HCO3)2 → CaCO3 ↓+ СО2↑ + H2O Mg(HCO3)2 → MgCO3↓ + СО2 ↑+ H2O | Усувають дією натрій карбонату: CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4 MgSO4 + Na2CO3 → MgCO3↓ + Na2SO4 |
Застосування карбонатів
| Назва солі | Хімічна формула | Властивості | Застосування |
| Калій карбонат (поташ) | К2СО3 | Білий, гігроскопічний порошок, розчинний у воді | Використовується у виробництві скла та рідкого мила |
| Натрій карбонат (сода) | Na2CO3 | Білий порошок або білі кристали, добре розчинні у воді | У виробництві хімічних продуктів, у милова-рінні, скляній, тексти-льній промисловості, у побуті |
| Натрій гідрогенкарбонат (питна сода) | NaHCO3 | Білий порошок добре розчинний у воді, внаслідок нагрівання розкладається на натрій карбонат, воду та карбон (ІV) оксид | У медицині, хлібопе-ченні, для наповнення вогнегасників |
| Кальцій карбонат | CaCO3 | У воді практично нерозчинний | Як будівельний мате-ріал, для одержання кальцій оксиду та вуг-лекислого газу |
Хімічні властивості силікатів
| Взаємодія з кислотами | Na2SiO3 + H2SO4 → Na2SO4 + H2SiO3↓ |
| Взаємодія з солями | Na2SiO3 + CaCl2 → 2NaCl + CaSiO3↓ |
МЕТАЛИ
ЗАГАЛЬНІ ВЛАСТИВОСТІ МЕТАЛІВ
Спільні фізичні властивості зумовлені однакови типом зв’язку в простих речовинах – металічним зв’язком. Метали проводять електричний струм, добре проводять тепло, ковкі, мають характерний металічний блиск.
Частина атомів у кристалічних ґратках металу йонізована, вільні електрони рівномірно розподілені по всьому кристалу. Цей “електронний газ”, немов клей, зв’язує катіони металу.
Спільні хімічні властивості металів зумовлені тим, що зовнішній енергетичний рівень їхніх атомів заповнений електронами менш ніж наполовину. Тому металам легше віддавати, а не приєднувати електрони. Металічні властивості посилюються під час руху в Періодичній таблиці зверху вниз за підгрупами та справа наліво за рядами.
Поширеність металічних елементів та їх сполук у природі
| Метали в природі | |
| У самородному стані (малоактивні Au, Ag) | У складі хімічних сполук – руд: оксидні Fe3O4, сульфідні FeS2 та інші |
Спільні хімічні властивості металів
Метали взаємодіють:
1) з киснем з утворенням оксидів 2Сu + O2 → 2CuO
2) з галогенами з утворенням галогенідів 2Al + 3Cl2 → 2AlCl3
3) з сіркою з утворенням сульфідів Hg + S → HgS
| Реагують з водою Нерозчинні у воді Li K Ca Na ǀ Mg Al Zn Fe Cr Sn Pb ǀ H Cu Ag Hg Au Реагують з кислотами (розчинами) Не реагують з кислотами |
Корозія металів, захист від корозії
Корозія – це руйнування металу під дією зовнішнього середовища з часом
Способи захисту металів від корозії.
1. Механічний: покривання поверхні щільною плівкою, наприклад, фарбою.
2. Електрохімічний: покривання менш активного металу тонким шаром більш активного – навіть при порушенні цілісності плівки більш активний метал, що руйнується у першу чергу, захищає менш активний (наприклад: оцинковане залізо).
3. Хімічний: пасивація поверхні деяких металів (обробка спеціальними окисниками для утворення щільної плівки хімічно інертного оксиду).
 Метал 1. Фарба або лак.
Метал 1. Фарба або лак.
Плівка 2. Більш активний метал.
3. Хімічно інертний оксид.
Загальні методи добування металів
З руди метал зазвичай переводять в оксид, який потім відновлюють:
1) вуглецем (кокс): Fe3O4 + 4C → 3Fe + 4CO↑
2) карбон (ІІ) оксидом: ZnO + CO → Zn + CO2
3) воднем: CuO + 2H2 → Cu + 2H2O
4) алюмінієм (алюмотермія): 3Fe3O4 + 8Al → 9Fe + 4Al2O3
Електроліз – це окисно-відновний процес, який відбувається під дією постійного електричного струму. Катіони отримують електрони від катода, аніони віддають електрони аноду.
Деякі метали (в тому числі найбільш активні) одержують електролізом розплавів їх сполук:
2NaCl → 2Na +Cl2↑ 2Al2O3 → 4Al + 3O2↑
(з додаванням NaF для зниження температури плавлення).
МЕТАЛИ ГОЛОВНИХ ПІДГРУП
Лужні метали ― І група, головна підгрупа

 Li
Li





 ― е Р Na
― е Р Na
+① S K



 Rb
Rb
 Cs
Cs
мала електронегативність, радіус відновні
легко віддають електрони атома властивості
Електрохімічний ряд напруг металів
! Li, Cs, K, Na
велика енергія гідратації
Фізичні властивості: легко ріжуться ножем; на зрізі – білого кольору з срібним металічним блиском, який зникає на повітрі із-за окиснення
Знаходження в природі: найбільш поширений Na,
K – в 2 рази, Li – в 100 разів менше
NaCl – кухонна сіль
Na2SO4 ∙ 10H2O – глауберова сіль
NaNO3 – чилійська селітра
Na3AlF6 – кріоліт
Na2B4O7 – бура
Калійні добрива:
KCl – cильвін
КCl ∙ NaCl ― сильвініт
Хімічні властивості: дуже активні, найсильніші відновники:
1) взаємодія з киснем – на холоді покриваються плівкою оксиду
Rb, Сs ― самозаймаються
2Na + O2 → Na2O2
4Li + O2 → 2Li2O
2) взаємодія з галогенами – з виділенням великої кількості тепла
2Na +Cl2 → 2NaCl
3) взаємодія з сіркою при нагріванні
2Li + S → Li2S
4) літій легко взаємодіє з азотом
6Li + N2 → 2Li3N
5) взаємодія з воднем при слабому нагріванні
2Na +H2 → 2NaH
6) взаємодія з водою (легко окиснюються навіть Н+ води)
2Na + 2H2O → 2NaOH +H2
Добування: так як ці елементи найсильніші відновники, для того, щоб відновити з сполук – електроліз розплавів солей
катод: Na+ + е → Na0
анод: Сl− - e → 1/2Cl2 ↑
1+ Сполуки лужних металів
Лужні метали – найсильніші відновники, не існує сполук, здатних передати електрон йонам лужних металів, їх сполуки не проявляють окиснювальних властивостей
| Луги – тверді кристалічні речовини, типово йонні сполуки, сильні основи (NaOH – їдкий натр, каус-тична сода). Добування: 1) електроліз водного розчину NaCl: катод: 2Н2О + 2е → Н2↑+ +2ОН− анод: 2Сl− - 2e → Cl2 ↑ сумарна реакція ― 2Н2О + 2NaCl → Cl2↑+ + Н2↑+ 2NaOH 2) каустифікація соди: Na2CO3 + Са(ОН)2 → → 2NaOH + СаСО3↓ | Солі – типово йонні сполуки, як правило – добре розчинні у воді. Утворені слабими кислотами – гідролі-зуються. | Якісна реакція: забарвлення полум’я Li – червоне Na – жовте K – фіолетове |
Лужноземельні метали ― ІІ група, головна підгрупа

 Ве – Аl погано взає -
Ве – Аl погано взає -





 ―2 е Р Mg – Zn подіють з во -
―2 е Р Mg – Zn подіють з во -
+② S Ca дою




 Sr лужнозе -
Sr лужнозе -
 Ba мельні ме -
Ba мельні ме -
Ra тали
Мала електронегативність, радіус металічні
легко віддають електрони атома властивості
Фізичні властивості: кальцій – легкий білувато-сірий метал, пластичний, але більш твердіший ніж лужні – як Сu
Знаходження в природі: кальцій відноситься до числа найбільш поширених елементів
СaSO4 ∙ 2H2O – гіпс
СaСO3 – крейда, мармур, вапняк
Сa3(РО4)2 – фосфорит
_____
Хімічні властивості: активні, сильні відновники – майже як лужні:
1) взаємодія з киснем (при звичайній температурі)
2Сa + O2 → 2СaO
2) взаємодія з галогенами – з виділенням великої кількості тепла
Сa +Cl2 → СaCl2
3) взаємодія з сіркою
Са + S → СаS (кальцій сульфід)
4) взаємодія з азотом
3Са + N2 → Са3N2 (кальцій нітрид)
5) взаємодія з воднем
Сa +H2 → СaH2
6) взаємодія з водою (легко окиснюються навіть Н+ води)
Сa + 2H2O → Сa(OH)2 +H2↑
як активний метал, шо стоїть до Гідрогену
Сa + 2НСl → СaCl2 +H2↑
Добування: так як кальцій сильний відновник, добування можливе тільки шляхом електролізу розплавів солей, звичайно сполук – СaCl2
_______________________________________________________________
2+ Сполуки кальцію
Ці сполуки – найсильніші відновники, не проявляють окиснювальних властивостей
| Кальцій оксид СаО “негашене вапно” Добування: СаСО3 → СаО + СО2 1) СаО – як основний оксид: СаО + Н2О → Сa(OH)2 (гашене вапно) СаО + SiО2 → СaSiO3 2)при високих температурах: CaO +3 Сa → CaC2 + СО↑ кальцій карбід | Кальцій гідроксид Сa(OH)2 “гашене вапно” Добування: СаО + Н2О → Сa(OH)2 (гашене вапно) Сильна основа. Розчин у воді має сильнолужну реакцію. “Вапняна во-да”– одна з найдешев-ших основ | Якісна реакція: Сa(OH)2 + СО2 → СаСО3↓+ +H2O при дальшому пропус-канні – розчиняється СаСО3+ СО2 + Н2О → → Са(НСО3)2 |
Твердість води
(накип, не утворює піни – 2С17Н35СООNa + CaSO4 → (С17Н35СОО)2Ca↓ +Na2SO4)
карбонатна – тимчасова некарбонатна - постійна
Са(НСО3)2, Mg(НСО3)2, Fe(НСО3)2 CaCl2, CaSO4, MgCl2, MgSO4
  кип’ятінням видален- додаванням соди
Са(НСО3)2→ СаСО3+ СО2↑ + Н2О ня твер- СаSO4 + Na2CO3 →
дості, → СаСО3↓ + Na2CO3 додаванням соди “помягше- MgSO4 + Na2CO3 →
Са(НСО3)2 + Na2CO3 → СаСО3+ ння”води → MgСО3↓ + Na2CO3
+2NaHCO3 кип’ятінням видален- додаванням соди
Са(НСО3)2→ СаСО3+ СО2↑ + Н2О ня твер- СаSO4 + Na2CO3 →
дості, → СаСО3↓ + Na2CO3 додаванням соди “помягше- MgSO4 + Na2CO3 →
Са(НСО3)2 + Na2CO3 → СаСО3+ ння”води → MgСО3↓ + Na2CO3
+2NaHCO3
|
Алюміній ― ІІІ група, головна підгрупа
 В неметал
В неметал






 ―3 е Р Аl амфотерні властивості
―3 е Р Аl амфотерні властивості
 +③ S Ga метали, оксиди, яких
+③ S Ga метали, оксиди, яких




 In не проявляють амфо -
In не проявляють амфо -
 Tl терних властивостей
Tl терних властивостей
[Ne] 3S23P1 радіус металічні
атома властивості
Фізичні властивості: срібно-білий метал, пластичний, легкий (2,7 г/см3), добре проводить тепло та електричний струм. Температура плавлення = 660 оС
Знаходження в природі: багато гірських порід по своєму складу – алюмосилікати (Аl, O, Si, лужні та лужноземельні)
глини – Аl2O3 ∙ nSiO2
боксити – Аl2O3 ∙ nH2O
нефеліни – КNa3[AlSiO4]4<






