АТОМІВ ЕЛЕМЕНТІВ ПЕРШИХ ТРЬОХ ПЕРІОДІВ
| ЕНЕРГЕТИЧНИЙ РІВЕНЬ | ЕНЕРГЕТИЧНИЙ ПІДРІВЕНЬ | КІЛЬКІСТЬ ОРБІТАЛЕЙ

 НА ПІДРІВНІ НА РІВНІ НА ПІДРІВНІ НА РІВНІ
|  МАКСИМАЛЬНА КІЛЬКІСТЬ ЕЛЕКТРОНІВ МАКСИМАЛЬНА КІЛЬКІСТЬ ЕЛЕКТРОНІВ
 НА ПІДРІВНІ НА РІВНІ НА ПІДРІВНІ НА РІВНІ
| ||
| 1(K) | S | ||||
| 2(L) | S | ||||
| P | |||||
| 3(M) | S | ||||
| P | |||||
| d | |||||
| 4(N) | S | ||||
| P | |||||
| d | |||||
| f |
S – орбіталі мають сферичну форму;
P – орбіталі мають форму гантелі;
d, f… − орбіта лі мають форму пелюстків квітки.
Електрони розміщуються на різних відстанях від ядра, формуючи електронні шари, або рівні. Рівні розщеплюються на підрівні, що мають орбіта лі різної форми.
Початок періоду: атоми металів легко віддають електрони, утворюючи позитивно заряджені йони (катіони) – проявляють металічні властивості.
Кінець періоду: атоми неметалів легко приймають електрони, утворюючи негативно заряджені йони – проявляють неметалічні властивості.
Періодична зміна властивостей пояснюється певною повторюваністю в заповненні зовнішніх електронних шарів.
В групах зверху донизу:
 Li ― збільшується число електронних рівнів;
Li ― збільшується число електронних рівнів;
Na ― збільшуються радіуси атомів;
K ― послаблюється притягання електронів до ядра;
Rb ― послаблюється здатність приєднувати електрони;
Cs ― посилюються металічні властивості.
Металічні властивості зростають зверху донизу і справа наліво.
|
Неметалічні властивості зростають зліва направо і знизу доверху.
|
Ізотопи – різновиди атомів одного й того самого елемента, що мають однаковий заряд ядра, але різне масове число.
Електрон − це елементарна частинка з найменшим негативним електричним зарядом, який тільки може існувати (1,602 ∙ 10−19 Кл); маса електрона дорівнює 9,11 ∙ 10−31 кг.
ПАМ’ЯТКА – ПЛАН
ДЛЯ СКЛАДАННЯ ХАРАКТЕРИСТИКИ ЕЛЕМЕНТІВ
ЗА ПОЛОЖЕННЯМ У ПЕРІОДИЧНІЙ СИСТЕМІ ТА БУДОВОЮ АТОМІВ
I. Назва елемента, його символ, відносна атомна маса Аr.
II. Положення у періодичній системі:
1) порядковий номер;
2) номер періоду;
3) номер групи, підгрупа.
ІІІ. Будова атома:
1) заряд ядра;
2) кількість протонів, електронів, нейтронів;
3) електронна формула, коміркова структура зовнішнього шару;
4) кількість електронних рівнів;
5) кількість електронів на зовнішньому рівні, кількість електронів, що не вистачає до завершення.
ІV. Метал чи неметал:
властивості простої речовини:
| для металів | для неметалів |
| a) з киснем; б) з неметалами; в) з кислотою. | а) з киснем; б) з металами; в) з воднем. |
V. Вищий оксид:
1) формула, місце у класифікації (характер);
2) властивості:
| для основних оксидів | для амфотерних оксидів | для кислотних оксидів |
| а) з водою; б) з кислотними оксидами; в) з кислотами. | а) з кислотами; б) з лугами. | а) з водою; б) з основними оксидами; в) з лугами. |
VІ. Вищий гідроксид:
1) формула, місце у класифікації (характер);
2) властивості:
| для основ | для амфотерних гідроксидів | для кислот |
| а) з кислотами; б) з кислотними оксидами; в) з солями. | а) з кислотами; б) з лугами; в) розклад за температури | а) з основами; б) з основними оксидами; в) з солями; г) з металами. |
VІІ. Воднева сполука.
Для металів:
а) метали головних підгруп утворюють гідриди, нелеткі сполуки;
б) метали побічних підгруп не утворюють водневі сполуки.
Для неметалів:
а) неметали ІІІ, ІV груп утворюють леткі сполуки;
б) неметали V групи утворюють леткі сполуки;
в) неметали VІ, VІІ груп утворюють леткі сполуки – кислоти.
РОЗЧИНИ
Розчини – гомогенні термодинамічно стійкі системи змінного складу, що складаються з двох і більше компонентів.
Розчинник – речовина, кількість якої переважає і агрегатний стан якої не змінюється під час утворення розчину.
Стійкість визначається розміром розприділених частинок:
10―9м → молекулярні, істинні розчини; розчини електролітів;
10―7м → колоїдні розчини;
10―4м - 10―5м → суспензії (тверді в рідині); емульсії (рідкі в рідкому)
Процес утворення розчину є проміжним між хімічним і фізичним процесами. Д.І. Менделєєв розробив гідратну теорію, згідно з якою під час утворення розчинів відбуваються не тільки фізичні, а й хімічні процеси.
У процесі розчинення частинки речовини, що розчиняється, утворюють з молекулами розчинника відносно нестійкі сполуки, які часто мають змінний склад і називаються сольватами (якщо розчинником є вода – гідратами).
Під час розчинення речовини відбуваються такі процеси: зв'язок між частинками (молекулами, атомами, йонами) у речовині, яка розчиняється, та розчиннику руйнується, що супроводжується поглинанням теплоти; одночасно утворюються сольвати, внаслідок чого виділяється теплота; далі відбувається розподіл сольватованих частинок речовини, яка розчиняється, в розчиннику, що супроводжується поглинанням теплоти. Загальний тепловий ефект процесу розчинення буде позитивним або негативним залежно від того, що переважатиме: тепловий ефект сольватації частинок, чи сума теплових ефектів дифузії та руйнування зв’язків між частинками речовини, яка розчиняється.

Розчинення, розчинність подібне розчиняється в подібному






 розчинення
розчинення

 Надлишок тверда речовина тверде в розчині над твердою
Надлишок тверда речовина тверде в розчині над твердою

 кристалізація речовиною
кристалізація речовиною
Насиченими називаються розчини, що перебувають в стані рівноваги з надлишком речовини, яка розчиняється.
Ненасиченими називаються розчини, в яких розчинювала речовина, що добавляється, може ще розчинятися.
Перенасиченим називають розчин, в якому розчиненої речовини міститься більша кількість, ніж її може розчинятися за даних умов.
Концентрація розчиненої речовини – це відношення кількості або маси розчиненої речовини до об’єму розчину.
Молярна концентрація (М) – це відношення кількості розчиненої речовини до об’єму розчину (моль/л).
Молярна концентрація еквівалента (Сек., н) – це відношення еквівалентної кількості розчиненої речовини до об’єму розчину (моль/л).
Склад розчину можна виразити як концентрацією, так і часткою розчиненої речовини.
Масова частка (W) – це відношення маси розчиненої речовини до маси розчину. Масову частку виражають у частках одиниці або у відсотках.
ТЕОРІЯ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ
(С. Арреніус, 1887р.)
Основні положення сучасної теорії електролітичної дисоціації.
1. У результаті розчинення у воді (або в іншому полярному розчиннику), а також у процесі розплавлення електроліти розпадаються на позитивно та негативно заряджені йони. Процес розпаду електролітів на йони називають електролітичною дисоціацією.
2. У розчинах йони утворюються з полярних молекул та йонних кристалів речовин, а в розплавах – лише з речовин з йонним типом зв’язку.
3. У водних розчинах йони оточені гідратною оболонкою – гідратовані йони.
4. Йони у водному розчині або розплаві рухаються хаотично. Якщо в розчин або розплав електроліту занурити електроди й додати електричної напруги, то рух йонів стає спрямованим: позитивно заряджені йони рухаються до катода (негативно зарядженого електрода) й називаються катіонами, а негативно заряджені йони – в напрямку анода (позитивно зарядженого електрода) та називаються аніонами.
5. Дисоціація – оборотній процес.
6. Електрична провідність розчинів і розплавів електролітів зумовлена наявністю позитивно й негативно заряджених йонів, що вивільнюються внаслідок електролітичної дисоціації, тобто електролітів – це провідники з йонною провідністю.
ПАМ’ЯТКА ДЛЯ НАПИСАННЯ РЕАКЦІЙ ОБМІНУ МІЖ РОЗЧИНАМИ ЕЛЕКТРОЛІТІВ
Реакції йонного обміну – хімічні реакції, що відбуваються в розчинах електролітів за участі йонів без зміни ступенів окислення елементів.
Умови протікання реакцій йонного обміну “ до завершення”
(правило Бертоллє)
| Коли утворюються речовини, що практично не дисоціюють та залишають сферу реакції | Реакція не протікає | |
| 1.Осад _____________ 2.Летка речовина _____________ 3.Слабкі електроліти | Нерозчинні або малорозчинні сполуки __________________________ Леткі кислоти: HCl, HF, HBr, HI, H2S, HNO3. Нестійкі кислоти: ↗ Н2О Н2СО3 ↘ СО2 ↗ Н2О Н2SО3 ↘ SО2 __________________________ Н2О, СН3СООН, NH3 | Суміш йонів, реакція не протікає Na2SO4 + KCl Йони: Na+, SO42−, K+, Cl−. |
Умовна класифікація електролітів залежно від ступеня дисоціації
| Сильні електроліти – під час розчинення у воді цілком дисоціюють на йони: α > 30% | Слабкі електроліти – під час розчинення у воді погано дисоціюють на йони: α < 30% |
| Усі розчинні солі, багато мінеральних кислот (HCl, HBr, HI, HNO3, Н2SО4, НMnO4, HClO4), луги (KOH, NaOH) | Деякі мінеральні кислоти (Н2СО3, H2S, Н2SіО3, HNO2), майже всі органічні кислоти, багато бінарних сполук, гідроксиди металів |
Алгоритм складання йонного рівняння реакцій
1. Запишіть молекулярне рівняння реакції, звертаючи особливу увагу на правильність складання формул речовин, що утворюються. Перевірте за валентністю. Розставте коефіцієнти.
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
2. За допомогою таблиці розчинності визначте розчинність кожної речовини.
р р н р
3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
3. Складіть повне йонне рівняння. Для цього прості речовини, оксиди, нерозчинні солі та слабкі електроліти запишіть у молекулярному вигляді (Н2, СаО, АgCl, H2O), а розчинні солі, луги, сильні кислоти – в йонному.
3Na+ + 3OH− + Fe3+ + 3Cl− → Fe(OH)3↓ + 3Na+ + 3Cl−
4. Складіть скорочене йонне рівняння. Для цього потрібно відкинути (закреслити) йони, що не беруть у реакції безпосередньої участі (однакові у правій та лівій частинах повного йонного рівняння).



 3Na+ + 3OH− + Fe3+ + 3Cl− → Fe(OH)3↓ + 3Na+ + 3Cl−
3Na+ + 3OH− + Fe3+ + 3Cl− → Fe(OH)3↓ + 3Na+ + 3Cl−
3OH− + Fe3+ → Fe(OH)3↓
Примітка.
1. Малорозчинні солі, основи та інші сполуки з йонним типом зв’язку є сильними електролітами, тобто дисоціації піддаються.
2. Сума електричних зарядів йонів у лівій частині рівняння має дорівнювати сумі електричних зарядів йонів у правій частині.
3. Умови протікання до завершення реакцій обміну в розчинах електролітів:
― утворення осаду;
― виділення газу;
― утворення води або іншого слабкого електроліту.
Властивості кислот, основ і солей
у світлі теорії електролітичної дисоціації
| Електроліти | Характерні спільні йони | Характерні властивості |
| кислоти | Н+ | Діють на індикатори (лакмус – червоний). Реагують з йонами ОН− з утворенням води Н+ + ОН− → H2O |
| основи (луги) | ОН− | Діють на індикатори (лакмус – синій, фенолфталеїн – малиновий). Реагують з йонами Н+ з утворенням води ОН− + Н+ → H2O |
| солі | спільних йонів нема | Спільні хімічні властивості відсутні. |
НЕМЕТАЛИ ШОСТОЇ ГРУПИ
ЕЛЕМЕНТИ VІ ГРУПИ ГОЛОВНОЇ ПІДГРУПИ
ОКСИГЕН ТА СУЛЬФУР
Порівняльна характеристика будови атомів
Оксигену й Сульфуру
| Протонне число | Хімічний символ | Будова атома | Будова електронних оболонок | Прості речовини | Властивості простих речовин |
| +8 | О | +⑧)) 2 6 |
   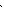 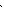 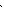              2S2 2P4
1S2
1S22S22P4 2S2 2P4
1S2
1S22S22P4
| О2 – кисень О3 - озон | газ, малорозчинний у воді, без запаху і кольору газ, нестійкий, без кольору, з запахом свіжості |
| +16 | S | +⑯))) | 3    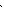 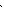 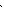        S2 3P4 3d0 S2 3P4 3d0
   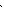 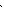 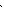              2S2 2P6
1S2
1S22S22P6
3S23P4 2S2 2P6
1S2
1S22S22P6
3S23P4
| S8 – кристалічна S - пластична | Жовтий порошок, не змочується водою, неелектро− провідний коричнева пластична маса |
Алотропні форми кисню
| Ознаки для порівняння | кисень О2 | озон О3 |
| Фізичні властивості | Газ без запаху, безбарвний, у товстих шарах блакитнуватий | Газ із гострим характерним запахом, має блакитнуватий колір навіть у невеликих кількостях |
| Фізіологічна дія | Забезпечує життєдіяльність організмів | У невеликих кількостях корисний, оскільки вбиває хвороботворні організми, у великих – має отруйну дію |
| Хімічні властивості | Активний: сполучається майже зі всіма елементами (виняток – інертні гази) | Сильний окисник. Його активність пояснюється тим, що його молекула легко розщеплюється: О3 → О2 + О |
| Застосування | Для дезінфекції під час оброблення води | У металургії, медицині тощо |
Алотропні форми сірки
| ромбічна | моноклінна | пластична |
| Найбільш стійка за звичайних умов | Утворюється внаслідок нагрівання ромбічної сірки до температури, вищої за 96оС. у разі охолодження знову повертається до ромбічної форми | Киплячу сірку (444,6оС) виливають у холодну воду, утворюється пластична сірка, яка легко розтягується на зразок гуми |
Поширення сірки в природі
| У водах мінеральних джерел, морів, океанів | У нафті та кам’яному вугіллі | Входить до складу білкових молекул живих організмів | У складі природних сполук |
Хімічні властивості сірки
| Властивість | Рівняння реакції | Тип реакції |
| 1.Взаємодія з неметалами: а)гідрогеном, б)оксигеном. | Сірка – окисник S + Н2 → Н2S гідроген сульфід (сірководень) Сірка – відновник S + О2 → SО2 + Q сульфур (ІV) оксид 2S +3 О2 → 2SО3 сульфур (VІ) оксид | сполучення сполучення |
| 2.Взаємодія з металами. | Сірка – окисник
3S +2 Al → Al2S3
алюміній сульфід
S + 2Na → Na2S
натрій сульфід
3S0 +2 Al0 → Al2+3S3−2
 S0 + 2ē → S−2 3 окисник
Al0 - 3ē → Al+3 2 відновник S0 + 2ē → S−2 3 окисник
Al0 - 3ē → Al+3 2 відновник
| сполучення термохімічне окисно-відновне |
Застосування кисню
1. У виробництві синтетичних миючих засобів.
2. Добування нітратної та сульфатної кислот.
3. У металургії (сталь, чавун).
4. Випалювання руд.
5. Для зварювання металів.
6. У медицині, космосі, підземні, підводні роботи.
Застосування сірки
1. Виробництво сульфатної кислоти.
2. Виробництво барвників, гуми, чорного пороху, сірників.
3. Виробництво ліків, солей.
4. У шкіряному виробництві (Na2S, ВаS).
5. Для вулканізації каучуку.
6. У сільському господарстві для боротьби зі шкідниками та захворюваннями рослин.
Сульфур (ІV) оксид, сульфур (VІ) оксид,
їх фізичні та хімічні властивості, застосування
| сульфур (ІV) оксид (сірчистий газ, сульфур діоксид) | сульфур (VІ) оксид (сірчаний ангідрид, сульфур триоксид) |
| SO2 O=S=O 1. Газ, без кольору, отруйний. 2. Має різкий запах. 3. В одному об’ємі води розчиняється 40 об’ємів газу. | SO3 O=S=O ІІ О 1. Безбарвна рідина, що за температури, нижчої за 17 оС, перетворюється на білу кристалічну масу 2. Активно поглинається водою. 3. Уражає дихальні шляхи, спричиняє опіки. |
| Хімічні | властивості |
| 1. Взаємодія з водою: SO2 + H2O ↔ H2SO3 сульфітна кислота 2. Взаємодія з основними оксидами: SO2 + Na2O → Na2SO3 натрій сульфіт 3. Взаємодія з лугами: SO2 + 2NaOH → Na2SO3 + H2O натрій сульфіт | 1. Взаємодія з водою: SO3 + H2O → H2SO4 сульфатна кислота 2. Взаємодія з основними оксидами: SO3 + СаO → СаSO4 кальцій сульфат 3. Взаємодія з лугами: SO3 + 2КOH → К2SO4 + H2O калій сульфат |
| Застосування | |
| Для відбілювання різноманітних виробів, знищення плісняви та різних шкідливих грибів | Для одержання органічних сполук |
| Способи одержання | |
| 1) В результаті взаємодії концентрованої сульфатної кислоти з металами: t Cu + 2H2SO4 → CuSO4 + SO2↑ +2H2O купрум (ІІ) сульфат 2) Внаслідок окиснення сульфідів: 2ZnS +3 O2 → 2ZnO +2 SO2 | 1) В результаті окиснення сірчистого газу киснем повітря: Кат. 2SO2 + O2 ↔ 2SO3 2) внаслідок окиснення SO2: SO2 + NO2→ SO3 +NO |
Сульфатна кислота
H2SO4 Н – О О
\ //
S
/ \\
Н – О О
Мr(H2SO4) = 98
М(H2SO4) = 98 г/моль
Двоосновна, оксигеновмісна кислота.
Фізичні властивості: безбарвна рідина, важка (ρ = 1, 84 г/см3), нелетка, добре розчинна у воді.
Обережно! При розчиненні не можна вливати воду в концентровану сульфатну кислоту.
Хімічні властивості сульфатної кислоти
| Властивість | Рівняння реакції | Тип реакції |
| 1. Дисоціація у водному розчині. | І стадія: H2SO4 ↔ Н+ + НSO4― ІІ стадія: HSO4―↔ Н+ + SO42― | |
| 2. Взаємодія з металами (в ряді активності до Гідрогену). | Mg + H2SO4→ MgSO4 + H2 магній сульфат | заміщення |
| 3. Взаємодія з основними оксидами. | Zn + H2SO4→ ZnSO4 + H2O цинк сульфат | обміну |
| 4. Взаємодія з лугами. | 2NaOH + H2SO4 → Na2SO4 + 2H2O натрій сульфат | обміну |
| 5. Взаємодія з нерозчинними основами. | Сu(OH)2 + H2SO4 → СuSO4 + H2O купрум сульфат | обміну |
| 6. Взаємодія з солями (слабких кислот). | К2СО3 + H2SO4 → К2SO4 + H2O + СО2 | обміну |
| Na2СО3+H2SO4 → Na2SO4 +H2O +СО2 2Na+ + СО32− + 2H+ + SO42− → 2Na+ + + SO42− + H2O + СО2 СО32− + 2H+ → H2O + СО2 | йонного обміну |
Cпецифічні властивості сульфатної кислоти
| Ряд активності металів: K, Na, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au | |
| Me + H2SO4 (концентрована) | |
| З металами, що в ряді активності – до Гідрогену: відновлюється до SO2, S, Н2 S залежно від умов | З металами, що в ряді активності – після Гідрогену: відновлюється тільки до SO2 |
| Якісна реакція H2SO4 + ВаСl2 → ВаSO4↓ + 2HСl утворюється білий нерозчинний у воді та кислотах осад Ва2+ +SO42― → ВаSO4↓ Висновок: реактивом на аніон SO42― є катіон Ва2+. |