При взаимодействии ВМС с растворителем происходит их набухание.
Набуханием называется увеличение объема и массы полимера во времени при контакте с растворителем.
При набухании объем и масса полимера могут увеличиться в 10 – 15 раз.
Количественной мерой набухания является степень набухания а:
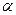 =
= 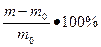 или
или 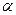 =
= 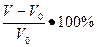 ,
,
где т  , V
, V  – масса и объем сухого полимера; т, V – масса и объем набухшего полимера.
– масса и объем сухого полимера; т, V – масса и объем набухшего полимера.
Набухание может быть ограниченным и неограниченным. В случае ограниченного набухания т и 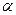 достигают постоянных при данной температуре и концентрации предельных значений т
достигают постоянных при данной температуре и концентрации предельных значений т 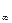 и
и 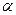
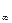 (кривая 1 на рис. 13.1) и далее не меняются. При неограниченном набухании (кривая 2 на рис. 13.1) т и
(кривая 1 на рис. 13.1) и далее не меняются. При неограниченном набухании (кривая 2 на рис. 13.1) т и 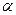 достигают максимальных значений, которые затем уменьшаются за счет растворения полимера. Таким образом, в этом случае набухание является первой стадией растворения.
достигают максимальных значений, которые затем уменьшаются за счет растворения полимера. Таким образом, в этом случае набухание является первой стадией растворения.
 Причина набухания состоит в различии свойств ВМС и растворителя. Молекулы ВМС отличаются от молекул НМС на несколько порядков по размерам и по подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, в то время как молекулы растворителя быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем. Гибкость цепей облегчает проникновение малых молекул НМС в сетку полимера. Итак, процесс набухания представляет собой одностороннее смешение, обусловленное
Причина набухания состоит в различии свойств ВМС и растворителя. Молекулы ВМС отличаются от молекул НМС на несколько порядков по размерам и по подвижности. Поэтому переход макромолекул в фазу растворителя происходит очень медленно, в то время как молекулы растворителя быстро проникают в сетку полимера, раздвигая цепи и увеличивая его объем. Гибкость цепей облегчает проникновение малых молекул НМС в сетку полимера. Итак, процесс набухания представляет собой одностороннее смешение, обусловленное
|

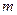
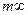
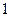
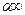
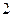
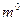
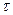
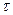
большим различием в размерах молекул.
Следует подчеркнуть, что набухание – это не простое механическое вхождение молекул НМС в пустоты полимера, а межмолекулярное взаимодействие, обусловленное, главным образом, сольватацией макромолекул. Поэтому процесс набухания всегда специфичен: полимер набухает не в любом, а лишь в «хорошем» растворителе, с которым он взаимодействует. Так, полярные полимеры набухают в полярных жидкостях, например, белки в воде, а неполярные – в неполярных (каучук в бензоле).
Ограниченность процесса набухания и возможность самопроизвольного растворения определяются соотношением между энергией решетки полимера и энергией сольватации с учетом энтропийного эффекта. Так, линейные полимеры обычно неограниченно набухают в «хороших» растворителях, особенно при повышенных температурах, так как работа раздвижения макромолекул в них меньше энергии сольватации.
Пространственные полимеры набухают ограниченно, так как растворение их потребовало бы разрыва химических связей, образующих пространственную структуру, а на такой разрыв энергии сольватации недостаточно. Полимеры, сшитые короткими мостичными связями, как правило, вообще не набухают. Так, натуральный каучук (линейный полимер) неограниченно набухает в бензоле, вулканизированный каучук (пространственная структура) ограниченно набухает в бензоле, а эбонит (сшитый вулканизированный каучук) совсем не набухает.
Введение в полимер полярных групп уменьшает степень набухания в неполярных растворителях и увеличивает — в полярных.
Процесс набухания идет самопроизвольно, т. е. при Р и Т – const
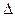 G =
G = 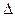 Н – Т
Н – Т 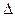 S < 0.
S < 0.
Следует выделить две стадии набухания:
1. Происходит сольватация макромолекул, при этом. выделяется теплота, т. е. 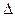 H
H 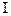 < 0. При этом энтропия не меняется или незначительно уменьшается, т. е,
< 0. При этом энтропия не меняется или незначительно уменьшается, т. е,
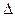 S
S 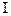
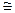 0 (или
0 (или 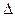 S
S 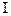 < 0, так как объем системы несколько уменьшается).
< 0, так как объем системы несколько уменьшается).
 |
| 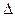 H1 | > | T
H1 | > | T 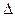 S
S 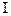 |
| 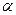 невелика
невелика
Итак, первая стадия обусловлена энтальпийным фактором.
2. Теплота сольватации не выделяется (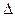 H
H 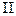
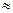 0), но возрастает энтропия системы (
0), но возрастает энтропия системы (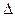 S
S 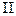 > 0), так как разрыхление сетки полимера увеличивает число конформаций:
> 0), так как разрыхление сетки полимера увеличивает число конформаций:
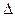 G ii =
G ii = 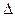 H
H 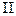 -T
-T 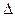 S
S 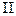 < 0.
< 0.
Таким образом, вторая стадия набухания обусловлена энтропийным фактором.
Набухание может закончиться растворением полимера, в этом случае говорят о неограниченном набухании.
Ограниченно набухший полимер называется студнем (см. следующую главу).
СВОЙСТВА РАСТВОРОВ ВМС
Растворение ВМС является самопроизвольным процессом и приводит к уменьшению свободной энергии системы; если растворение происходит при постоянных давлении и температуре, 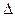 G < 0. Это связано с тем, что при растворении | T
G < 0. Это связано с тем, что при растворении | T 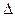 S | > |
S | > | 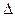 H | и при любом знаке
H | и при любом знаке 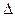 Н имеет место уменьшение свободной энергии Гиббса. Увеличение энтропии (
Н имеет место уменьшение свободной энергии Гиббса. Увеличение энтропии (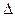 S > 0) при растворении происходит не только вследствие смешения молекул ВМС с молекулами растворителя, но главным образом за счет того, что в растворенном состоянии молекула ВМС приобретает значительно большее число конформаций, чем в твердом состоянии. Таким образом, растворение ВМС сопровождается самопроизвольным диспергированием вещества.
S > 0) при растворении происходит не только вследствие смешения молекул ВМС с молекулами растворителя, но главным образом за счет того, что в растворенном состоянии молекула ВМС приобретает значительно большее число конформаций, чем в твердом состоянии. Таким образом, растворение ВМС сопровождается самопроизвольным диспергированием вещества.
Так как растворение ВМС сопровождается уменьшением свободной энергии, растворы ВМС являются термодинамически устойчивыми и не требуют присутствия стабилизаторов. Более того, растворы ВМС сами часто используются как стабилизаторы.
Растворы ВМС представляют собой истинные растворы, состоящие из отдельных очень больших молекул, по размерам часто превосходящих коллоидные частицы.
Указанные свойства отличают растворы ВМС от коллоидных растворов.
Вместе с тем, следует отметить, что в «плохих» растворителях молекулы
ВМС свертываются в компактные клубки, при этом возникает межфазная поверхность, т. е. система становится гетерогенной. Также в концентрированных растворах вследствие межмолекулярного взаимодействия возникают ассоциаты молекул, которые можно рассматривать как зародыши второй фазы. Растворы ВМС, подобно коллоидным растворам, способны рассеивать падающий свет, а также избирательно поглощать световые лучи.
ПОЛИЭЛЕКТРОЛИТЫ
Полиэлектролитами называются ВМС, способные в растворе диссоциировать с образованием высокомолекулярного иона.
В зависимости от природы содержащихся в полимере групп полиэлектролиты можно разделить на три вида:
1) полиэлектролиты, содержащие кислотную группу, например, – СОО  или – ОSО3
или – ОSО3  ;
;
2) полиэлектролиты, содержащие основную группу, например – NH3+. Такие вещества в природе не встречаются, но могут быть синтезированы;
3) полиэлектролиты, содержащие одновременно как кислотную, так и основную группы (полиамфолиты). Сюда относятся белки, содержащие группы – СОO  и – NН3+.
и – NН3+.
Все высокомолекулярные электролиты растворяются в полярных растворителях.
Важнейшими представителями полиэлектролитов являются белки. Молекулы белков построены на основе аминокислот и содержат основные группы – HONH3 и кислотные группы – СООН:
HONH3 – R – COOH, где R – достаточно длинный углеводородный радикал.
Следует отметить, что ионогенные группы могут располагаться не только на концах макромолекулы, но и в виде коротких боковых цепей, распределенных по всей длине макромолекулы.
В кислой среде (НС1) подавлена ионизация карбоксильных групп, белок ведет себя как слабое основание:
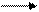 HONH3 – R – COOH + Н+ +NH3 – R – COOH + Н2О.
HONH3 – R – COOH + Н+ +NH3 – R – COOH + Н2О.
Молекула приобретает положительный заряд. Так как между одноименно заряженными группами, разбросанными по всей длине молекулы, действуют силы отталкивания, цепная молекула белка в кислой среде будет стремиться развернуться.
Однако при большом избытке НС1 из – за наличия большого количества хлорид – ионов степень ионизации соединения C1NH3 – R – COOH будет понижаться и молекула снова свернется в более плотный клубок.
В щелочной среде (NaOH) из – за большого количества гидроксид – ионов, ионизация групп HONH3+ – подавлена и белок ведет себя как слабая кислота:
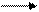 HONH3 – R – COOH+ОН
HONH3 – R – COOH+ОН  HONH3 – R – COO
HONH3 – R – COO  +Н2О,
+Н2О,
приобретая отрицательный заряд. И в этом случае цепная молекула стремится развернуться вследствие электростатического отталкивания групп СОО  .
.
При большом избытке щелочи из – за большого количества ионов Na+ заряд будет уменьшаться и молекула будет находиться в форме клубка.
Таким образом, как в кислой, так и в щелочной среде молекулы белка обладают нескомпенсированным зарядом разного знака. Регулируя рН белкового раствора, можно добиться перевода белка в изоэлектрическое состояние.
Изоэлектрическим состоянием белка называется состояние белковой молекулы, при котором ее положительные и отрицательные заряды взаимно скомпенсированы. Молекулу белка в изоэлектрическом состоянии можно считать нейтральной, хотя, а ней имеются ионизированные группы.
Условно молекулу белка в изоэлектрическом состоянии можйо изобразить так: +NH3 – R – COO 
Изоэлектрическая точка белка (ИТБ) – это значение рН, при котором белок переходит в изоэлектрическое состояние.
Так как белок обычно является более сильной кислотой, чем основанием, его ИТБ лежит при рН < 7. Иначе говоря, для достижения изоэлектрического состояния в растворе должен находиться некоторый избыток кислоты, для подавления ионизации кислотных групп. Так как в ИТБ число ионизированных основных и кислотных групп одинаково, гибкая макромолекула сворачивается в клубок.
На форму макромолекул влияет не только рН среды, но и введение в
раствор индифферентного электролита.
Небольшое количество электролита подавляет ионизацию ионогенных групп и приводит к тому, что форма макромолекул приближается к наиболее статистически вероятным конформациям. При больших концентрациях электролитов происходит высаливание вследствие уменьшения растворимости полимера – макромолекулы образуют плотные клубки. Действие ионов на полиэлектролиты изменяется в том порядке, в котором они стоят в лиотропном ряду.
ЗАКЛЮЧЕНИЕ
Макромолекулы ВМС представляют собой гигантские образования, состоящие из сотен и тысяч атомов, химически связанных между собой.
Все ВМС по происхождению можно разделить на природные, образующиеся при биохимическом синтезе, и синтетические, получаемые искусственно путем полимеризации или поликонденсации.
В зависимости от строения полимерной цепи ВМС делятся на линейные, разветвленные и пространственные.
Подобно истинным растворам низкомолекулярных веществ растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. В этом состоит их отличие отлиофобных коллоидных систем. Термодинамическая устойчивость обусловлена благоприятным соотношением энтальпийного и энтропийного факторов,
ВМС обладают рядом свойств, характерных для дисперсных систем: они способны образовывать ассоциаты, размер которых соизмерим с размерами частиц золей (1 – 100 нм), рассеивают свет, способствуют образованию эмульсий, суспензий и пен, для них характерны диффузия и броуновское движение. В то же время, в отличие отлиофобных золей в растворах ВМС отсутствует гетерогенность, т. е, нет большой межфазной поверхности.
Специфическим свойством, присущим только ВМС, является набухание при взаимодействии с растворителем. Набухание может быть ограниченным и неограниченным. Последнее приводит к растворению полимера.
Существует большое количество ВМС, которые в растворе диссоциируют с образованием высокомолекулярных ионов, они называются полиэлектролитами. В зависимости от природы полимерных групп полиэлектролиты могут быть катионными, анионными и амфотерными. Последние содержат в своем составе одновременно кислотные и основные группы. В зависимости от рН среды они диссоциируют как кислоты или как основания. Состояние, при котором положительные и отрицательные заряды в молекуле белка скомпенсированы, называется изоэлектрическим, а значение рН, при котором молекула переходит в изоэлектрическое состояние, называется изоэлектрической точкой белка (ИТБ).
ВОПРОСЫ ДЛЯ САМОКОНТРОЛЯ
1. Какие соединения называются высокомолекулярными?
2. Как их можно классифицировать по происхождению, но строению
молекул?
3. В чем состоят сходство и различия между растворами
низкомолекулярных и высокомолекулярных соединений?
4. Почему растворы ВМС являются термодинамически устойчивыми?
5. В чем состоят сходство и различия между растворами ВМС и
коллоидными растворами?
6. Какой процесс называется набуханием, и какой величиной оно
характеризуется?
7. В чем состоят особенности ограниченного и неограниченного набухания?
8. Как изменяются энтальпия, энтропия и свободная энергия Гиббса при
набухании?
9. Какие ВМС называются полиэлектролитами?
10. На какие группы делятся полиэлектролиты?
11. Каково строение молекулы белка?
12. Как диссоциирует молекула белка в кислой и щелочной среде?
13. Что называется изоэлектрической точкой белка?
Закончив изучение главы 13, вы должны знать:
• особенности растворов ВМС, их сходство и различия с растворами
низкомолекулярных веществ и золей;
• характер диссоциации разных типов полиэлектролитов в водных
растворах.
ГЛАВА 14
СТУДНИ. СТУДНЕОБРАЗОВАНИЕ
В главе 11 мы рассматривали явление структурообразования в агрегативно неустойчивых системах – золях. Образующиеся при этом структурированные системы называются гелями.
Структурообразование происходит также и в системах, содержащих высокомолекулярные соединения. При этом образуются структурированные системы, называемые студнями.
Процесс образования студней – студнеобразование – есть не что иное, как процесс появления и постепенного упрочнения в застудневающей системе пространственной сетки. Свойства студней во многом сходны со свойствами гелей. Однако имеются и принципиальные различия.
1. Причина застудневания состоит в возникновении связей между отдельными макромолекулами ВМС. Поэтому студни следует рассматривать как гомогенные системы. Гели же образуются в результате взаимодействия коллоидных частиц, поэтому являются системами гетерогенными.
2. В гелях пространственная сетка образуется за счет ван – дер – ваальсовых сил, в студнях – за счет гораздо более прочных химических и водородных связей.
3. Связи в студнях возникают не только на концах макромолекул, но и
между любыми их участками, где имеются группы, способные взаимодействовать между собой. Это, конечно, приводит к различным структурно-механическим свойствам.
ФАКТОРЫ, ВЛИЯЮЩИЕ






