Краткие теоретические сведения
Для любого труднорастворимого электролита (Kt) х (Аn) у между его осадком и насыщенным раствором устанавливается равновесие вида
(Kt) х (Аn) у Û x× Kt z+ + y× Аn z–.
осадок насыщенный раствор
Константа равновесия процесса диссоциации мало растворимого вещества в его насыщенном растворе называется произведением растворимости ПР.
Выражение для произведения растворимости имеет вид
ПР =  (g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
(g + ·[Kt z+ ]) x × (g– ·[Аn z– ]) y, (46)
где а +, а – – активности катиона и аниона; g + , g– – коэффициенты активностей катиона и аниона; [Kt z+ ], [Аn z– ] – равновесные молярные концентрации ионов, моль/дм3.
Поскольку насыщенный раствор труднорастворимого вещества содержит небольшие количества ионов, то есть является достаточно разбавленным, то при расчете ПР активности ионов можно заменить равновесными концентрациями. Тогда уравнение (46) примет вид
ПР = [ Kt z+ ] x × [Аn z– ] y. (47)
ПР электролита при данной температуре есть величина постоянная. Численные значения произведения растворимости большинства труднорастворимых электролитов приведены в справочной литературе.
По величине ПР судят о растворимости электролита: из двух однотипных соединений большей растворимостью обладает то, произведение растворимости которого больше.
Если произведение концентраций ионов (ПРрасч) в каком-либо растворе соли больше, чем табличное значение ПРтабл, то в растворе будет присутствовать осадок данного вещества. И наоборот, если ПРрасч < ПРтабл, то осадок данного вещества растворится.
Равновесные молярные концентрации ионов [Kt z+ ]и [Аn z– ] пропорциональны растворимости вещества L (моль/дм3)
[Kt z+ ] = x × L; [Аn z– ] = y× L. (48)
Отсюда ПР[(Kt) х (Аn) у ] = (x×L) x × (y× L) y;(49)
L = 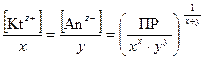 . (50)
. (50)
Примеры решения задач
Пример 1. Вычислите произведение растворимости фторида кальция, если его растворимость в воде равна 0,024 моль/дм3.
Р е ш е н и е
Уравнение диссоциации имеет вид СаF2↓ Û Са2+ + 2F –. Тогда по уравнению (48) равновесные концентрации ионов равны
[Са2+]= L; [ F –]= 2× L.
По формуле (47)
ПР(СаF2) = [Са2+]∙[ F –]2 = L ×(2 L)2 = 4× L 3 = 4 × (0,024)3 = 5,53 × 10-5.
Пример 2. Выпадет ли осадок йодида серебра при 25 °С после сливания 0,1 дм3 0,005 М раствора нитрата серебра и 0,3 дм3 0,002 М раствора иодида калия, если ПР(AgI)табл = 1,1×10-16?
Решение
При сливании указанных реактивов идет реакция
AgNO3 + KI = AgI↓ + KNO3,
Ag+ + I– = AgI↓.
Молярные концентрации ионов в растворах до смешивания равны
[Ag+] = 0,005 моль/дм3; [I–] = 0,002 моль/дм3.
Концентрации ионов в растворах после смешивания
[Ag+] =  =
= 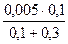 = 1,25∙10-3 моль/дм3;
= 1,25∙10-3 моль/дм3;
[I–] =  =
= 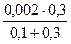 = 1,5∙10-3 моль/дм3 .
= 1,5∙10-3 моль/дм3 .
По формуле (47) находим произведение концентраций ионов (ПРрасч)
ПР(AgI)расч = [Ag+]×[I–]= 1,25∙10-3 ∙1,5∙10-3 = 1,88×10-6.
AgIосаждается, так как соблюдается условие выпадения осадка
ПР(AgI)расч > ПР(AgI)табл.
Пример 3. Вычислите (не учитывая гидролиза) растворимость фосфата бария в моль/л и г/л, а также молярные концентрации ионов в насыщенном растворе данной соли, если ПР [Ва3(РО4)2] = 6,3 · 10-39.
Р е ш е н и е
Фосфат бария диссоциирует по схеме Ва3(РО4)2↓↔ 3Ва2+ + 2РО 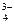 , тогда по формуле (47)
, тогда по формуле (47)
ПР [Ва3(РО4)2] = [Ва2+]3 · [РО 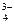 ]2.
]2.
По уравнению (48) равновесные концентрации ионов равны
[Ва2+] = 3× L; [РО 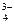 ] = 2× L.
] = 2× L.
Тогда по по формуле (50) L =  моль/л.
моль/л.
Молярная масса фосфата бария М 2(Ва3(РО4)2) = 602 г/моль, тогда растворимость, выраженная в г/л
L = 602 · 9 · 10-9 = 5,42 · 10-6 г/л.
Концентрации ионов [Ва2+] = 3× L = 3 · 9 · 10-9 = 2,7 · 10-8 моль/л;
[РО 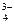 ] = 2× L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
] = 2× L = 9 · 10-9 · 2 = 1,8 · 10-8 моль/л.
Пример 4. Выпадет ли осадок галогенида серебра, если к 1 л 0,1 М раствора [Ag(NH3)2]NO3, содержащему 1 моль аммиака добавить:
а) 1×10–5 моль КВr; б) 1×10–5 моль КI.
Р е ш е н и е
Для решения вопроса о возможности разрушения комплексного иона за счет связывания комплексообразователя в малорастворимую соль необходимо оценить значения равновесных концентраций ионов в рассматриваемой системе. Для этого из справочника [8] выбираем значение константы нестойкости комплекса и произведения растворимости соответствующих солей
К Н([Ag(NH3)2]+) = 5,9 · 10–8; ПР(AgBr) = 5,3 · 10–13; ПР(AgI) = 8,3 · 10–17.
Данная комплексная соль диссоциирует по схеме
[Ag(NH3)2]NO3 ® [Ag(NH3)2]+ + NO 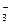 .
.
По определению для комплексного иона [Ag(NH3)2]+
К Н([Ag(NH3)2]+) = 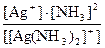 .
.
[NH3] ≈ С2 (NH3) = 1 моль/л, так как концентрация молекул аммиака, образовавшихся вследствие вторичной диссоциации комплексного иона мала.
Из схемы первичной диссоциации следует, что
[[Ag(NH3)2]+] ≈ С 2([Ag(NH3)2]NO3) = 0,1 моль/л.
Тогда концентрация ионов Ag+ равна
[Ag+] = 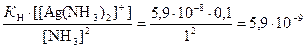 моль/л.
моль/л.
Концентрацию ионов Br –, достаточную для осаждения AgBr найдем из выражения для ПР (AgBr)
[Br –] =  моль/л.
моль/л.
Так как необходимая для осаждения бромида серебра концентрация ионов брома ([Br –] = 8,98×10–5 моль/дм3) больше добавляемой в составе бромида калия ([Br –] = 1×10–5 моль/дм3), то осадок бромида серебра не выпадает.
Концентрацию ионов I–, достаточную для осаждения AgI найдем по аналогии
[I–] = 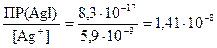 моль/л.
моль/л.
Так как необходимая для осаждения йодида серебра концентрация ионов йода ([I –] = 1,41×10–8 моль/дм3) меньше добавляемой в составе йодида калия ([I –] = 1×10–5 моль/дм3), то реакция разрушения комплексного иона в данном случае будет протекать
[Ag(NH3)2]NO3 + 2КI = AgI↓ + КNO3 + 2NH3.
ГИДРОЛИЗ СОЛЕЙ




