1. Составьте гальванический элемент, в котором бы протекала следующая реакция: Hg2SO4 + 2Cl– = Hg2Cl2 + 
Укажите знаки электродов, запишите электронные реакции, рассчитайте стандартную Э.Д.С. данного элемента.
2. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора Fe2(SO4)3 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер за время 2 часа при t=170С и р=99,75 кПа. Выход по току составил 90%.
3. Составьте схему атмосферной коррозии железа в контакте с медью. Ответ мотивируйте.
4. Составьте гальванический элемент, в котором бы протекала следующая реакция:
5Pb0 + 5SO 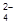 + 2MnO
+ 2MnO 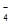 + 16H+ = 2Mn2+ + 8H2O + 5PbSO
+ 16H+ = 2Mn2+ + 8H2O + 5PbSO 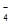
Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
5. Составьте уравнения реакций, протекающих на электродах при электролизе водного раствора CuCl2 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 4 ампер за время 1,5 часа при t=170С и Р=750 мм. рт. ст.
6. Составьте схему атмосферной коррозии Ag в контакте с Cd. Дать соответствующие пояснения.
7. Составьте гальванический элемент, в котором бы протекала следующая реакция:
Pb + 2 OH– + 2AgCl = PbO + H2O + 2Ag + 2Cl–
Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
8. Составьте уравнения реакций, протекающих на электродах, происходящих в водном растворе Pb(NO3)2 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 1,5 ампер? Выход по току 75%, время 1,5 часа, t=270C, Р=760 мм.рт.ст.
9. Составьте схему атмосферной коррозии Mg в контакте с Со. Дать соответствующие пояснения.
10. Вычислить Э.Д.С. гальванического элемента, образованного металлическим электродом Pb/Pb2+ при концентрации [Pb2+]=10-2 г–ион/л в сочетании со стандартным водородным электродом. Определить знаки электродов, написать уравнения электродных процессов.
11. При пропускании тока через раствор NiSO4 в течение 40 мин. на катоде выделилось 30 г Ni. Какой газ и в каком количестве выделится на аноде при Т=170С и Р=740 мм рт. ст. Определите силу тока.
12. Sn склепано с Au. Система находится в агрессивной кислой среде. Какой метал будет корродировать? Почему? Составьте схему коррозии.
13. Вычислить Э.Д.С. гальванического элемента, образованного медным электродом в растворе CuSO4, [Cu2+]=10–1г–ион/л и никелевого электрода в растворе NiSO4,[Ni2+]=10–2г–ион/л. Указать направление движения электронов в составленной схеме данного гальванического элемента.
14. Какова была сила тока при электролизе водного раствора нитрата свинца (II), если в течение 20 мин. был выделен весь металл из 500 мл 0,1 н раствора? Напишите уравнения реакций, протекающих на электродах.
15. Mg склепан с Cu. Деталь находится в H2O с растворимым в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, записать схему коррозии.
16. Вычислить Э.Д.С. гальванического элемента, образованного цинковым электродом в растворе ZnSO4,[Zn2+]=0,01г–ион/л и свинцового электрода в растворе Pb(NO3)2, [Pb2+]=0,1 г–ион/л. Указать направление движения электронов в составленной схеме данного гальванического элемента.
17. Какова была сила тока при электролизе водного раствора сульфата меди, если в течение 10 мин. был выделен весь металл из 250 мл 0,25 н раствора? Напишите уравнения реакций, происходящих на электродах.
18. Zn склепан с Со. Деталь находится в Н2О с растворимым в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, записать схему коррозии.
19. Составьте гальванический элемент, в котором бы протекала следующая реакция: Ag0 + Br– + Co3+ = AgBr + Co2+ Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
20. Составьте уравнения реакции, протекающих, на электродах, происходящих в водном растворе Na2SO4 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер. Выход по току 92%, время – 0,5 часа., t =170С, Р=98,42 к Па.
21. Sn склепано с Bi. Система находится в агрессивной кислой среде. Какой металл будет корродировать? Почему? Составьте уравнения электродных процессов.
22. Для гальванического элемента Ag, AgI/I–//MnO 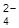 , MnO2 составить уравнение электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
, MnO2 составить уравнение электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
23. Какова была сила тока при электролизе водного раствора Pb(NO3)2 если в течение 20 мин был выделен весь металл из 500 мл 0,1 н раствора. Напишите уравнения реакций, происходящих на электродах.
24. Mg склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, то записать схему коррозии.
25. Для гальванического элемента (Pt) Sn+2, Sn+4//Fe+3, Fe+2(Pt) составьте уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
26. Какова была сила тока при электролизе водного раствора AgNO3 если в течение 15 мин был выделен весь металл из 300 мл 0,5 н раствора. Напишите уравнения реакций, происходящих на электродах.
27. Ti склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему. Если будет, то записать схему коррозии.
28. Вычислите Э.Д.С. гальванического элемента, который образован электродами Zn/Zn+2 при C(Zn2+) = 0,1 г–ион/л и Cu/Cu+2 при C(Cu+2)=0,01 г–ион/л и сравните Э.Д.С. гальванического элемента, образованного нормальными электродами тех же металлов.
29. Составьте уравнения реакций электролиза водного раствора Pb(NO3)2. Какой объем 0,5 М раствора был взят, если для полного превращения электролита потребовалось 1,5 часа? Сила тока равна 4 А.
30. Никель покрыт серебром. Система работает в кислом водном растворе. Будет ли протекать коррозия в системе, если нарушена целостность покрытия? Ответ мотивируйте.
31. Составьте гальванический элемент, в котором бы протекала следующая реакция:
Ge + 2H2O + 2Hg2SO4 = GeO2 + 4H+ + 4Hg + 2SO 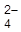 Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
32. Составьте уравнения реакций, протекающих на электродах, происходящих в одном растворе Fe2(SO4)3 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 10 ампер. Выход по току 98%, время 0,6 часа, Т=170С, Р=95,76 кПа
33. Sn склепано с Zn. Система находится в агрессивной кислой среде. Какой металл будет корродировать? Почему? Составить уравнения электродных процессов.
34. Вычислить Э.Д.С. гальванического элемента образованного металлическим электродом Со/Со2+ при концентрации [Co2+] = 0,01 г–ион/л в сочетании со стандартным водородным электродом. Определить знаки электродов, выписать уравнения электродных процессов.
35. При пропускании тока через раствор Cr2(SO4)3 в течение 1 часа на катоде выделилось 26 г Cr. Какой газ и в каком количестве выделится на аноде при Т=270С и Р=720 мм рт. ст. Определить силу тока.
36. Fe склепано с Cu. Система находится в агрессивной кислой среде. Какой металл будет корродировать? Почему? Составьте схему коррозии.
37. Для гальванического элемента (Pt)Cu+, Cu+2//Cl–, Hg2Cl2,Hg составить уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д,С. элемента.
38. Какова была сила тока при электролизе водного раствора CuSO4 если в течение 10 мин был выделен весь металл из 250 мл 0,25 н раствора? Напишите уравнения реакций, происходящих на электродах.
39. Zn склепан с Со. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, то записать схему коррозии.
40. Для гальванического элемента Ag, AgCl, Cl–//MnO 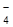 , MnO
, MnO 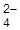 (Pt) составить уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
(Pt) составить уравнения электродных реакций, суммарную реакцию. Рассчитать нормальную Э.Д.С. элемента.
41. Какова была сила тока при электролизе водного раствора Pb(NO3)2, если в течение 20 мин был выделен весь металл из 500 мл 0,1 н раствора? Напишите уравнение реакций, происходящих на электродах.
42. Mg склепан с Cu. Деталь находится в Н2О с растворенным в ней О2. Будет ли наблюдаться коррозия и почему? Если будет, то записать схему коррозии.
43. Составить гальванический элемент, в котором бы протекала следующая реакция:
Pb0 + 2H2O + 4Fe3+ = PbO2 + 4H+ + 4Fe2+. Укажите знаки электродов, запишите электродные реакции, рассчитайте нормальную Э.Д.С. данного элемента.
44. Составьте уравнения реакции, протекающих на электродах, происходящих в водном растворе FeSO4 при нерастворимом аноде. Какие вещества и в каком количестве выделятся на электродах при пропускании тока силой 5 ампер? Выход по току 98%, время 2 часа, t=170С, Р=750 мм рт.ст.
45. Составьте схему атмосферной коррозии Fe в контакте с Cu. Дать соответствующие пояснения.




