1. Определите, при какой температуре начнется реакция восстановления Fe3O4, протекающая по уравнению:
Fe3O4 (K) + CO (Г) = 3FeO (K) + CO2 (Г); 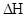 = +34,55 кДж; DS
= +34,55 кДж; DS  = 146,2 Дж/моль
= 146,2 Дж/моль  К.
К.
2. Вычислить, как и во сколько раз уменьшится скорость реакции N2 + O2 = 2NO при уменьшении давления в 100 раз.
3. Константа равновесия гомогенной системы N2 + 3H2  2NH3 при температуре, равной 3000С равна 0,1. Равновесные концентрации водорода и аммиака равны 0,4 моль/л и 0,16 моль/л. Вычислить равновесную и начальную концентрацию азота.
2NH3 при температуре, равной 3000С равна 0,1. Равновесные концентрации водорода и аммиака равны 0,4 моль/л и 0,16 моль/л. Вычислить равновесную и начальную концентрацию азота.
4. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ, вычислите DН  реакции, протекающей по уравнению:
реакции, протекающей по уравнению:
CO (Г) + Н2O (Ж) = CO2(Г) + Н2 (Г)
5. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л; [O2] = 0,02 моль/л. Вычислите начальную скорость реакции и скорость в момент, когда [NO] стала равной 0,005 моль/л.
6. Каким путем можно повысить выход NO2 при реакциях, идущих по уравнениям:
а) 2NO + O  2NO2 – DН;
2NO2 – DН;
б) N2O4  2NO2 + DН
2NO2 + DН
7. Вычислить, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа.
8. При повышении температуры на 100С скорость некоторой реакции взрастет в два раза. При 200С она равна 0,04 моль/л.ч. Какова будет скорость этой реакции при 400С и 00С?
9. Написать выражение для константы равновесия гомогенной системы:
СН4 + CO2  2CO + 2Н2; Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – эндотермическая.
2CO + 2Н2; Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция – эндотермическая.
10. Восстановление Fe3O4 оксидом углерода идет по уравнению: Fe3O4 (К) + СО(Г) = 3FeO(К) + CO2(Г)
Вычислите DG  и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равна DS
и сделайте вывод о возможности самопроизвольного протекания этой реакции при стандартных условиях. Чему равна DS  в этом процессе DG
в этом процессе DG  Fe3O4 = –1014,2 кДж/моль.
Fe3O4 = –1014,2 кДж/моль.
11. При понижении температуры на 300 скорость реакции уменьшилась в 27 раз. Вычислить температурный коэффициент реакции.
12. В гетерогенной системе FeO (Т) + Н2(Г)  Fe (Т) + Н2О(П) равновесные концентрации реагирующих веществ: [Н2] = 0,1 моль/л; [Н2О] (пар) = 0,4 моль/л. Вычислить константу равновесия системы и исходную концентрацию водорода.
Fe (Т) + Н2О(П) равновесные концентрации реагирующих веществ: [Н2] = 0,1 моль/л; [Н2О] (пар) = 0,4 моль/л. Вычислить константу равновесия системы и исходную концентрацию водорода.
13. При какой температуре наступит равновесие системы: СО(Г) + 2H2(Г)  CН3OН(Ж);DН = –128,05 кДж.
CН3OН(Ж);DН = –128,05 кДж.
14. Реакция идет по уравнению N2 + 3H2  2NH3 Концентрации участвующих в ней веществ были: [Н2] = 1,5 моль/л; [N2] = 0,80 моль/л; [NН3] = 1,10 моль/л. Вычислите концентрации Н2 и NН3, когда [N2] стала равной 0,50 моль/л.
2NH3 Концентрации участвующих в ней веществ были: [Н2] = 1,5 моль/л; [N2] = 0,80 моль/л; [NН3] = 1,10 моль/л. Вычислите концентрации Н2 и NН3, когда [N2] стала равной 0,50 моль/л.
15. Равновесие реакции H2 + Br2  2hbr установилось при следующих равновесных концентрациях: [Н2] = 1,5 моль/л;: [Br2] = 0,3 моль/л; [HBr] = 4,8 моль/л. Определить исходные концентрации водорода и брома.
2hbr установилось при следующих равновесных концентрациях: [Н2] = 1,5 моль/л;: [Br2] = 0,3 моль/л; [HBr] = 4,8 моль/л. Определить исходные концентрации водорода и брома.
16. Реакция горения бензола выражается термохимическим уравнением С6Н6 (Ж) + 7  О2(Г) = 6CO2(Г) + 3Н2O(Г); DН =? Вычислите тепловой эффект этой реакции, если известно: что мольная теплота парообразования бензола равна +33,9 кДж.
О2(Г) = 6CO2(Г) + 3Н2O(Г); DН =? Вычислите тепловой эффект этой реакции, если известно: что мольная теплота парообразования бензола равна +33,9 кДж.
17. Взаимодействие окиси углерода и хлора идет по уравнению: СО + Сl2  COCl2
COCl2
Концентрация окиси углерода 0,3 моль/л, а хлора 0,2 моль/л. Как изменится скорость прямой реакции, если увеличить концентрацию хлора до 0,6 моль/л, а концентрацию окиси углерода до 1,2 моль/л?
18. Вычислить константу равновесия для гомогенной системы CO (Г) + Н2O (Г) = CO2 (Г) + Н2 (Г)
если равновесные концентрации реагирующих веществ: [СО] = 0,004 моль/л;
[Н2О] = 0,064 моль/л; [СО2] = 0,016 моль/л; [Н2] = 0,016 моль/л.
19. Напишите термохимическое уравнение реакции между CO (Г) и водородом, в результате которой образуются CН4 (Г) и Н2O (Г). Сколько теплоты выделяется при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия.
20. Если температурный коэффициент скорости реакции равен 2, то во сколько раз возрастет скорость химической реакции при повышении температуры от 2000С (Т1) до 5000С (Т2)?
21. Почему при изменении давления смещается равновесие системы N2 + 3H2  2NH3
2NH3
и не смещается равновесие системы N2 + О2  2NО. Написать выражение констант равновесия каждой из данных систем.
2NО. Написать выражение констант равновесия каждой из данных систем.
Тепловой эффект какой реакции равен теплоте образования NO? Вычислите теплоту образования NO, исходя из следующих термохимических уравнений: 4NH3 (Г) + 5О2 (Г) = 4NO (Г) + 6H2O (Ж), DН = –1168,8 кДж;
4NH3 (Г) + 3О2 (Г) = 2N2 (Г) + 6H2O (Ж), DН = –1530,28 кДж.
22. При 1500 некоторая реакция заканчивается в 10 мин. Принимая температурный коэффициент реакции равным 2,5 рассчитайте, через сколько минут закончилась бы эта реакция при 2000С и при 800С.
23. В гомогенной системе СО + Сl2  COCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Сl2] = 0,3 моль/л; [СОCl2] = 1,2 моль/л. Вычислить константу равновесия системы и исходные концентрации хлора и СО.
COCl2 равновесные концентрации реагирующих веществ: [СО] = 0,2 моль/л; [Сl2] = 0,3 моль/л; [СОCl2] = 1,2 моль/л. Вычислить константу равновесия системы и исходные концентрации хлора и СО.
25. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
Н2 (Г) +  О2 (Г) = Н2 О (Ж); DН = –285,84 кДж;
О2 (Г) = Н2 О (Ж); DН = –285,84 кДж;
С (К) + О2 (Г) = СО2 (Г); DН = –393,51 кДж;
СН4 (Г) + 2О2 (Г) = 2Н2 О (Ж) + СО2 (Г); DН = –890,31 кДж.
26. Константа скорости реакции 2SO2 + O2  2SO3 при некоторой температуре равна 0,0015 л/моль
2SO3 при некоторой температуре равна 0,0015 л/моль  сек. Определите скорость реакции в момент, когда концентрации диоксида серы и кислорода соответственно равны 0,06 и 0,045 моль/л.
сек. Определите скорость реакции в момент, когда концентрации диоксида серы и кислорода соответственно равны 0,06 и 0,045 моль/л.
В гомогенной системе А + 2В  С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислить константу равновесия системы и исходные концентрации веществ.
С равновесные концентрации реагирующих газов: [А] = 0,06 моль/л; [В] = 0,12 моль/л; [С] = 0,216 моль/л. Вычислить константу равновесия системы и исходные концентрации веществ.
28. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия?
29. Химическая реакция протекает в растворе согласно уравнению А + В  С, исходные концентрации: [А] = 0,80 моль/л; [В] = 1,60 моль/л. Спустя 20 мин. концентрация [А] снизилась до 0,78 моль/л. Какова стала концентрация вещества [В]? С какой средней скоростью за это время протекает реакция, если о скорости судить по убыли вещества [А], вещества [В]?
С, исходные концентрации: [А] = 0,80 моль/л; [В] = 1,60 моль/л. Спустя 20 мин. концентрация [А] снизилась до 0,78 моль/л. Какова стала концентрация вещества [В]? С какой средней скоростью за это время протекает реакция, если о скорости судить по убыли вещества [А], вещества [В]?
30. Исходные концентрации [NO] и [Cl2] в гомогенной системе 2NО + Cl2  2NОCl
2NОCl
составляют соответственно 0,5 и 0,2 моль/л. Вычислить константу равновесия, если к моменту наступления прореагировало 20% NO.
31. Вычислить, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа.
32. При повышении температуры на 100С скорость некоторой реакции возрастет в два раза. При 200С она равна 0,04 моль/л.ч. Какова будет скорость этой реакции при 400С и 00С?
33. Написать выражение для константы равновесия гомогенной системы СН4 + СО2  2Н2 + 2СО
2Н2 + 2СО
Как следует изменить температуру и давление, чтобы повысить выход водорода? Прямая реакция - эндотермическая.
34. Тепловой эффект реакции сгорания жидкого бензола с образованием паров воды и диоксида углерода равен –3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (Ж).
35. Примем скорость некоторой химической реакции при 00С за единицу. Чему будет равна скорость той же химической реакции при 2000С, если температурный коэффициент скорости равен 3?
36. Равновесие реакции H2 + Br2  2hbr установилось при следующих равновесных концентрациях: [Н2] = 0,5 моль/л; [Br2] = 0,1 моль/л; [HBr] = 1,6 моль/л. Определить исходные концентрации водорода и брома.
2hbr установилось при следующих равновесных концентрациях: [Н2] = 0,5 моль/л; [Br2] = 0,1 моль/л; [HBr] = 1,6 моль/л. Определить исходные концентрации водорода и брома.
37. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды?
38. Реакция идет по уравнению H2 + J2  2hJ. При 5080С константа скорости этой реакции равна 0,16 л/моль мин. Вычислите начальную скорость реакции, если исходные данные концентрации водорода и йода были равны 0,04 и 0,5 моль/л соответственно. Чему будет равна скорость этой реакции, когда концентрация водорода понизится до 0,03 моль/л?
2hJ. При 5080С константа скорости этой реакции равна 0,16 л/моль мин. Вычислите начальную скорость реакции, если исходные данные концентрации водорода и йода были равны 0,04 и 0,5 моль/л соответственно. Чему будет равна скорость этой реакции, когда концентрация водорода понизится до 0,03 моль/л?
39. Напишите выражение для константы равновесия системы 2Н2О (П)  2Н2 + О2 + DН
2Н2 + О2 + DН
Как следует изменить температуру и давление, чтобы сместить равновесие вправо?
40. При сгорании газообразного аммиака образуются пары воды и оксида азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия?
41. Реакция идет по уравнению: 4НСl + О2 = 2Н2 О + 2Сl2. Через некоторое время после начала реакции концентрации участвующих в ней веществ стали: [НCl] = 0,25 моль/л; [O2] = 0,2 моль/л; [Cl2] = 0,1 моль/л. Какими были концентрации исходных веществ в начальный момент?
42. Константа равновесия гомогенной системы CO (Г) + Н2O (Г) = CO2 (Г) + Н2 (Г) при 850 К равна 1. Вычислить концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх = 3 моль/л; [Н2О]исх = 2 моль/л.
43. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения 1 моль этана С2Н6 (Г), в результате которой образуются пары воды и диоксид углерода. Сколько теплоты выделится при сгорании 1 м3 этана в пересчете на нормальные условия?
44. Две химические реакции при температуре 100С идут с одинаковой скоростью. Скорость первой реакции увеличивается в два раза, второй - в 3 раза при повышении t0 на 10 градусов. При какой температуре скорость второй реакции в два раза превышает скорость первой?
45. Константа равновесия гомогенной системы CO (Г) + Н2O (Г)  CO2 (Г) + Н2 (Г) при некоторой температуре равна 1. Вычислить равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО] = 0,10 моль/л;
CO2 (Г) + Н2 (Г) при некоторой температуре равна 1. Вычислить равновесные концентрации всех реагирующих веществ, если исходные концентрации: [СО] = 0,10 моль/л;
[Н2О] = 0,40 моль/л.
РАСТВОРЫ
1. Кристаллическая сода Na2СO3  10Н2О какой массы потребуется для приготовления раствора объемом 1,2 л, если его: а) молярная концентрация равна 0,2 моль/л; б) эквивалентная концентрация равна 0,2 моль/л?
10Н2О какой массы потребуется для приготовления раствора объемом 1,2 л, если его: а) молярная концентрация равна 0,2 моль/л; б) эквивалентная концентрация равна 0,2 моль/л?
2. 76. Требуется вычислить давление пара раствора, содержащего 0,2 моля сахара в 450 г воды. Давление пара чистой воды при 200С равно 17,5 мм рт.ст.
3. 101. Вычислите величину осмотического давления раствора, в 1 л которого содержится 0,2 моля неэлектролита, если температура раствора 170С.
4. Вычислите молярную концентрацию раствора муравьиной кислоты (рН=3, КД=2,1  10-4).
10-4).
5. Определить нормальность, молярность и моляльность 48% -ного раствора Н2SO4 (р=1,38 г/мл).
6. Медный купорос CuSO4  5H2O какой массы потребуется для приготовления раствора объемом 2 л, содержащего CuSO4 количеством вещества 0,5 моль? Какова молярная концентрация полученного раствора?
5H2O какой массы потребуется для приготовления раствора объемом 2 л, содержащего CuSO4 количеством вещества 0,5 моль? Какова молярная концентрация полученного раствора?
7. Давление пара воды при 200С составляет 17,54 мм рт.ст. Сколько граммов сахара С12Н22О11 следует растворить в 720 г воды для получения раствора, давление пара которого на 0,14 мм рт.ст. ниже давления пара воды?
8. Определите относительную молекулярную массу глюкозы, если осмотическое давление раствора, содержащего
9. Вычислите рН 0,01 %-ного раствора HCl (р=1 г  см-3,
см-3,  =1).
=1).
10. Определить нормальность, молярность и моляльность 17%-ного раствора Н2SO4 (р=1,12 г/см3).
11. Чему равны массы хлорида бария безводного и кристаллогидрата BaCl2  2H2O, которые надо взять для приготовления раствора (p=1,072 г
2H2O, которые надо взять для приготовления раствора (p=1,072 г  см--3) объемом 1,5 л, в котором (BaCl2)=0,08? Какой объем воды потребуется в том и другом случае?
см--3) объемом 1,5 л, в котором (BaCl2)=0,08? Какой объем воды потребуется в том и другом случае?
12. При 420С давление водяного пара 61,5 мм рт.ст. На сколько понизится давление пара при указанной температуре, если в 540 г воды растворить 36 г глюкозы С6Н12О6.
13. Вычислите осмотическое давление раствора сахара С12Н22О11, если 1 л раствора содержит 91 г растворенного вещества, а температура равна 270С.
14. Вычислите рН и рОН 1 М раствора NaOH ( =72,6 %).
=72,6 %).
15. В 2 л воды растворено 49 г H2SO4 (р=1,12 г/см3). Определить процентную концентрацию.
16. Какие массы безводного сульфата меди и медного купороса CuSO4  5H2O потребуются для приготовления раствора (ρ=1,084 г
5H2O потребуются для приготовления раствора (ρ=1,084 г  см--3) объемом 1 л, для которого (CuSO4)=0,08?
см--3) объемом 1 л, для которого (CuSO4)=0,08?
17. Вычислить давление пара 10%-ного водного раствора сахара С12Н22О11 при 1000С.
18. Раствор неэлектролита содержит 1 л 0,12 моля растворенного вещества. Вычислите осмотическое давление раствора, если температура его равна 370С.
19. Какова молярная концентрация раствора соляной кислоты, если рН ее 1,6.
20. Определить нормальность, молярность и моляльность 68% раствора НNO3 (р= 1,4 г/см3).
21. Определите эквивалентную концентрацию 8%-ного раствора гидроксида натрия (p=1,092 г  см--3).
см--3).
22. Определите относительную молекулярную массу анилина, если при 300С давление пара раствора, содержащего 3,09 г анилина в 370 г эфира С4Н10О равно 643,6 мм рт.ст. а давление пара чистого эфира при той же температуре равно 647,9 мм рт.ст.
23. Вычислите осмотическое давление раствора, содержащего в 1 л 0,05 моля растворенного вещества, если температура раствора равна 350С.
24. Вычислите рН для 0,01 М раствора цианистоводородной кислоты, если КД=7,2  10-10.
10-10.
25. К 1 л 10% раствора КОН (р= 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (р= 1,045 г/см3). Объем смеси довели до 2 л. Вычислить молярную концентрацию полученного раствора.
26. Определите нормальную концентрацию 10%-ного раствора серной кислоты (p=1,07 г  см--3).
см--3).
27. Определите моляльность раствора мочевины. Давление пара над раствором при 250С равно 31 гПа. Давление пара воды при этой температуре 31,67 гПа.
28. Вычислите осмотическое давление раствора, содержащего в 1 л 3,1 г анилина С6Н5NН2 при 210С.
29. Чему равна константа диссоциации кислоты, если рН 0,08 н. раствора кислоты равен 2,4.
30. В 250 г воды содержится 15 г NaCl. Определить молярность, нормальность и моляльность раствора (р= 1,18 г/см3).
31. Сколько миллилитров 96%-ного (по массе) раствора H2SO4 (p=1,84 г  см--3) нужно взять для приготовления 1 л 0,25 н раствора?
см--3) нужно взять для приготовления 1 л 0,25 н раствора?
32. Определите массовую долю глюкозы в растворе, если давление пара над ним равно при той же температуре давлению пара раствора, содержащего мочевину массой 1,56 г и воду массой 90 г.
33. Вычислите осмотическое давление 4%-ного раствора сахара С12Н22О11 при 200С, если плотность раствора равна 1,014 г  см--3.
см--3.
34. Какое значение имеет рН для растворов СН3СООН и NH4OH, если их концентрация равна 0,1 моль  л-1 и
л-1 и  =1,3%.
=1,3%.
35. Вычислить молярную и нормальную концентрации 20%-ного раствора хлорида кальция, плотность которого равна 1,178 г/мл.
36. Плотность 40%-ного (по массе) раствора HNO3 равна 1,25 г  см--3. Рассчитать молярность, моляльность этого раствора.
см--3. Рассчитать молярность, моляльность этого раствора.
37. При растворении 0,94 г фенола С6Н5ОН в 50 г спирта точка кипения повысилась на 0,2320. Определите относительную молекулярную массу фенола, если эбуллиоскопическая константа спирта 1,160С.
38. Вычислите, при какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С6Н12О6, достигнет 6 атм.?
39 Определите концентрацию ионов ОН- в 0,01 М NH4ОН. Рассчитайте рН этого раствора при 295К.
40. В 3 л воды растворено 300 г NaCl. Рассчитать молярность, нормальность и моляльность этого раствора (р= 1,071 г/см3).
41. Вычислите массовую долю HNO3 в растворе и моляльность 8 н раствора HNO3, плотность которого равна 1,246 г  см--3.
см--3.
42. Вычислите, на сколько градусов понизится температура замерзания бензола, если в 100 г его растворить 4 г нафталина С10Н8. Криоскопическая константа бензола 5,120С
43. Сколько граммов глюкозы С6Н12О6 содержится в 200 мл раствора, осмотическое давление которого при 370С составляет 8 атм.?
44. Вычислите рН раствора азотной кислоты (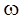 = 0,0005). Плотность раствора и степень диссоциации НNO3 считать равным единице.
= 0,0005). Плотность раствора и степень диссоциации НNO3 считать равным единице.
45. Для нейтрализации 10 мл раствора, содержащего 5,3 г Na2CO3 на 1 л потребовалось 50 мл раствора HСl. Определить нормальность раствора соляной кислоты.
46. Какой объем раствора гидроксида калия с массовой долей КОН 24% (p=1,218 г  см--3) можно приготовить из 125 л раствора гидроксида калия с массовой долей КОН 0,48 (p=1,510 г
см--3) можно приготовить из 125 л раствора гидроксида калия с массовой долей КОН 0,48 (p=1,510 г  см--3)?
см--3)?
47. В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,1040С. Эбуллиоскопическая константа воды 0,5120С.
48. Осмотическое давление раствора, в 250 мл которого содержится 0,66 г мочевины, равно 836 мм рт.ст. при 330С. Вычислите относительную молекулярную массу мочевины.
49. Какое количество гидроксида натрия растворено в 200 мл раствора NaOH, если рН этого раствора 12.
50. В 500 мл воды растворено 100 г Na2CO3 (р= 1,02 г/см3). Определить нормальность, молярность и моляльность полученного раствора.
51. Определите эквивалентную концентрацию, моляльность, и массовую долю Fe2(SO4)3 в растворе, если плотность раствора равна 1,000 г  см--3.
см--3.
52. Раствор, содержащий 5,4 г неэлектролита в 200 г воды, кипит при 100,0780С. Вычислить относительную молекулярную массу растворенного вещества, если эбуллиоскопическая константа воды 0,5120С.
53. Чему равно при 270С осмотическое давление раствора, взятого объемом 1 л и содержащего этиловый спирт массой 23 г, или глюкозу С6Н12О6 массой 36 г?
54. Какая масса НСООН содержится в 0,3 л раствора этой кислоты, имеющей рН 6,04? КД=1,77  10-4.
10-4.
55. Сколько граммов AgNO3 потребуется для взаимодействия с 50 мл 0,1 н раствора NaCl?






